Реферат Химия и экология. Химия и экология. Химия и экология
 Скачать 67.47 Kb. Скачать 67.47 Kb.
|
|
Государственное бюджетное профессиональное образовательное Учреждение города Москвы “Образовательный комплекс Юго-Запад”. Реферат по химии на тему: «Химия и экология». Выполняла: студентка группы ОС-11 Мелишарова П.С. Преподаватель: Копейкина Е.Д. Содержание Введение 3 1. Химическая экология атмосферы 4 1.1. Состав воздуха атмосферы Земли 4 1.2. Основные токсические вещества, содержащиеся в воздухе 5 1.3. Химические реакции в атмосфере 7 1.3.1. Реакции в нижних слоях атмосферы 7 1.3.2. Фотохимические реакции 7 2. Экологическая химия гидросферы 9 2.1. Химический состав природных вод 9 2.2. Показатели качества воды 10 3. Химическая экология педосферы 12 3.1. Химический состав почвы 12 3.2. Экологические последствия загрязнения почв 14 Вывод 15 Источники 16 Введение. Экология – это наука о взаимодействии живых организмов между собой и окружающей их средой. Отношения человека и природы однозначно входят в данное определение. Состояние окружающей среды в течение последних нескольких десятилетий значительно ухудшается в связи с промышленным прогрессом. Из-за слишком быстрого развития промышленности и халатного поведения работников большое количество ГОСТов и нормативных документов по утилизации отходов производства не соблюдаются. Антропогенные изменения в окружающей среде, вызванные перечисленными выше факторами, безусловно сопровождаются химическими процессами. Этим занимается отдельная наука – экологическая химии, которая изучает химические реакции в атмосфере, литосфере, гидросфере, почвах, организме человека и других сферах. Химическая экология атмосферы. Состав воздуха атмосферы Земли. У воздуха атмосферы Земли множество функций: обеспечение кислородом и углекислым газом, необходимыми для энергетики многоклеточных животных и представителей царства Растения; предохранение живых организмов озоном от негативного воздействия ультрафиолетовых волн Солнца. Полный химический состав атмосферы Земли выглядит следующим образом:
Основные токсические вещества, содержащиеся в воздухе атмосферы Земли. Согласно протоколу по стойким органическим загрязнителям к Конвенции 1979 года о трансграничном загрязнении воздуха на большие расстояния стойкими органическими загрязнителями (далее СОЗ) воздуха являются вещества, которые: обладают токсичными свойствами; являются стойкими; биологически аккумулируются, т.е. накапливаются в почве в результате жизнедеятельности растений; предрасположены к трансграничному атмосферному переносу на большие расстояния и осаждению; могут вызывать значительные негативные последствия для здоровья человека или окружающей среды вблизи и вдали от их источников. Основными такими веществами являются оксид серы (IV), оксиды азота, оксид углерода (II), твердые вещества и углеводороды. Эти вещества попадают в атмосферу в таких количествах, что оказывают негативное воздействие на организм человека. Все вышеперечисленные вещества могут поступать в атмосферу в виде атмосферных аэрозолей или газов. Газы – это вещества, находящиеся в состоянии, характеризующемся тем, что молекулы вещества удалены на большие расстояния друг от друга и силы взаимодействия между молекулами очень невелики. Атмосферные аэрозоли – это система твердых или жидких частиц, диспергированных (способствующих рассеиванию вещества). К ним относят: пыль – систему твердых частиц, образующихся при дроблении, размоле, перегрузке сыпучих материалов; дым – дисперсную систему, состоящую из твердых частиц, образующихся в процессе горения угля, нефти, древесины; туман – смесь, состоящую из твердых частиц, паров и воды; мглу – это дисперсную систему, состоящую из капель жидкости (H2O, H2SO3, H2SO4, углеводороды); смог – дисперсную систему, представляюNOщую собой совокупность дыма и тумана, которая может также содержать продукты фотохимических реакций. Химические реакции в атмосфере. Самые основные химические реакции, протекающие в атмосфере Земли можно разделить на 2 категории: реакции, протекающие в нижних слоях атмосферы и фотохимические реакции. Реакции в нижних слоях атмосферы. Большая часть химических реакция связана с работой тех видов автомобильного транспорта, которым для работы необходимо топливо. Оксиды азота образуются в двигателе внутреннего сгорания: 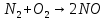 но при выходе из выхлопной трубы газы быстро остывают и образовывается оксид азота (IV): 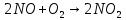 Во время же сжигания серосодержащих видов топлива оксид серы высвобождается и соединяясь с водяным паром образует сернистую и серную кислоты: 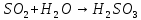 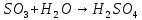 но 90% оксидов серы можно удалить если в выхлопной трубе предусмотрена обработка гашеной известью или известняком: 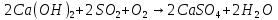 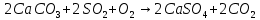 Фотохимические реакции. Фотохимические реакции – это химические реакции, протекающие под действием света. Образование озонового слоя в стратосфере (в слое 11—25 км от поверхности Земли) происходит следующим образом: 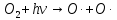 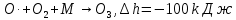 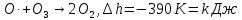 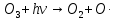 Экологическая химия гидросферы. Химический состав природных вод. Природные воды представляют сложные растворы как органических, так и неорганических соединений, а также близки по составу к океанической воде. Чистой же воды в природе не встречается. Среднестатистический химический состав природных вод включает в себя почти все химические элементы, но 99,78% массы — это:
В воде также присутствуют газы, которые попадают туда из атмосферы. Их можно разделить на хорошо растворимые: углекислый газ и сероводород; и плохо растворимые: кислород, азот, аргон. Показатели качества воды. К основным химическим показателям качества природной воды относят кислотность, щелочность, жесткость, окисляемость и окислительно-восстановительный (редокс-) потенциал. Степень кислотности и щелочности воды определяется по водородному показателю pH:
Кислотность природных вод обусловлена наличием угольной кислоты, а кислотность некоторых видов вод — наличием также гуминовых и других органических кислот. Щелочность природных вод — это способность нейтрализовать ионы водорода. Различают щелочность карбонатную и общую. Карбонатная щелочность – часть общей щелочности, создаваемая карбонатными и гидрокарбонатными ионами. Общая щелочность - сумма анионов всех слабых кислот: угольной, борной, фосфорной и др. Жесткость воды обусловлена присутствием в ней растворенных солей кальция и магния. Под общей жёсткостью понимают суммарную концентрацию Ca2+ и Mg2+, выраженную в мг-экв/л (или градусах жесткости). Классификация природных вод по величине жесткости:
Окисляемость характеризует общее содержание в воде восстановителей (неорганических и органических), реагирующих с сильными окислителями. Окисляемость выражают в миллиграммах кислорода, эквивалентного расходу окислителя на 1 литр пробы. Окисляемость незагрязненных поверхностных вод проявляет довольно отчетливую физико-географическую зональность:
К основным процессам, обеспечивающим жизнедеятельность любого организма, относятся окислительно-восстановительные реакции, то есть реакции, связанные с передачей или присоединением электронов. Окислительно-восстановительный потенциал воды — это показатель ее окислительных (кислотных) либо восстановительных (щелочных) качеств. Химическая экология педосферы. Химический состав почвы. Гумус - совокупность всех органических соединений, находящихся в почве, но не входящих в состав живых организмов или образований, сохраняющих анатомическое строение. Органическое вещество почвы – это совокупность всех органических веществ, находящихся в форме гумуса и остатков животных и растений. 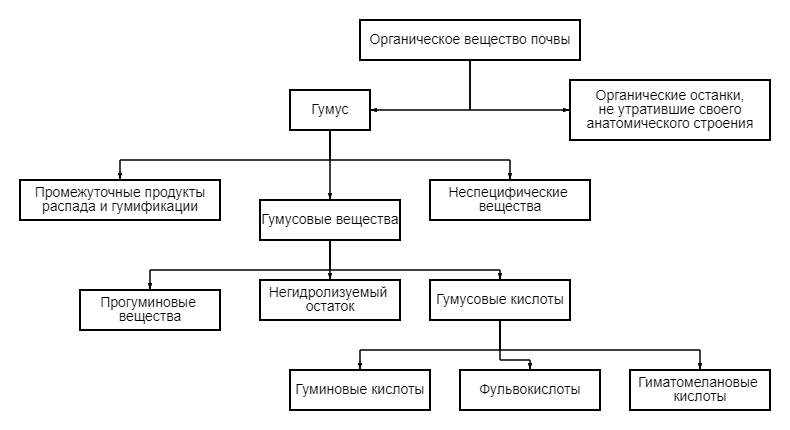 Промежуточные продукты распада и гумификации – соединения, утратившие признаки индивидуальности, но еще не имеющие специфических признаков гумусовых веществ. Неспецифические вещества – группа органических соединений, поступающих в почву в результате разложения растительных и животных остатков, а также с корневыми выделениями и т.п. Специфические гумусовые вещества — это более или менее темноокрашенные, азотсодержащие высокомолекулярные соединения кислотной природы. Прогуминовые вещества – вещества, не имеющие ярко выраженной природы гумусовых кислот. Негидролизуемый остаток включает такие группы веществ как гумусовые кислоты, прочно связанные с минеральной частью, декарбоксилированные гумусовые вещества, утратившие способность растворяться в щелочах, неспецифические и нерастворимые органические соединения, а также частично остатки, не утратившие анатомического строения (обломки хитинного покрова насекомых). Гумусовые кислоты - высокомолекулярные азотсодержащие оксикарбоновые кислоты с интенсивной темно-бурой или красновато-бурой окраской. Гуминовые кислоты (ГК) обладают высокой молекулярной массой. У них более развито ядро молекулы, в состав которого входят бензол, пиррол, пиридин и т.д. Фульвокислоты (ФК) – кислоторастворимая часть гумусовых кислот. Отличаются от гуминовых кислот большим содержанием кислорода и меньшим содержанием углерода, более развитой периферийной частью. Гиматомелановые кислоты (ГМК) занимают промежуточное положение по свойствам между гуминовыми и фульвокислотами. Экологические последствия загрязнения почв. Антропогенное воздействие, прямое или косвенное, как правило, приводит к изменению функций, состава, свойств и режимов почвы, к снижению ее природнохозяйственной значимости, то есть к деградации и появлению убранозёмов. В соответствии с ГОСТ 17.4.3.06-2020 Охрана природы. Почвы. Общие требования к классификации почв по влиянию на них химических загрязняющих веществ по степени возможного отрицательного воздействия на почву, растения, животных и человека все загрязняющие химические вещества антропогенного происхождения подразделяют на три класса опасности: Вещества высоко опасные: мышьяк, кадмий, ртуть, селен, свинец, цинк, фтор, бенз(а)пирен; пестициды: атразин, гексахлорбутадиен, гранозан, ГХЦГ, гептахлор, ДНОК, ДДТ, карбатион, метафос, ПХК, ПХП, севин, тордон, тиодан, ТМТД; Вещества умеренно опасные: бор, кобальт, никель, молибден, медь, сурьма, хром; пестициды: агелон (атразин+прометрин), 2,4-Д, далапон, карбофос, купрозан, кельтан, нитрафен, пропанид, симазин, трефлан, хлорофос, ялан, рогор; Вещества малоопасные: барий, ванадий, вольфрам, марганец, стронций, ацетофенон; пестициды: банвел Д, дактал, дилор, мильбекс, полидим, поликарбацин, прометрин, трихлорацетат натрия, тедион, цинеб, эрадикан. Вывод. Химия и экология – тесно связанные между собой науки и даже образовывают одну целую – химическую экологию. Она изучает химические реакции в атмосфере, литосфере, гидросфере, почвах, организме человека и других сферах. Химический состав воздуха, вод, почвы очень разнообразен, включает в себя огромное количество химических реакций, протекающих в следствие влияние антропогенных факторов окружающей среды. Источники. ГОСТ 27593-88 Почвы. Термины и определения: ГОСТ – Комитет стандартов, мер и измерительных приборов при Совмине СССР, 23 февраля 1988. С-9 Протокол по стойким органическим загрязнителям к Конвенции 1979 года о трансграничном загрязнении воздуха на большие расстояния: Международный протокол – Государства, 24 июня 1998. С-75 Большая медицинская энциклопедия: [в 30 т.]. Т. 29. Дополнительный / гл. ред. Б. В. Петровский; [АМН СССР]. – 3-е изд. – Москва: Советская энциклопедия, 1988. С-544 Кнунянц И. Л. Химическая энциклопедия – Советская Энциклопедия, 1988. С-623 Соколова С. А. Экологическая химия: Учебное пособие. – Воронеж: ФГОУ ВПО ВГАУ, 2008. С-594 Справочник технического переводчика. – Интент. 2009-2013. https://studref.com/592644/matematika_himiya_fizik/kislotnost_prirodnoy_vody Москва, 2022 |
