Хлороводород. Хлороводород, аммиак. Хлороводород Получение хлороводорода
 Скачать 141.52 Kb. Скачать 141.52 Kb.
|
|
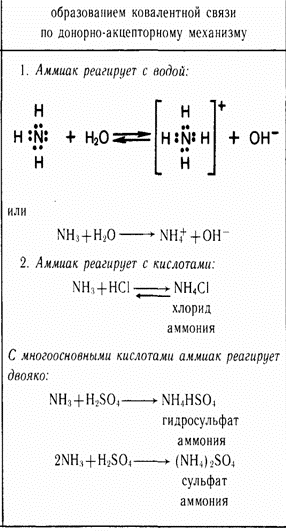
Хлороводород Получение хлороводорода. В лаборатории хлороводород можно получить нагреванием твёрдого хлорида натрия с концентрированной серной кислотой: Реакция хорошо идёт и без нагревания, но при необходимости сосуд с реакционной смесью можно слегка нагреть, выделение хлороводорода будет интенсивным. Из-за большой растворимости хлороводорода в воде необходимо соблюдать технику безопасности (смотри рисунок 1 ниже)!
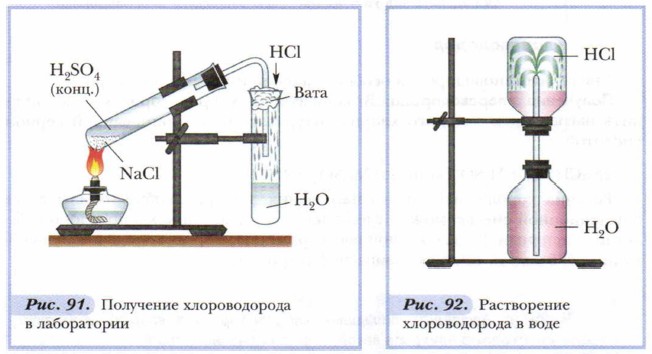 Рисунок 1 - Получение хлороводорода Физические свойства хлороводорода. Хлороводород — бесцветный газ, немного тяжелее воздуха, с резким запахом, дымит во влажном воздухе. Хлороводород относится к числу наиболее растворимых в воде газообразных веществ. В 1 л воды при комнатной температуре может раствориться до 500 л хлороводорода (рисунок 2).  Рисунок 2 – Растворение хлороводорода в воде Раствор хлороводорода в воде называют хлороводородной (соляной) кислотой. Основное применение хлороводорода — получение соляной кислоты. Соляная кислота и ее свойства Получение. Соляную кислоту получают путем растворения хлороводорода в воде (описание выше!). Физические свойства. Растворяя хлороводород в воде, можно получить даже 40% раствор соляной кислоты с плотностью 1,19 г/см3. Однако имеющаяся в продаже концентрированная соляная кислота содержит около 0,37 массовых долей, или около 37% хлороводорода. Плотность данного раствора составляет примерно 1,19 г/см3. Пр разбавлении кислоты плотность ее раствора уменьшается. Концентрированная соляная кислота является бесценным раствором, сильно дымящая во влажном воздухе, обладающая резким запахом вследствие выделения хлороводорода. Химические свойства. Соляная кислота обладает рядом общих свойств, которые характерны большинству кислот. Помимо этого, она обладает некоторыми специфическими свойствами. Свойства HCL, общие с другими кислотами: 1) Изменение окраски индикаторов 2) взаимодействие с металлами 2HCL + Zn → ZnCL2 + H2↑ 3) Взаимодействие с основными и амфотерными оксидами: 2HCL + CaO → CaCl2 + H2O; 2HCL + ZnO → ZnHCL2 + H2O 4) Взаимодействие с основаниями: 2HCL + Cu (OH)2 → CuCl2 + 2H2O 5) Взаимодействие с солями: 2HCL + CaCO3 → H2O + CO2↑ + CaCL2 Специфические свойства HCL: 1) Взаимодействие с нитратом серебра (нитрат серебра является реактивом на соляную кислоту и ее соли); выпадет осадок белого цвета, который не растворяется в воде, ни в кислотах: HCL + AgNO3 → AgCL↓ + HNO3 2) Взаимодействие с окислителями (MnO2, KMnO, KCLO3 и др.): 6HCL + KCLO3 → KCL +3H2O + 3CL2↑ Применение. Огромное количество соляной кислоты расходуется для удаления оксидов железа перед покрытием изделий из этого металла другими металлами (оловом, хромом, никелем). Для того чтобы соляная кислота реагировала только с оксидами, но не с металлом, к ней добавляют особые вещества, которые называются ингибиторами. Ингибиторы – вещества замедляющие реакции. Соляная кислота применяется для получения различных хлоридов. Ее используют для получения хлора. Очень часто, раствор соляной кислоты прописывают больным с пониженной кислотностью желудочного сока. Соляная кислота находится у каждого в организме, она входит в состав желудочного сока, который необходим для пищеварения. В пищевой промышленности соляная кислота применяется только в виде раствора. Она используется для регулирования кислотности при производстве лимонной кислоты, желатина или фруктозы (Е 507). Не стоит забывать, что соляная кислота опасна для кожи. Еще большую опасность она представляет для глаз. Воздействуя на человека, она может вызвать разрушение зубов, раздражение слизистых оболочек, удушье. Помимо этого, соляная кислота активно применяется в гальванопластике и гидрометаллургии (удаление накипи, ржавчины, обработка кожи, химреактивы, в качестве растворителя породы при добыче нефти, при производстве каучуков, глутамината натрия, соды, Сl2). Соляная кислота используется для регенерации Сl2, в органическом синтезе (для получения винилхлорида, алкилхлоридов и т.д.) Она может использоваться в качестве катализатора при получении дифенилолпропана, алкилирование бензола. Аммиак – NH3 Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак. 1. Строение молекулы 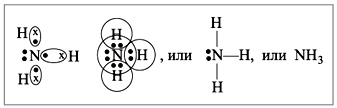 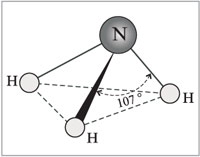 Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+. Вид химической связи: ковалентная полярная, три одинарные σ - сигма связи N-H 2. Физические свойства аммиака При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. 3. Получение аммиака
4. Химические свойства аммиака Для аммиака характерны реакции: с изменением степени окисления атома азота (реакции окисления) без изменения степени окисления атома азота (присоединение)
5. Применение аммиака По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках. Аммиак используется также для получения синтетических волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость. Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен. |