Инженерная энзимология. Инженерная энзимология ферменты как биологические катализаторы
 Скачать 1.48 Mb. Скачать 1.48 Mb.
|
|
| Наименование | Катализируемые реакции | Примеры |
| Оксидоредуктазы | Восстановительные и окислительные процессы | Глюкозооксидаза, каталаза, алкоголь- дегидрогеназа |
| Трансферазы | Перенос различных химических групп от одного субстрата к другому | Протеинкиназа, гликогенфосфорилаза, пируваткиназа |
| Гидролазы | Гидролитическое расщепление химических связей субстратов | Протеазы, амилазы, целлюлазы |
| Лиазы | Отщепление химической группы с образованием двойной связи или, например, присоединение химической группы по двойной связи | Аспартаза, фумараза |
| Изомеразы | Изменения в пределах молекулы субстрата | Глюкозоимераза, триозофосфатизомераза |
| Лигазы (синтетазы) | Соединение молекул субстрата с использованием высокоэнергетических соединений, например, АТФ | ДНК-лигаза, трипто-фансинтетаза |
Ферментативный катализ и основы кинетики
ферментативных реакций
Тысячи различных ферментативных реакций протекают в клетке одновременно и согласованно. Такие реакции могут происходить лишь в тех случаях, когда ферменты способны «распознавать» свой субстрат. Это свойство во многом определяет упомянутый выше принцип «ключа и замка» или «руки и перчатки».
У простых ферментов типа лизоцима каталитическое действие осуществляется таким образом: фермент влияет на конформацию субстрата и переводит его в напряженное состояние, способствующее протеканию реакции. Кроме того, в активном центре сосредоточено много неполярных групп, и эта область действует как органический растворитель. Здесь находится небольшое число заряженных полярных боковых групп аминокислот, реакционная способность которых выше по сравнению с водной средой. Имея большую гибкую молекулу, ферменты способны сосредоточить на небольшом участке необходимые группы для осуществления конкретной реакции с субстратом.
У сложных ферментов, имеющих простатические группы и коферменты, возможности взаимодействия с субстратом увеличиваются. Так, каталаза, которая расщепляет пероксид водорода, имеет прочно связанную с активным центром простетическую группу, представляющую собой порфириновое кольцо с гемогруппой (железо) в центре. Во время катализа простетические группы расщепляются, а затем регенерируются.
Соединение фермента с субстратом в каталитическом центре может происходить с помощью водородных связей, при участии электронов или более слабых взаимодействий, например, сил Ван-дер-Ваальса. Все это означает, что фермент и субстрат в районе каталитического центра должны сблизится до расстояния 1,5-2 нм. В этих условиях внутренние связи в молекуле субстрата ослабляются.
Ферментативная реакция в целом состоит из трех последовательных стадий, а именно: образования фермент-субстратного комплекса; превращения этого комплекса в комплекс фермент - продукт и диссоциации промежуточного продукта.
Механизм действия ферментов состоит в снижении энергии активации, необходимой молекуле, чтобы вступить в реакцию. Согласно существующим теориям (промежуточных соединений, адсорбционной, цепных реакций) снижение энергии активации происходит в результате адсорбции реагирующих веществ на поверхности фермента с образованием промежуточного нестойкого соединения - фермент-субстратного комплекса, что вызывает глубокую деформацию разрываемой связи. При этом фермент является начальным, или «запальным», фактором реакции; в дальнейшем катализируемая им реакция идет уже самостоятельно. Это объясняет тот факт, что для ферментативной реакции достаточна незначительная концентрация энзима.
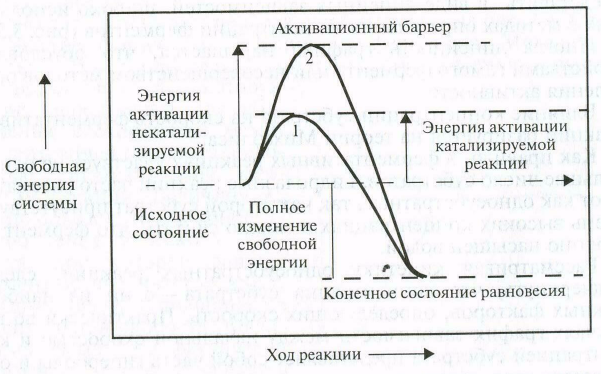
Таким образом, добавление катализатора позволяет молекулам преодолеть активационный барьер (рис. ) на более низком энергетическом уровне (способ «обходного» пути).
Рис. Характеристика энергетического состояния катализирцемой (1) и некатализируемой (2) реакции
При изучении каталитической активности ферментов необходимо основываться на количественной оценке скоростей катализируемых реакций. Изучение влияния различных факторов на скорость данной реакции позволяет сделать вывод о механизме действия ферментов и подобрать наилучшие условия для эффективного действия ферментов.
Влияние различных факторов на функционирование
ферментов
Факторы, определяющие характер течения ферментативных реакций: концентрации фермента и субстрата, рН, температура, наличие активаторов или ингибиторов.
1. Влияние концентрации фермента. При данных условиях две молекулы фермента, действующие в растворе независимо друг от друга, за определенный промежуток времени вызовут превращение в два раза большего количества субстрата, чем одна молекула. Поэтому скорость (v) реакции прямо пропорциональна концентрации фермента Е:'
v = kE
В большинстве случаев графически это можно представить в виде линейных зависимостей, широко используемых в методах определения концентрации ферментов (рис. ).
Иногда линейность графика нарушается, что обусловлено свойствами самого фермента или несовершенством методов опрееледеления активности.
2. Влияние концентрации субстрата на скорость ферментативной реакции базируется на теории Михаэлиса.
Фермент Евначале образует со своим субстратом комплекс ЕS, который затем распадается с освобождением фермента и продуктов реакции:
k+1 k+2
E + S ↔ ES Е + Р
k-1
Р – продукты реакции.
Представление об образовании фермент-субстратного комплекса является главным для всех современных концепций о механизме действия ферментов, которые объясняют закономерности изменения скорости ферментативной реакции.
При очень низких концентрациях субстрата скорость реакции очень мала, но постепенно возрастает по мере повышения концентрации субстрата.
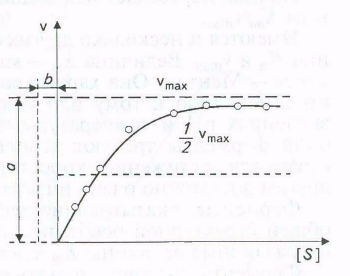
Скорость, когда фермент «насыщен» субстратом, принимают за максимальную (vmaх). Однако сколько бы ни увеличивалась концентрация субстрата, скорость ферментативной реакции приближается к максимальной, но никогда не достигает ее. График зависимости между начальной скоростью реакции и концентрацией субстрата представляет собой часть равнобочной гиперболы (рис.).
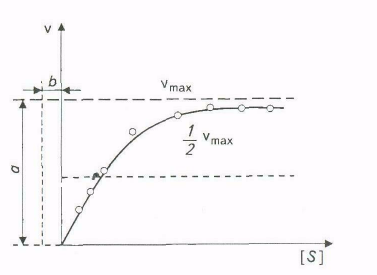
Рис. Зависимость скорости реакции от концентрации субстрата



Эти исследования имеют и большое практическое значение, так как позволяют подобрать наилучшие условия для эффективного действия ферментов.
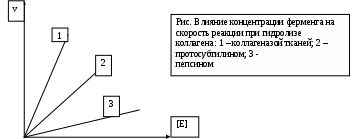
Гис. 3.3. Влияние концентрации
фермента на скорость реакции при
гидролизе коллагена:
' 1 — коллагеназой тканей; 2 — протосубтили-ном;3—пепсином
Факторы, определяющие характер течения ферментативных реакций, многочисленны и разнообразны. К главным из них относятся: концентрации фермента и субстрата, рН, температура, наличие активаторов или ингибиторов.
При данных условиях две молекулы фермента, действующие в растворе независимо друг от друга, за определенный промежуток времени вызовут превра-
_ ————— ___., . -.^^^1»
центрации фермента ([Е\)'.
щение в два раза большего количества субстрата, чем одна молеку
ла. Поэтому скорость (v) реакции прямо пропорциональна кон
ет '
у = ад (3.1)
В подавляющем большинстве случаев графически это можно представить в виде линейных зависимостей, широко используемых в методах определения концентрации ферментов (рис. 3.3).
Иногда линейность графика нарушается, что обусловлено свойствами самого фермента или несовершенством методов опрееле
деления активности.
.
Влияние концентрации субстрата на скорость ферментативной реакции базируется на теории Михаэлиса.
Как правило, в ферментативных реакциях участвует не один, а большее число субстратов. Гидролазные реакции часто рассматривают как односубстратные, так как второй субстрат присутствует в очень высоких концентрациях и можно считать, что фермент постоянно насыщен водой.
сывается уравнением вида:
Рассматривая кинетику односубстратных реакций, следует подчеркнуть, что концентрация субстрата — один из наиболее важных факторов, определяющих скорость. Практически во всех случаях график зависимости между начальной скоростью и концентрацией субстрата представляет собой часть гиперболы и опи-
сывается УПЯКНРНИРМ ПМПЯ-
Фермент Е вначале образует со своим субстратом ^ комплекс Е5, который затем распадается с освобождением свободного фермента и продуктов реакции:
Представление об образовании фермент-субстратного комплекса является главным для всех современных концепций о механизме действия ферментов, которые объясняют закономерности изменения скорости ферментативной реакции.
При очень низких концентрациях субстрата скорость реакции весьма мала, но постепенно возрастает по мере повышения концентрации субстрата. В условиях возрастающих концентраций субстрата каждый раз приращение скорости становится все мень-16 и меньше до бесконечно малого ускорения.
Скорость, когда фермент «насыщен» субстратом, принято при-|нимать за максимальную (утах). В таком состоянии он не может функционировать быстрее.
Эффект насыщения свойствен почти всем ферментам. Однако, сколько бы ни увеличивалась концентрация субстрата, фактически скорость ферментативной реакции приближается к максимальной, но никогда не достигает ее. Практически во всех случаях график зависимости между начальной скоростью реакции и концентрацией субстрата представляет собой часть равнобочной гиперболы (рис. 3.4).
Благодаря тому что гипербола, изображенная на рис. 3.4, имеет •одинаковую форму для большинства ферментов, Михаэлис и Шентен в 1913г. определили константу, обозначаемую в настоя-
Рис. 3.4. Зависимость скорости реакции от концентрации субстрата
Благодаря тому, что гипербола имеет одинаковую форму для большинства ферментов, Михаэлис и Mентен в 1913г. определили константу, Кт, для обозначения соотношения между концентрацией субстрата и скоростью катализируемой ферментом реакции. Величина Кт означает концентрацию субстрата, при которой данный фермент обеспечивает скорость реакции, равную половине ее максимальной скорости. Физический смысл Ктфактически показывает степень сродства фермента и субстрата. Характерная форма кривой насыщения фермента субстратом может быть выражена математически уравнением Михаэлиса-Ментен:
v0 = vmax [S] / (Km + [S]),
где v0 - начальная скорость реакции при концентрации субстрата [S]; vmax - максимальная скорость реакции; Кт - константа Михаэлиса - Ментен для данного фермента, соответствующая определенному субстрату.
Ферментативная реакция состоит из трех последовательных стадий: образования фермент-субстратного комплекса; превращения этого комплекса в комплекс фермент - продукт и диссоциации промежуточного продукта.
Это уравнение было выведено исходя из предположения о том, что стадией, лимитирующей скорость ферментативных реакций, является распад комплекса ЕS на продукты распада и свободный фермент. Уравнение Михаэлиса - Ментен составляет основу для анализа кинетики всех ферментативных реакций. Если известны величины Кти vmax, то можно рассчитать скорость ферментативной реакции при любой заданной концентрации субстрата. Уравнение позволит определить количественные характеристики ферментов и провести анализ их ингибирования.
Для определения vmax и Ктпо данным измерений скорости при различных концентрациях субстрата график уравнения Михаэлиса - Ментен может быть построен несколькими способами. Чаще всего используют метод графического изображения по Лайнуиверу - Бэрку. Если построить график зависимости 1/v от 1/[S] и воспользоваться методом двойных обратных величин, то получится уравнение прямой линии вида:
1 = Km 1 + 1
v0 vmax [S] vmax
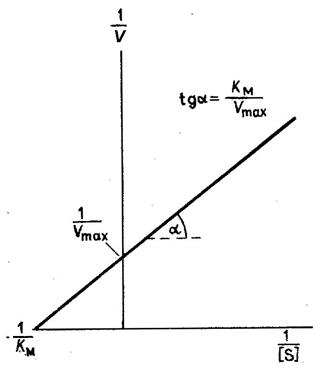
Прямая пересекает ось ординат в точке 1/ vmax под углом, равным Km/ vmax .
Величина Кт - ключевое звено в уравнении Михаэлиса - Ментен. Она характеризует действие данного фермента по отношению к тому или иному субстрату при определенных значениях рН и температуры.
Следует отметить, что одни ферменты требуют довольно высоких концентраций субстрата для достижения скорости, равной половине максимальной, другим достаточно очень низких концентраций субстрата.
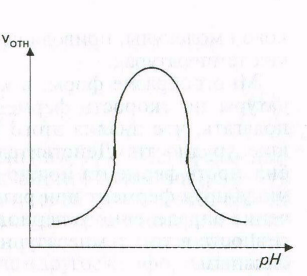
Ферменты активны только в определенном интервале рН; в большинстве случаев для каждого фермента имеется свой определенный оптимум рН.
Это объясняется несколькими причинами:
1) истинное обратимое влияние рН на скорость реакции v (когда фермент насыщен субстратом);
2) влияние рН на сродство фермента к субстрату (в этом случае падение активности по обе стороны от оптимума рН будет следствием понижения насыщения фермента субстратом в силу понижения сродства):
3) влияние рН на стабильность фермента, который может необратимо инактивироваться при рН пo одну или обе стороны от оптимума Перечисленные факторы могут действовать и в комбинации друг с другом. Например, падение активности по одну сторону от оптимума рН может быть результатом уменьшения сродства фермента к субстрату, а по другую - результатом инактивации фермента.
Для всех известных ферментов зависимость относительной скорости реакции от рН графически выражается в виде «колоколообразной» функции (рис. ).
Такие кривые строятся на основе данных, полученных при измерении начальных скоростей реакции, протекающей в буферных растворах с разными значениями рН.
Форма кривых, описывающих зависимость скорости ферментативной реакции от рН, отражает способность важных для данного фермента протон-донорных или протон-акцепторных групп в его каталитическом центре переходить при определенных значениях рН в состояние требуемой степени ионизации.
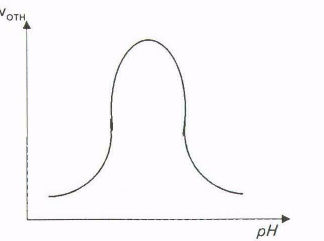
Рис. Зависимость скорости ферментативной реакции от рН
Методы анализа температурных зависимостей кинетических и равновесных параметров ферментативных реакций основываются на классических принципах термодинамики и кинетики.
Такая форма зависимости отражает способность важных для данного фермента протон-донорных или протон-акцепторных групп в его каталитическом центре переходить при определенных значениях рН в состояние требуемой степени ионизации.
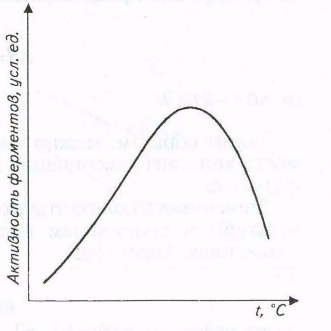
Зависимость скорости ферментативных реакций от температуры также имеет колоколообразную форму в достаточно широком температурном интервале (рис. ).
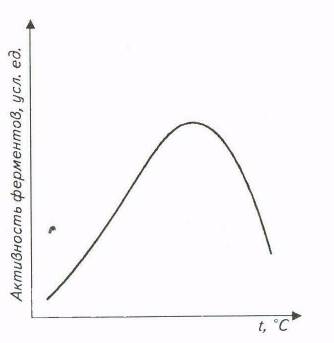
Рис. Влияние температуры на активность ферментов
Наличие температурного оптимума реакции объясняется наложением двух эффектов - возрастанием скорости реакции при увеличении температуры и ускорением тепловой денатурации белковой молекулы, приводящей к инактивации фермента при высоких температурах.
Таким образом, внешние факторы позволяют регулировать интересующие процессы, особенно при технологической обработке биологических объектов, например мяса и мясных продуктов.
Действие большинства ферментов можно также подавить или полностью ингибировать определенными химическими реагентами. Очевидно, химические вещества, в широком ассортименте присутствующие в биологических объектах (пищевом сырье), во многом предопределяют направленность и эффективность суммарных ферментативных превращений.
Известно много ферментов, для которых естественные условия их действия не совпадают с оптимальными параметрами рН и температуры. Изучение влияния ингибиторов ферментов позволяет получить ценные сведения о субстратной специфичности энзимов, природе функциональных групп активного центра и механизмах их каталитической активности. Ингибиторы ферментов служат очень полезными инструментами при исследовании метаболических путей в клетках.
Ферменты повышают скорости катализируемых ими реакций в 108 - 1020 раз. Необычайно высокое усиление каталитических свойств в мягких условиях объясняется следующими факторами:
1. Фермент способен связывать молекулу субстрата так, что атакуемая ферментом связь располагается вблизи от каталитической группы и правильно ориентирована по отношению к ней.
В результате присоединения субстрата возникает соответствие, благодаря которому комплекс ЕS легче достигает переходного состояния.
В активных центрах ферментов находятся специфические аминокислотные остатки, являющиеся хорошими донорами или акцепторами протонов. Они выступают мощными катализаторами
Механизм действия ферментов тесно связан со структурой и строением фермента и субстрата. Важную роль играет структура и строение белка, а именно: молекулярная масса, число пептидных цепей и последовательность аминокислот, упаковка и расположение пептидных цепей в молекуле фермента, число активных центров в молекуле белка, природа активного центра: химическая природа субстратсвязывающих и активизирующих групп, присутствующих в активном центре, а также небелковая часть, если она имеется.
ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ
В 1971 г. на первой конференции по инженерной энзимологии был узаконен термин «иммобилизованные ферменты». Иммобилизованными ферментами называются ферменты, искусственно связанные с нерастворимым носителем, но сохраняющие свои каталитические свойства. Однако в понятие «иммобилизация» в настоящее время вкладывают более широкий смысл, чем связывание на нерастворимом носителе, а именно - полное или частичное ограничение свободы движения белковых молекул.
Еще в 1916 г. Дж. Нельсон и Е. Гриффин показали, что сахараза, сорбированная на угле, сохраняла свою каталитическую активность, но лишь в 1953 г. Н. Грубхофер и Д. Шлейт впервые осуществили ковалентные связывания амилазы, пепсина, РНКазы и карбоксипептидазы с нерастворимым носителем.
Иммобилизованные ферменты имеют ряд преимуществ по сравнению со свободными молекулами. Во-первых, такие ферменты, представляя собой гетерогенные катализаторы, легко отделяются от реакционной среды, могут использоваться многократно и обеспечивают непрерывность каталитического процесса. Кроме того, иммобилизация ведет к изменению свойств фермента: субстратной специфичности, устойчивости, зависимости активности от параметров среды. Иммобилизованные ферменты долговечны и в тысячи и десятки тысяч раз стабильнее свободных энзимов. Так, термоинактивация лактатдегидрогеназы (при температуре 65 °С), иммобилизованной в 60 %-м полиакриламидном геле, замедлена в 3600 раз по сравнению с нативным ферментом. Все перечисленное обеспечивает высокую экономичность, эффективность и конкурентоспособность технологий, использующих иммобилизованные ферменты.
Носители для иммобилизации ферментов
По Дж. Порату (1974), идеальные материалы, используемые для иммобилизации ферментов, должны обладать следующими основными свойствами: нерастворимостью; высокой химической и биологической стойкостью; значительной гидрофильностью; достаточной проницаемостью как для ферментов, так и для коферментов, субстратов и продуктов реакции; способностью носителя легко активироваться (переходить в реакционноспособную форму).
Естественно, ни один из используемых в настоящее время в качестве носителя материал не отвечает полностью перечисленным требованиям. Тем не менее, существует широкий набор носителей, пригодных для иммобилизации определенных энзимов в конкретных условиях.
В зависимости от природы носители делятся на органические и неорганические материалы.
Органические полимерные носители. Иммобилизация многих ферментов осуществляется на полимерных носителях органической природы. Существующие органические полимерные носители можно разделить на два класса: природные и синтетические полимерные носители. В свою очередь, каждый из классов органических полимерных носителей подразделяется на группы в зависимости от их строения.
Среди природных полимеров выделяют белковые, полисахаридные и липидные носители, а среди синтетических — полиметиленовые, полиамидные и полиэфирные.
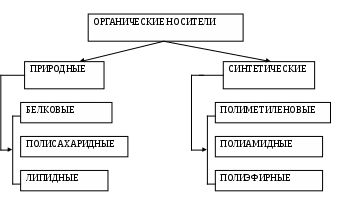
Рис. 4.
К преимуществам природных носителей следует отнести их доступность, полифункциональность и гидрофильность, а к недостаткам - биодеградируемость и достаточно высокую стоимость.
Из полисахаридов для иммобилизации наиболее часто используют целлюлозу, декстран, агарозу и их производные.
Для придания химической устойчивости линейные цепи целлюлозы и декстрана поперечно сшивают эпихлоргидрином. В полученные сетчатые структуры довольно легко вводят различные ионогенные группировки. Химической модификацией крахмала сшивающими агентами (формальдегид, глиоксаль, глутаровый альдегид) синтезирован новый носитель - губчатый крахмал, обладающий повышенной устойчивостью к гликозидазам.
Из природных аминосахаридов в качестве носителей для иммобилизации применяют хитин, который в значительных количествах накапливается в виде отходов в процессе промышленной переработки крабов и креветок. Хитин химически стоек и имеет хорошо выраженную пористую структуру.
Среди белков практическое применение в качестве носителей нашли структурные протеины, такие, как кератин, фиброин, коллаген и продукт переработки коллагена - желатина. Эти белки широко распространены в природе, поэтому доступны в значительных количествах, дешевы и имеют большое число функциональных групп для связывания фермента. Белки способны к биодеградации, что очень важно при конструировании иммобилизованных ферментов для медицинских целей. К недостаткам белков как носителей в этом случае следует отнести их высокую иммуногенность.
Синтетические полимерные носители. Благодаря разнообразию и доступности материалы этой группы широко используются как носители для иммобилизации. К ним относятся полимеры на основе стирола, акриловой кислоты, поливинилового спирта; полиамидные и полиуретановые полимеры. Большинство синтетических полимерных носителей обладают механической прочностью, а при образовании обеспечивают возможность варьирования в широких пределах величины пор, введения различных функциональных групп.
Некоторые синтетические полимеры могут быть произведены в различных физических формах (трубы, волокна, гранулы). Все эти свойства полезны для разных способов иммобилизации ферментов.
Носители неорганической природы. В качестве носителей наиболее часто применяют материалы из стекла, глины, керамики, графитовой сажи, силикагеля, а также силохромы, оксиды металлов. Их можно подвергать химической модификации, для чего носители покрывают пленкой оксидов алюминия, титана, гафния, циркония или обрабатывают органическими полимерами. Основное преимущество неорганических носителей - легкость регенерации. Подобно синтетическим полимерам, неорганическим носителям можно придать любую форму и получать их с любой степенью пористости.
Итак, к настоящему времени создано огромное число разнообразных носителей для иммобилизации ферментов. Однако для каждого индивидуального фермента, используемого в конкретном технологическом процессе, необходимо подбирать оптимальные варианты как носителя, так и условий и способов иммобилизации.
Методы иммобилизации ферментов
Существуют два принципиально различных метода иммобилизации ферментов: без возникновения ковалентных связей между ферментом и носителем (физические методы иммобилизации) и с образованием ковалентной связи между ними (химические методы иммобилизации). Каждый из этих методов осуществляется разными способами (рис. 4.4).
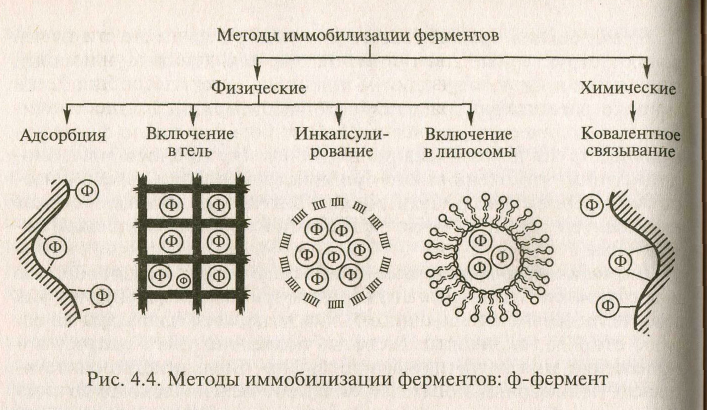
Физические методы иммобилизации ферментов реализуются посредством адсорбции фермента на нерастворимом носителе, путем включения энзимов в поры поперечносшитого геля, в полупроницаемые структуры или двухфазные системы.
Адсорбция ферментов на нерастворимых носителях. При адсорбционной иммобилизации белковая молекула удерживается на поверхности носителя за счет электростатических, гидрофобных, дисперсионных взаимодействий и водородных связей.
Адсорбция была первым методом иммобилизации ферментов. Активность фермента при таком варианте иммобилизации сохраняется практически на 100%, а удельная концентрация белка достигает 64 мг на 1 г носителя.
К недостаткам адсорбционного метода следует отнести невысокую прочность связывания фермента с носителем.
Иммобилизация ферментов путем включения в гель. Способ иммобилизации ферментов путем включения в трехмерную структуру полимерного геля широко распространен благодаря своей простоте и уникальности. Метод применим для иммобилизации не только индивидуальных ферментов, но и мультиэнзимных комплексов и даже интактных клеток.
Иммобилизация ферментов в гелях обеспечивает равномерное распределение энзима в объеме носителя. Однако метод непригоден для иммобилизации ферментов, действующих на водонерастворимые субстраты.
Иммобилизация ферментов в полупроницаемые структуры. Сущность этого способа иммобилизации заключается в отделении водного раствора фермента от водного раствора субстрата с помощью полупроницаемой мембраны, пропускающей низкомолекулярные молекулы субстратов и кофакторов, но задерживающей большие молекулы фермента. Разработано несколько модификаций этого метода, из которых интерес представляет микрокапсу-лирование и включение ферментов в липосомы.
Размер получаемых капсул составляет десятки или сотни мик рометров, а толщина мембраны - сотые доли микрометра.
Достоинства метода микрокапсулирования — простота, универсальность, возможность многократного использования нативного фермента (фермент может быть отделен от непрореагировавшего субстрата и продуктов реакции процедурой простого фильтрования).
Ферменты, иммобилизованные путем включения в структуру липосом, используют преимущественно в медицинских и научных целях.
Химические методы иммобилизации ферментов. Иммобилизация ферментов путем образования новых ковалентных связей между ферментом и носителем - наиболее массовый способ получения промышленных биокатализаторов.
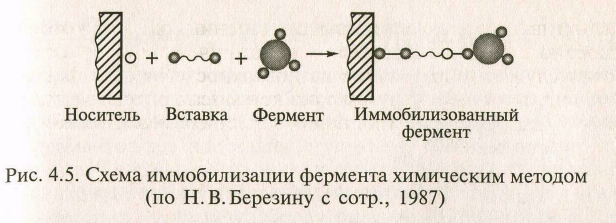
В отличие от физических методов, этот способ иммобилизации обеспечивает прочную и необратимую связь фермента с носителем и часто сопровождается стабилизацией молекулы энзима.
Все методы химической иммобилизации классифицируют в зависимости от природы реакционной группы носителя, вступающей во взаимодействие с молекулой фермента.
Иммобилизация ферментов на носителях, обладающих гидроксогруппами. Наиболее распространенным методом образования ковалентной связи между ферментом и полисахаридным носителем или синтетическим диольным соединением является бромциановый метод.
Иммобилизация ферментов на носителях, обладающих аминогруппами. Первичные аминогруппы носителя, связанные с ароматическим кольцом, предварительно превращают в соли диазо-ния, которые затем подвергают разнообразным реакциям сочетания. В реакции сочетания вступают фенольные, имидазольные, аминные, гуанидиновые, тиольные группы белков.
Иммобилизация на носителях, обладающих активированными производными карбоксильной группы. Наиболее часто для соединения аминогрупп белка с ацильными группировками носителя используют ангидриды, галогенангидриды, активированные эфиры и другие производные карбоновых кислот.
Иммобилизация на носителях, обладающих сульфгидрильными группами. Сульфгидрильные группы носителя и фермента легко окисляются с образованием дисульфидных связей под действием кислорода воздуха:
Источники ферментов
Ферменты присущи всем живым организмам, но для их выделения используют те природные объекты, в которых содержание энзимов составляет не менее 1%. Для промышленного получения ферментов используют проросшее зерно различных злаков и бобовых, латекс и сок зеленой массы ряда растений, а также отдельные ткани и органы животных. Практически неограниченный источник ферментов – микроорганизмы (бактерии, грибы, дрожжи), содержание которых можно повысить в десятки и сотни раз методами мутагенеза, селекции и индукции биосинтеза.
Как известно, ферменты животного происхождения преимущественно выделяют из органов, в которых протекают интенсивные биохимические процессы. Из слизистой желудка свиней и крупного рогатого скота получают препарат пепсина. Из поджелудочной железы свиней получают смеси трипсина, хемотрипсина, липаз и амилаз. Из желудка телят выделяют сычужный фермент, широко используемый в сыроделии. Для нужд медицины и биохимии ферментные препараты выделяют из мышц, в том числе из сердца, печени, селезенки, почек, тонкого кишечника. Некоторые широко известные ферменты животного происхождения получают в виде различных препаратов (табл. 20).
Таблица 20 Некоторые ферменты животного происхождения
| Фермент | Источник |
| Лактатдегидрогеназа | Крупный рогатый скот, сердце |
| Каталаза | Крупный рогатый скот, свинья, печень |
| Сычужный фермент | Крупный рогатый скот, сычуг |
| Щелочная фосфатаза | Крупный рогатый скот, кишечник |
| Гиалуронидаза | Крупный рогатый скот, семенник |
| Фумараза и трансаминаза | Свинья, сердце |
| Трипсин, химотрисин, карбоксилпептидаза, эластаза | Свинья, поджелудочная железа |
| Пепсин | Свинья, желудок |
| Аминоацилаза | Свинья, почки |
| Люцифераза | Светляки, мышечная ткань |
| Ацетилхолинэстераза | Электрический угорь, мышечная ткань |
На крупных мясокомбинатах целесообразно иметь цехи по получению биохимических препаратов из органов убойных животных
Из ферментов растительного происхождения наиболее широко в народном хозяйстве используют амилазы и папаин. Условно ферментным препаратом можно назвать и ячменный солод, в котором содержится до 1% амилаз.
Растительная протеаза – папаин – содержится в плодах дынного дерева. Только в США ежегодно расходуют около 100 т папаина для обработки (тендеризации, т.е. размягчения) мяса. Папаин, а также протеазы фицин и бромелин, контактируя с мясом в течение 2 ч при комнатной температуре, расщепляют белки соединительной ткани - коллаген и эластин.
Из растительного сырья получают также фосфатазы пероксидазы, уреазы, гемицеллюлазы и др. Источники некоторых ферменттов растительного происхождения перечислены в табл 21.
В связи со все увеличивающимися потребностями в ферментных препаратах растительное и животное сырье не удовлетворяют- спроса производителей. Содержание ферментов в растениях, как правило, низкое. Кроме того, получение ферментов из растений носит сезонный характер. Органы животных получают на мясокомбинатах, но при этом возникают проблемы с консервированием и хранением этого вида сырья.
Таблица 21
Некоторые ферменты растительного происхождения
| Фермент | Источник |
| Амилазы | Ячмень |
| Протеазы Папаин Фицин Бромелин | Дынное дерево Фиговое дерево Ананас |
| Кислая фосфатаза | Картофель |
| Пероксидаза | Хрен |
| Уреаза | Канавалия мечевидная |
Совершенно иная ситуация с получением биологически активных веществ, в том числе ферментов, микробиологическим путем. Современные методы генетики и генетической инженерии позволяют целенаправленно увеличивать выход необходимого фермента. Кроме того, среди микроорганизмов можно найти формы, живущие в экстремальных условиях (термофилы, галофилы и др.) Это означает, что из микроорганизмов можно выделить ферменты с улучшенными свойствами: термостабильные, осмоустойчивые, кислото- и щелочеустойчивые.
Технологически очень важно то, что микроорганизмы выделяют ряд ферментов из клеток в окружающую среду; это существенно облегчает выделение и очистку.
Экономически выгодна комплексная переработка биомассы дрожжей, при которой помимо зимозана получают нуклеиновые кислоты, азотистые основания, дрожжевые ферменты (инвертазу, альдолазу) и пр.
