Иод. Калия и натрия иодиды
 Скачать 207.43 Kb. Скачать 207.43 Kb.
|
Количественное определение: Метод Фаянса. Вещества в препарате должно быть не менее 99,5%. Хранение. В хорошо укупоренных банках оранжевого стекла. Применение: При бронхиальной астме, атеросклерозе и др. заболеваниях. Natrii iodidumКоличественное определение: Метод Фаянса. Хранение. В хорошо укупоренных банках оранжевого стекла в сухом месте. Применение: при бронхиальной астме, атеросклерозе, пневмонии, сифилисе и др. заболеваниях. Реакции: Na+1. Соль натрия, внесенная в пламя, окрашивает его в желтый цвет 2. С цинкуранилацетатом выпадает желтый кристаллический осадок. NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O NaZn[(UO2)3(CH3COO)9]•9H2O + HCl K+1. Окрашивает пламя в фиолетовый цвет. 2. С раствором винной кислоты в присутствии ацетата натрия и спирта. COOH-(CHOH)2-COOH + KBr 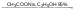 COOK-(CHOH)2-COOH + HBr COOK-(CHOH)2-COOH + HBrАцетат натрия добавляют для связывания минеральных кислот. CH3COONa + H+  CH3COOH + Na+ CH3COOH + Na+Этиловый спирт добавляют для уменьшения растворимость осадка. Но если спирта много, то в осадок выпадает винная кислота. Осадок растворим в минеральных кислотах: COOK-(CHOH)2-COOH + HСl COOH-(CHOH)2-COOH + KCl В щелочах (образуется синьетова соль): COOK-(CHOH)2-COOH + NaOH COONa-(CHOH)2-COOK 3. С раствором кобальтонитрита натрия, он же гексанитрокобальтат натрия выпадет желтый кристаллический осадок. 2KCl + Na3[Co(NO2)6] 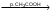 K2Na[Co(NO2)6] + 2NaCl K2Na[Co(NO2)6] + 2NaClI-1. Он более сильный восстановитель, используют слабые окислители. 2KI + 2NaNO2 + 2H2SO4 I2 + 2NO2 + 2Na2SO4 + K2SO4 + 2H2O 2. I- при нагревании с серной кислотой образуется йод, который обнаруживают по образованию фиолетовых паров. 8HI + H2SO4 к H2S + 4I2 + 4H2O
Количественное определение: Метод Мора. Вещества в препарате должно быть не менее 98,5%, и не более 101,5% Хранение. В хорошо укупоренной таре. Применение: успокаивающее средство. Kalii bromidumКоличественное определение: Метод Мора. Хранение. В хорошо укупоренной таре, предохраняющей от действия света. Применение. Успокаивающее средство. Реакции: Na+1. Соль натрия, внесенная в пламя, окрашивает его в желтый цвет 2. С цинкуранилацетатом выпадает желтый кристаллический осадок. NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O NaZn[(UO2)3(CH3COO)9]•9H2O + HCl K+1. Окрашивает пламя в фиолетовый цвет. 2. С раствором винной кислоты в присутствии ацетата натрия и спирта. COOH-(CHOH)2-COOH + KBr 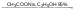 COOK-(CHOH)2-COOH + HBr COOK-(CHOH)2-COOH + HBrАцетат натрия добавляют для связывания минеральных кислот. CH3COONa + H+  CH3COOH + Na+ CH3COOH + Na+Этиловый спирт добавляют для уменьшения растворимость осадка. Но если спирта много, то в осадок выпадает винная кислота. Осадок растворим в минеральных кислотах: COOK-(CHOH)2-COOH + HСl COOH-(CHOH)2-COOH + KCl В щелочах (образуется синьетова соль): COOK-(CHOH)2-COOH + NaOH COONa-(CHOH)2-COOK 3. С раствором кобальтонитрита натрия, он же гексанитрокобальтат натрия выпадет желтый кристаллический осадок. 2KCl + Na3[Co(NO2)6] 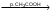 K2Na[Co(NO2)6] + 2NaCl K2Na[Co(NO2)6] + 2NaClBr-1. С раствором хлорамина Б. Ph-SO2-NNa-Cl + 2HCl p Ph-SO2NH2 + Cl2 + NaCl Cl2 + 2KBr 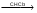 Br2 + 2KCl Br2 + 2KClцвет хлороформного слоя – желто-бурый, желто-оранжевый 2. Реакция с KMnO4 (не фармакопейная). 2KMnO4 + 10KBr + 8H2SO4 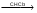 5Br + 2MnSO4 + 5K2SO4 + 5H2O 5Br + 2MnSO4 + 5K2SO4 + 5H2Oхлороформ окрашивается в желто-бурый цвет.
Solutio Hydrogenii peroxydi dilutaПодлинность: к 1 мл препарата прибавляют 0,2 мл H2SO4 разведенной, 2 мл эфира, 0,2 мл раствора K2Cr2O7 и взбалтывают, эфирный слой окрашивается в синий цвет K2Cr2O7 + H2SO4 H2Cr2O7 + K2SO4 H2Cr2O7 + 4H2O2 H2Cr2O8 + H2O Количественное определение: 1. Безындикаторная перманганатометрия: до устойчивой розовой окраски: 2KMnO4 + 5H2O2+3 H2SO4 2MnSO4 + K2SO4 + 8H2O + 5O2 f(H2O2) = ½ ;  2. Косвенная йодометрия: 2KI + H2O2 + H2SO4 р. I2 + K2SO4 + 8H2O I2 + 2Na2S2O3 2NaI + Na2S4O6 f(H2O2) = ½; 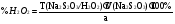 3. Прямая цериметрия 4. Фотоколориметрия 5. Спектрофотоколориметрия 6. Рефрактометрия Хранение: в склянках темного стекла с притертой пробкой, в прохладном месте без доступа света. Применение: антисептическое, дезодорирующее, депигментирующее и кровоостанавливающее средство Другие препараты перекиси водородаPerhydrolum – 30% H2O2. Hydroperitum – 33-35% H2O2, (NH2)2CO, лимонная кислота. Magnesii peroxydum–25%MgO2+75%MgO.
Na2S2O3•5H2O Натрия тиосульфат. Получение: Кипячение раствора сульфита натрия с серой: Окончание – по отрицательной реакции на сульфит ионы с раствором хлорида кальция. Затем отфильтровывают избыток серы и сгущают фильтрат до кристаллизации. Выкристаллизовывается кристаллогидрат Получают натрия тиосульфат также путем сплавления его кальциевой соли с сульфатом натрия. Подлинность: 1) 0,1 г растворяют в 2 мл H2O прибавляют несколько капель HCl и через некоторое время раствор мутнеет и появляется запах Na2S2O3 + HCl NaCl + S + SO2 + H2O 2) с избытком AgNO3 образуется осадок, который меняет свою окраску от белого через желтый и бурый к черному. Na2S2O3 + 2AgNO3 изб. Ag2S2O3 Ag2S2O3 Ag2SO3 + S Ag2SO3 + S + H2O Ag2S + H2SO4 3) Характерные реакции на натрий. Na+1. Соль натрия, внесенная в пламя, окрашивает его в желтый цвет 2. С цинкуранилацетатом выпадает желтый кристаллический осадок. NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O NaZn[(UO2)3(CH3COO)9]•9H2O + HCl Количественное определение: Применение: противотоксическое и десенсибилизирующее средство, используется при отравлении цианидами, при отравлении солями тяжелых металлов, при аллергических заболеваниях (внутривенно). Натрия нитрит Получение: Восстановление расплавленного нитрата нитрия свинцом: Промышленный способ получения основан на использовании отходов производства азотной кислоты. Диоксид азота поглощают раствором карбоната натрия: Полученную смесь солей разделяют фракционной перекристаллизацией. Вначале кристаллизуется натрия нитрат. После тщательной очистки от примесей получают лекарственное вещество. Подлинность. Дает характерные реакции на натрий и нитрит ион. 1. Соль натрия, внесенная в пламя, окрашивает его в желтый цвет 2. С цинкуранилацетатом выпадает желтый кристаллический осадок. NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O NaZn[(UO2)3(CH3COO)9]•9H2O + HCl 3)В кислой среде диспропорционирует с образованием двух оксидов азота (II и IV), высший оксид выделяется в виде желто-бурых паров: Эту реакцию используют как для определения подлинности нитритов, так и для отличия их от нитратов. 4) Подлинность нитритов подтверждают также их взаимодействием в кислой среде с антипирином. В результате образуется окрашенный в зеленый цвет нитрозоантипирин: 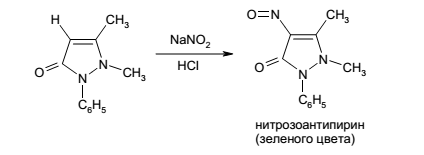 5) Нитриты можно открыть по взаимодействию с дифениламином в среде кислоты серной концентрированной (возникает синее окрашивание).При нанесении капли подкисленного раствора, содержащего нитрит ион, на пропитанную калия йодидом и крахмалом бумагу появляется пятно синего цвета из-за образующегося в результате реакции йода: Количественное определение:метод обратной перманганатометрии.
Natrii hydrocarbonasНатрия гидрокарбонат, NaHCO3, M. в. 84,0 Описание. Белый кристаллический порошок без запаха, соленощелочного вкуса, устойчив в сухом воздухе, медленно разлагается во влажном. Водные растворы имеют щелочную реакцию. Растворимость. Растворим в воде, практически нерастворим в 95% спирте. Получение: Аммиачно – хлоридным способом. На очищенный орт примеси рассол хлорида натрия действуют аммиаком, а затем подвергают карбонизации в барботажных колоннах. Подлинность. Препарат дает характерные реакции на натрий и гидрокарбонаты. На ион Na 1. Соль натрия, внесенная в пламя, окрашивает его в желтый цвет 2. С цинкуранилацетатом выпадает желтый кристаллический осадок. NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O NaZn[(UO2)3(CH3COO)9]•9H2O + HCl 3)Для отличия от карбонат-иона проводят реакцию взаимодействия с насыщенным раствором сульфата магния. Испытание основано на образовании магния карбоната основного: 4MgSO4 + 4Na2CO3 MgCO3•Mg(OH)2•3H2O + 4Na2SO4 +CO2 Гидрокарбонат-ион образует осадок только при кипячении смеси, а карбонат-ион при обычной температуре. Количественное определение. Натрия гидрокарбонат для инъекций, кроме перечисленных выше требований, должен выдерживать следующее испытание: 5% раствор препарата должен быть прозрачным и бесцветным. Хранение. В хорошо укупоренной таре. Применение: ацидоз, язвенная болезнь желудка и двенадцатиперстной кишки, интоксикации, диабет, воздушная болезнь, морская болезнь. Лития карбонат: Получают лития карбонат действием карбонатов Na2CO3. K2CO3. на соли лития LiCl. LiNO3. Li2SO4 или пропусканием диоксида углерода (4) в растворы гидроксида лития: Подлинность:
Растворы солей лития в хлороводородной кислоте после прибавления раствора гидрофосфата динатрия (натрия фосфата двузамещенного) и гидроксида натрия после кипячения образуют белый осадок Растворимые фториды щелочных металлов осаждают из водных растворов солей лития белый аморфный осадок мало растворимого в воде фторида лития:
Количественное определение. Титрование растворенной в воде навески предварительно высушенного литий карбоната. Титрант – 0,1 М раствор хлороводородной кислоты Индикатор – метиловый оранжевый Хранение – хорошо укупоренная тара Применение: лечение подагры, почечных камней. Купирует маниакальное возбуждение у психических больных.
Magnesii sulfas - магния сульфат – MgSO4•7H2OПолучение: 1) Из магнезита: MgCO3 + H2SO4 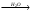 MgSO4•7H2O + CO2 MgSO4•7H2O + CO22) Из даламита (MgCO3•CaCO3), амарита. Подлинность: Mg2+ + Na2HPO4 + NH4OH + 5H2O 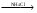 MgNH4PO4•6H2O + 2Na+ MgNH4PO4•6H2O + 2Na+Белый крист., растворим в уксусной и минеральных кислотах SO42- + BaCl2 BaSO4 Осадок нерастворим в минеральных кислотах. Допустимые примеси: хлориды, тяжелые металлы, железо, мышьяк. Марганец: препарат растворяют в воде, прибавляют к. H2SO4, небольшое количество 0,1 M раствора AgNO3, греют до закипания, прибавляют персульфат аммония, еще раз греют до закипания. Параллельно проводим контрольный опыт (бесцветный) и титруем его раствором перманганата калия до уравнения окрасок, рассчитываем содержание марганца (не более 0,004%). Препарат, применяемый для инъекций не должен содержать марганца (не должно быть розовой окраски). Mn2+ + (NH4)2S2O8 + H2O 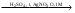 MnO4-+ 2SO42- + 2NH4+ MnO4-+ 2SO42- + 2NH4+Количественное определение: Прямая комплексонометрия в среде аммиачного буфера с рН 9,5-10,0. Индикатор эриохром черный Т. Титруют раствором трилона Б (0,05 моль/л) до синего окрашивания. Хранение: в хорошо упакованной таре Применение: успокаивающее, спазмолитическое, слабительное, желчегонное. Magnesii oxydum (magnesia usta) – магния окись (магнезия жженая) - MgOПодлинность: - Допустимые примеси: хлориды, сульфаты, кальций, тяжелые металлы, мышьяк, карбонаты щелочных металлов, растворимые соли. Количественное определение: растворяют в HCl, нейтрализуют NH4OH, далее как MgSO4. Хранение: в хорошо упакованной таре. Применение: антацидное средство. Calcii chloridum – кальция хлорид – CaCl2•6H2OПолучение: из мела, мрамора, известняка, предварительно очищенных от железа и магния: CaCO3 + 2HCl CaCl2•6H2O + CO2 содержащийся в природных минералах примеси ионов магния и железа осаждают гидроксидом кальция. Подлинность: Кальций.
Ca2+ + C2O4(NH4)2 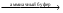 CaC2O4 + 2NH4+ CaC2O4 + 2NH4+Осадок растворим в минеральных кислотах, нерастворим в аммиаке и уксусе. CaC2O4 + HCl CaCl2 + H2C2O4
Хлор: Cl- + AgNO3 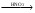 AgCl + NO3- AgCl + NO3-Выпадает белый аморфный осадок, растворим в аммиаке AgCl + 2NH4OH [Ag(NH3)2]Cl + 2H2O Допустимые примеси: сульфаты, тяжелые металлы, железо, мышьяк, магний, щелочные металлы. Недопустимые примеси: барий, алюминий, фосфаты, цинк. Количественное определение: 1) Прибавляют 10 мл буферного раствора с рН 9,5-10,0; индикаторной смеси или 7 капель раствора индикатора хромового темно - синего и титруют раствором трилона Б (0,05 моль/л) до сине - фиолетового окрашивания Первая стадия: 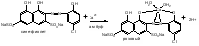 Вторая и третья стадии аналогично Магния Сульфату. 2) по аниону аргентометричекси: CaSO4 · ½ H2O 2 CaSO4 · H2O Кальция сульфат жженый, гипс жженый Получение: из природного гипса CaSO4 · 2 H2O обжигом в специальных печах при 130-1500 С до потери полутора молекул кристаллизационной воды, т.е. до CaSO4 · ½ H2O. Подлинность сульфат иона: SO42-: CaSO4 + BaCl2 + HClр. → BaSO4↓ + CaCl2 Доброкачественность: CaSO4: 1) Смешивают 5 ч H2O + 10 ч препарата; не должно быть запаха H2S↑; 2) Гипс должен затвердевать не ранее 4 минут и не позднее 10 минут после смешивания с водой в соотношении 10 : 5. 3) При просеивании через сито со стороной отверстия 0,75 мм остатка не должно быть, а через сито с отверстиями 0,20 мм допускается остаток не более 8 %. Применение: источник иона Ca, антиаллергическое средство, противовоспалительное, кровоостанавливающее, диуретическое.
Acidum boricum – кислота борная – H3BO3Получение: 1. Из минерала "амарита": B2O3•2MgO•H2O + 2H2SO4 2MgSO4 + 2H3BO3 2. Из буры (натрия тетрабората): Na2B4O7 + 2HCl + 5H2O H3BO3 + 2NaCl H3BO3 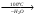 HBO2 HBO24HBO2 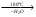 H2B4O7 (тетраборат) 2B2O3 (борный ангидрид, стекловидный плав) H2B4O7 (тетраборат) 2B2O3 (борный ангидрид, стекловидный плав)B(OH)3 + H2O [B(OH)4]H [B(OH)4]- + H+ В глицерине борная кислота образует более сильную глицероборную кислоту: 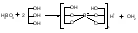 Эта кислота по силе как уксусная, рН=4. Подлинность: 1)Дихромат калия в ацетатном буферном растворе образует с ионами бария желтый кристаллический осадок: 2) Раствор кислоты в спирте с концентрированной серной кислотой горит пламенем, окаймленным в зеленый цвет. B(OH)3 + 3C2H5OH 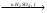 B(OC2H5)3 зеленая кайма + 3H2O B(OC2H5)3 зеленая кайма + 3H2O3). На куркумовой бумаге светло-желтого цвета. На бумагу наносят 1 каплю H3BO3, 1 каплю HCl, высушивают, бумага окрашиваются в розовый цвет. 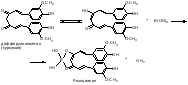 При обработке аммиаком, бумага окрашивается в фиолетовый или зеленовато-черный цвет: 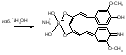 Количественное определение: Прямая алкалиметрия в водно-глицериновом растворе. Применение: в качестве наружного антисептика – мази, примочки, спиртовые растворы. Токсична, нарушает функции почек. Natrii tetraborax – натрия тетраборат – Na2B4O7•10H2O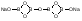 Получение: 4H3BO3 + Na2CO3 Na2B4O7 + CO2 + 6H2O Подлинность: реакции 1, 2 для борной кислоты (после подкисления) + реакции на натрий. Количественное определение: Прямая ацидиметрия в водном растворе. Индикатор – метиленовый оранжевый, титрант – 0,1M HCl. Na2B4O7 + 2HCl + 5H2O 2NaCl + 4H3BO3 f= ½; 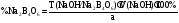 Хранение: в хорошо упакованной таре. Применение: в качестве наружного антисептика - для полосканий, смазываний. Водные растворы, растворы в глицерине.
Bismuthi subnitras – висмута нитрат основной.Подлинность: 1)С сульфидом натрия выпадет коричнево-черный осадок, растворимый в концентрированной азотной кислоте. 2Bi3+ + 3Na2S Bi2S3 + 3K+ Bi2S3 + 6HNO3 2Bi(NO3)3 + 3H2S 2)С KI выпадет черный осадок, растворимый в избытке KI (образуется желто-оранжевый комплекс). Bi3+ + 3KI BiI3 + 3K+  K[BiI4] K[BiI4]3)При прокаливании выделяются желто-бурые пары и остаток ярко-желтого цвета. Висмута нитрат основной  2Bi2O3 + H2O + 2NO2 + O2 2Bi2O3 + H2O + 2NO2 + O2Допустимые примеси: хлориды щелочных и щелочно-земельных металлов, серебро. Недопустимыепримеси: CO3, NH4, Cu, Pb, SO4, As, Te Количественное определение: прямая комплексонометрия. Индикатор: пирокатехиновый фиолетовый. рН=2-3 (HNO3). Титрант – трилон Б.  Расчет ведут по Bi2O3. Расчетная формула для прямого титрования без контрольного опыта. Применение: Вяжущее антисептическое при заболеваниях ЖКТ. Алюминия гидроксид Al(OH)3 Получение. обработкой сульфата алюминия или алюмокалиевых квасцов раствором аммиака при температуре 60 оС: Al2(SO4)3 + 6 NH4OH → Al(OH)3↓ + 3 (NH4)2SO4 2 KAl(SO4)2 + 6 NH4OH → Al(OH)3↓ + K2SO4 + 3 (NH4)2SO4 Образующийся белый студенистый осадок отфильтровывают, промывают горячей водой и высушивают при 40 0С. Подлинность. 1) Растворяется в кислотах с образованием растворимого в воде алюминия хлорида: Al(OH)3 + 3 HCl → AlCl3 + 3 H2O 2) Растворяется в щелочах с образованием прозрачного раствора, а при последующем прибавлении аммония хлорида выпадает белый студенистый осадок: Al(OH)3 + NaOH → NaAl(OH)4 NaAl(OH)4 + NH4Cl → Al(OH)3↓ + NaCl + NH4ОН 3) При прибавлении к кристаллическому гидроксиду алюминия раствора нитрата кобальта и прокаливании образуется кобальта алюминат синего цвета: Al(OH)3 + Co(NO3)2 → Co(AlO2)2
Количественное определение:
Хранение: хорошо укопоренная тара Применение: антацидное средство. Алюминия фосфат. Получают из растворимых солей алюминия при взаимодействии с эквивелентыми количествами ортофосфатов щелочных металлов в растворах с рН 4,0-4,5: Выпадает аморфный осадок. Применение: в виде геля – противоязвенного, антацидного, обволакивающего, адсорбирующего средства.
Получение: Источник- очищенный от примесей металлический цинк. Раствор цинка сульфата при нагревании с карбонатом натрия образует осадок основного карбоната цинка, который промывают для удаления сульфат ионов, сушат и прокаливают (3000 С) до получения оксида: 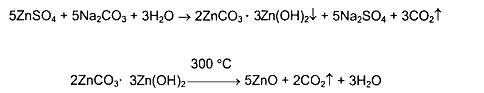 Цинка оксид получаю окислением цинка на воздухе или в кислороде: Zinci sulfas – цинка сульфат – ZnSO4•7H2OПодлинность: 1) При взаимодействии с сульфидом натрия выпадает белый осадок, нерастворим в уксусной кислоте (р), легко растворим в НСl. Zn2+ + Na2S ZnS + 2Na+ ZnS + HCl ZnCl2 + H2S 2) С гексацианоферратом калия дает белый аморфный студенистый осадок, нерастворимый в HCl. Zn2+ + K4[Fe(CN)6] K2Zn[Fe(CN)6] + 2K+ 3Zn2+ + 2K4[Fe(CN)6] K2Zn3[Fe(CN)6]2 + 6K+ 3) Сульфат с солью бария дает белый осадок, нерастворимый в минер. кислотах SO42- + Ba2+ BaSO4 Допустимые примеси: хлориды, мышьяк. Недопустимые примеси: нитраты, алюминий, железо, медь, магний, кальций. Количественное определение: Прямая комплексонометрия. Титрант: трилон Б, pH=9,5-10. Инд – кислотный хром черный специальный. Хранение: Список Б. В хорошо упакованной таре. Применение: Антисептик и вяжущее. Zinci oxydum – окись цинка – ZnOПодлинность:
при прокаливании окрашивается в желтый цвет., при охлаждении снова белеет. Допустимые примеси: мышьяк. Недопустимые примеси: карбонаты и нер-мые примеси железа, меди, алюминия, свинца. Количественное определение: Прямая комплексонометрия после растворения в соляной кислоте и нейтрализации раствором аммиака. Титрант: трилон Б, pH=9,5-10. Инд – кислотный хром черный специальный. Хранение: в хорошо упакованной таре Применение: вяжущее, подсушивающее, дезинфицирующее, при кожных заболеваниях.
Cuprisulfas – сульфат меди – CuSO4•5H2OПодлинность:
2) Ионы меди образуют синий комплекс с раствором аммиака. CuSO4 + 2NH4OH Cu2(OH)2SO4 + (NH4)2SO4 Cu2(OH)2SO4 + (NH4)2SO4 + 6NH4OH 2[Cu(NH3)4]SO4 синий + 8H2O 3) Сульфаты с солями бария дают белый осадок, нерастворимый в минеральных кислотах. SO42- + Ba2+ BaSO4 4)Гексационоферрат 2 калия при рН 7 осаждает ионы меди в виде красно – бурого осдка, растворимого в аммиаке с образованием аммиакатов меди. 5) раствор меди (2) сульфата с сульфидом натрия – черный осадок сульфида меди 2, нерастворимого в хлороводородной кислоте:
Допустимые примеси: хлориды, железо, соли металлов, не осаждающихся H2S Количественное определение: косвенная йодометрия (нефармакопейно – прямая комплексонометрия с индикатором мурексидом) CuSO4 + 2KI CuI2 + K2SO4 2CuI2 2CuI + I2 осадок цвета слоновой кости I2 + 2Na2S2O3 2NaI + Na2S4O6 f(CuSO4) = 1/2 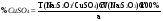 Применение: Антисептик, вяжущее, прижигающее, наружно, иногда внутрь (рвотное). Argenti nitras – нитрат серебра – AgNO3Подлинность: 1) С хлоридами выпадает белый творожистый осадок, нер-мый в HNO3, р-мый в NH4OH. Ag+ + Cl- AgCl 2) Реакция серебряного зеркала. 2[Ag(MH3)2]OH + H-COH  2Ag + HCOONH4 + 3NH3 + H2O 2Ag + HCOONH4 + 3NH3 + H2O3)Осаждение с иодид – ионом. Образуется желтого цвета осадок оксида серебра, нерастворимый в растворах аммиака и азотной кислоты. 4) осаждение с хроматом калия, по образовании. Оранжево – красного осадка хромата серебра:
Синее окрашивание Недопустимые примеси: Висмут, медь, свинец Количественное определение: Тиоцианатметрия. Индикатор: FeNH4(SO4)2•12H2O, среда – HNO3. Титрант – роданид амония NH3SCN. AgNO3 + NH4CNS 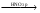 AgCNS + NH4NO3 AgCNS + NH4NO3Fe3+ + 6CNS- [Fe(CNS)6]3- красный f(AgNO3) = 1; 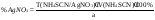 Применение: Антисептическое и прижигающее. Применяется наружно, иногда внутренне |
