11 ионная связь. Ионная связь. Строение ионных кристаллов Демонстрации. Кристаллические решетки
 Скачать 86.58 Kb. Скачать 86.58 Kb.
|
|
Дата 12.02.2021 Класс 11а (е-м) Тема: Ионная связь. Строение ионных кристаллов Демонстрации. Кристаллические решетки. Цель: обобщать понятия «ионная связь», «кристаллическая решетка», «элементарная ячейка»; объяснять механизмы образования ионной связи; характеризовать типы кристаллических решеток ионных соединений. Оборудование: учебник, компьютер, интерактивная доска, периодическая таблица Д.И. Менделеева Ход урока: 1. Организационный момент 2. Актуализация знаний Проверка домашнего задания 3. Постановка цели и задач урока, мотивация учащихся Задание «Четвертый лишний»: «Из предложенного списка веществ выберите вещество, которое не соответствует другим по типу химической связи: Li, NaF, F2 , NH3 , S, H2 O, Al, N2 , Si, Mg. Поясните свой выбор». (Ответ: NaF, так как это вещество с ионной связью.) Учитель формулирует тему урока — «Ионная связь. Строение ионных кристаллов». 4. Изучение нового материала 1. Верно ли утверждение, что ионная связь образуется между любым металлом и неметаллом? Ответ поясните. (Ответ: нет, утверждение не верно, так как ионная связь образуется, только между такими металлами и неметаллами, DЭО которых больше 1,7.) 2. Пользуясь таблицей ЭО по Полингу, ответьте на вопрос задания № 3 на с. 254 учебника. 3. Верно ли утверждение, что в условной молекуле NaOH реализуется только ионная связь? (Ответ: нет, утверждение не верно, так как в этой условной молекуле ионная связь реализуется только между натрием и группой ОН, между атомами кислорода и водорода в группе ОН — связь ковалентная полярная.) Ионная связь – это электростатическое притяжение между ионами, образованными путем полного смещения электронной пары к одному из атомов. Этот тип связи возникает между атомами химических элементов, сильно отличающихся по электроотрицательности. Как правило между типичными металлами и неметаллами. ионная связь, в отличие от ковалентной связи, — ненаправленная и ненасыщаемая, а энергия ионной связи составляет 300—700 кДж/моль Характеристики ионной связи В отличие от ковалентной связи, ионная связь является ненасыщенной и ненаправленной. Это легко себе представить: ведь взаимодействие ионов в пространстве не зависит от направления, а каждый анион может притягивать к себе несколько катионов. Следует подчеркнуть, что полностью ионной связи не существует. Корректнее говорить об "ионности", или ионном характере связи. В случае, если разница ЭО составляет более 2 (например, между щелочными металлами и галогенами), происходит почти полная "передача" электрона к более электроотрицательному элементу с образованием соответствующих ионов. Затем следует конкретизировать знания учащихся о строении ионных кристаллов, используя модели, в которых ионы представляют заряженными сферами определенного радиуса (рис. 137 и рис. 140 учебника). После этого учитель дает определение: «Элементарная ячейка — это повторяющаяся идентичная структурная единица кристаллической решетки соединения». 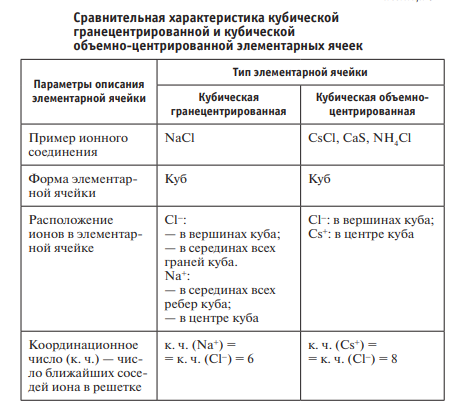 В заключение занятия можно обобщить сведения об ионных соединениях: в ионных соединениях нет отдельных молекул; формула ионного соединения выражает не состав молекулы, а соотношение количества положительных и отрицательных ионов; при комнатной температуре ионные соединения находятся в твердом состоянии (причина — прочная связь ионов в кристалле, и, как следствие, высокая энергия связи); ионные соединения имеют высокие температуры плавления и кипения (работа с таблицей «Температуры плавления неорганических веществ»); ионные соединения не проводят электрический ток в твердом состоянии; ионные соединения обладают электрической проводимостью в растворах и расплавах; ионные соединения растворимы в полярных растворителях (примеры полярных растворителей: вода, метанол, этанол, уксусная кислота), но по мере увеличения радиуса катиона их растворимость уменьшается. 5. Первичное закрепление изученного материала Задания № 4 и 5 после § 54 и проанализировать тенденцию в изменении растворимости в воде ионных соединений в рядах: а) MgСl2 — CaСl2 — SrСl2 — BaСl2 ; б) NaBr — MgBr2 — AlBr3 Крестики – нолики. Показать выигрышный путь, состоящий из формул с ионной связью.
6. Подведение итогов урока Д/з § 54; з. 1, 2, 6, 7 с. 255 7. Рефлексия |
