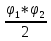Иркутский национальный исследовательский технический университет
 Скачать 30.46 Kb. Скачать 30.46 Kb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования ИРКУТСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ Институт недропользования Скорость химической реакции Отчёт по лабораторной работе по химии Выполнил Поимцева А.Е. Студент группы ТХб-18-5 04.10.2018 Принял Е.Г.Филатова Документ 04.10.2018 Иркутск-2018 Цель работы: изучить понятия «скорость реакции», зависимость скорости реакции от температуры (правило Вант-Гоффа) и концентрации (закон действия масс). Задание: провести реакцию между тиосульфатом натрия и серной кислотой, установить зависимость скорости реакции от концентрации и температуры. Выполнить требования к результатам опытов, оформить отчёт, решить задачу. Теоретическое введение. Скоростью реакции называется изменение концентрации какого-либо из веществ, вступающего в реакцию или образующегося при реакции, за единицу времени. Зависимость скорости реакции от концентрации реагирующих веществ выражаются законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. V=k* 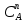 * *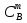 , ,где k- константа скорости реакции; 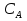 и и 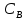 - концентрации реагирующих веществ; n и m- коэффициенты перед веществами Aи B. - концентрации реагирующих веществ; n и m- коэффициенты перед веществами Aи B.Зависимость скорости реакции от температуры выражается правилом Ван-Гоффа: в гомогенной системе при повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2-4 раза: 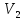 = =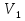 * ү * ү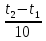 , ,где 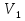 и и 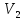 - скорость реакции при температурах - скорость реакции при температурах 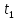 и и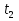 ; ү- температурный коэффициент скорости реакции. ; ү- температурный коэффициент скорости реакции.Выполнение работы. Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ.
V= 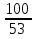 *V=1,9 *V=1,9V= 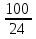 *v=4,2 *v=4,2V= 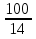 *v=7,1 *v=7,1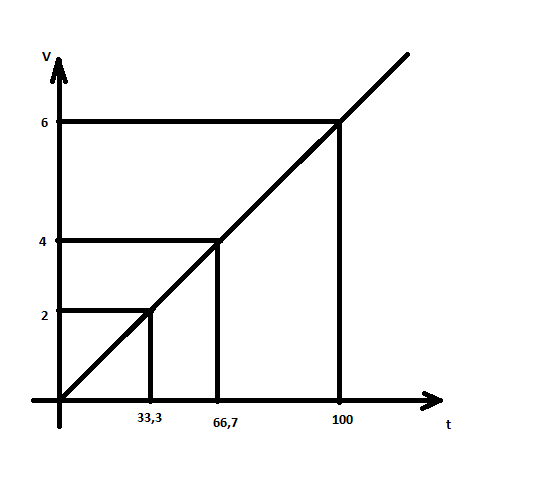
Опыт 2. Зависимость скорости реакции от температуры.
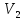 = =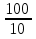 ; ; 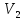 =10 =10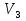 = =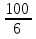 ; ; 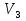 =16,6 =16,6
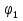 = =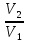 = =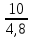 =2,08 =2,08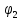 = =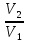 = =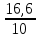 =1,66 =1,66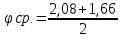 = 1,87 = 1,87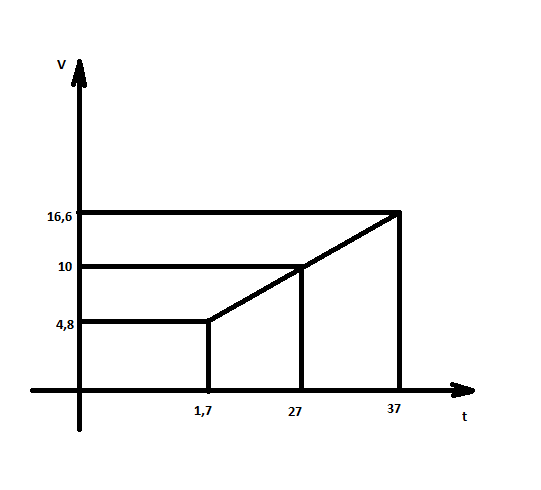 Кривая не проходит через начало координат. Потому что концентрация не равна 0 и соответственно кривая не будет проходить через начало. Вывод: изучила понятия «скорость реакции», зависимость скорости реакции от температуры (правило Вант-Гоффа) и концентрации (закон действия масс). | |||||||||||||||||||||||||||||||||||||||||||||||||||||

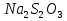 %
%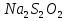
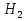 O
O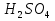
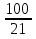 ;
;