Санктпетербургский горный университет кафедра общей химии отчёт по лабораторной работе
 Скачать 86.75 Kb. Скачать 86.75 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ  ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ КАФЕДРА ОБЩЕЙ ХИМИИ ОТЧЁТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №4 По дисциплине: Химия Тема работы: Приготовление раствора и определение его концентрации Выполнил: студент гр. ДГ-20 ___________ /Швец К.С./ Проверил доцент /Шахпаронова Т.С./ Санкт-Петербург 2021 Цель работы: ознакомиться с методами приготовления растворов заданной концентрации и анализом раствора при помощи титрования. Общие сведения Раствор - гомогенная (однородная) система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в определенных пределах. Титрование - Приём количественного анализа, при котором к раствору определяемого вещества по каплям приливают раствор реагента точно заданной концентрации.Состояние системы, в котором аналитическая реакция прошла полностью в соответствии со стехиометрическими уравнениями при отсутствии избытка реагента, называют точкой эквивалентности. Задача титрования – определить эквивалентный объём добавляемого реагента – титранта, необходимый для установления точки эквивалентности, так как в ней числа эквивалентов определяемого вещества и титранта равны между собой. Из определения нормальной концентрации следует, что число эквивалентов вещества в растворе равно произведению нормальности на объём раствора. Следовательно: СN(x)Vx = CN(T)VT До эквивалентной точки в ходе титрования в растворе присутствует избыток определяемого вещества, а после – избыток титранта. Поэтому в эквивалентной точке свойства раствора резко изменяются, в частности, изменяется окраска специально подобранных цветных индикаторов, что позволяет определить эквивалентный объём титрата. Выполнение лабораторной работы. Исходные данные: 1. 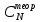 = 0,1 = 0,1 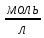 – нормальная концентрация, заданная преподавателем. – нормальная концентрация, заданная преподавателем.2. 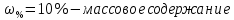 3. 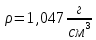 – плотность вещества – плотность вещества4. 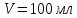 – объем вещества – объем вещества5. 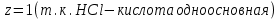 6. Vа =5 мл – объём аликвоты соляной кислоты 7. CNaOH = 0,2 экв/л – концентрация раствора щёлочи Вычисления: а) Определим нормальную концентрацию 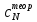 , моль / л раствора соляной кислоты, которую следует получить: , моль / л раствора соляной кислоты, которую следует получить: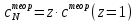 Значит 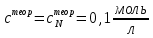 б) Определим массу соляной кислоты (mHCl) в 100 мл раствора соляной кислоты с стеор = 0,1 моль / л 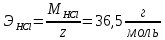 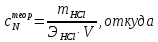 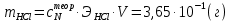 в) Определим объем соляной кислоты Vнач, который необходимо взять 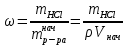 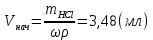 VNaOH, 1 = 2,6 мл; VNaOH,2 = 2,6 мл; VNaOH,ср = 2,6 мл. Протокол лабораторной работы 1. 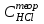 =0,75н- заданная преподавателем концентрация соляной кислоты. =0,75н- заданная преподавателем концентрация соляной кислоты.2. Расcчитали объем соляной кислоты, необходимый для приготовления 100 мл раствора кислоты заданной концентрации: 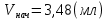 3. Объем аликвоты соляной кислоты, взятый для титрования, Vа =5 мл. 4. Концентрация раствора щелочи CNaOH = 0,2 экв/л. 5. Объем щелочи, пошедший на титрование пробы соляной кислоты: VNaOH, 1 = 2,6 мл; VNaOH,2 = 2,6 мл; VNaOH,ср = 2,6 мл. Обработка результатов эксперимента: 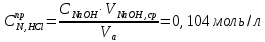 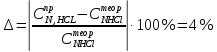 Вывод: ознакомился с методами приготовления растворов заданной концентрации и анализом растворов заданной концентрации и анализом раствора при помощи титрования. По итогам вычисления расхождение практического и теоретического значений оказались 4%, что является допустимым отклоением. |
