Лабораторная работа. МУ ЛАБ 2021 каз. ысаша аннотация
 Скачать 0.76 Mb. Скачать 0.76 Mb.
|
  УДК 546 Құрастырушылар: Кадирбаева А.А. «Жалпы және бейорганикалық химияның таңдаулы тараулары» пәні бойынша лабораториялық жұмысқа арналған әдістемелік нұсқаулық - Шымкент: М. Әуезов атындағы Оңтүстік Қазақстан университеті, 2021 – 36 б. Әдістемелік нұсқаулық «Жалпы және бейорганикалық химияның таңдаулы тараулары» пәнінің оқу жоспары мен типтік (оқу), оқу жұмыс программасы талаптарына сай құралған және курстың практикалық сабақтарының тақырыптарын орындау бойынша барлық қажетті мәліметтерді қамтиды. Қысқаша аннотация Әдістемелік нұсқаулық авторлар жаңадан әзірлеген, оқу процесіне алғаш енгізілген жеті зертханалық жұмыстардың қосылумен «Жалпы және бейорганикалық химияның таңдаулы тараулары» пәні бойынша зертханалық семинар болып табылады. Әдістемелік нұсқаулықта зертханалық жұмыстарды орындаудың қауіпсіздік техникасы, қысқаша теориялық материалдар, жұмысты орындау әдістемелері, талдау мен процесті есептеу әдістемелері және әрбір жұмыс үшін бақылау сұрақтары бар. Әдістемелік нұсқаулық 7М05320 – Химия мамандығында оқитын студенттерге арналған. Рецензент: Абдуразова П.А.-PhD, Сырдария университеті доценті "Химиялық инженерия және биотехнология" жоғары мектебі оқытудың инновациялық технологиялары және әдістемелік қамтамасыз етілуі жөніндегі комитеті ("31".08. 2021ж. хаттама №1) мен Х және ХТН кафедарсы мәжілісінде ("27".08. 2021ж. №2 хаттама) қаралып баспаға ұсынылды. © М.Әуезов атындағы Оңтүстік Қазақстан мемлекеттік университеті, 2021г. Шығарылымға жауапты: Қадырбаева А. А. МАЗМҰНЫ
КІРІСПЕ "Жалпы және бейорганикалық химияның таңдаулы тараулары" пәні магистранттарды жалпы және бейорганикалық химияның білім беру бағдарламаларының негізгі химиялық курстарында қарастырылмайтын немесе аз қамтылған бөлімдеріне тереңдетіп оқытуға арналған, сонымен қатар оларды білу қазіргі химия ғылымының алдыңғы қатарлы идеялары мен нәтижелерін және оның басым бағыттарын түсіну және бағалау үшін қажет. "Жалпы және бейорганикалық химияның таңдаулы тараулары" пәні таңдау бойынша пән болып табылады және «Мамандық модульдері» модуліне 7М05320-Химия білім беру бағдарламасы бойынша ББ құрылымындағына бейіндік пәндер цикліне жатады дайындау бағыты: 7М053 – Химия. Бағдарламаның мақсаты - магистранттардың қазіргі заманғы химиялық дүниетанымын дамыту, олардың қазіргі заманғы теориялық көзқарастары мен жұмыстың ғылыми-эксперименттік әдістері және қазіргі заманғы басым қолданбалы аспектілер туралы қажетті білім алуы. Бағдарламаның міндеттері: - магистранттарды s-, p - және f-элементтерінің қосылыстарын зерттеудегі заманауи бейорганикалық химияның жетістіктерімен таныстыру; - химиялық эксперименттерді ұйымдастыру мен жүргізудің заманауи әдістері мен әдістерімен және бейорганикалық қосылыстарды практикалық қолданудың басым бағыттарымен танысу; - жалпы және бейорганикалық химия саласындағы заманауи ғалымдардың алдында тұрған міндеттерді шешумен байланысты ғылыми-зерттеу және педагогикалық қызметке дайындық; - қазіргі заманауи ғылымдағы бейорганикалық химияның рөлі мен маңыздылығын ашатын пәнаралық қатынастарды құру. Бағдарламаны игеру қорытындысы бойынша білім алушы оқытудың мынадай нәтижелеріне ие болады: Бағалау: -химиялық эксперименттерді ұйымдастыру мен жүргізудің қазіргі заманғы әдістері мен тәсілдері; бейорганикалық қосылыстарды практикалық қолданудың қазіргі заманғы басым бағыттары; құрылымы, ерекшеліктері мен реактивтілігіне байланысты мақсатты өнімдердің синтезін ұйымдастыру принциптері, иондық құрамы мен оларды алу ерекшеліктерін ескере отырып басталған негізгі химиялық реакциялар механизмдері, мақсатты өнімдерді синтездеу бойынша эксперименттерді жоспарлау және іске асыру кезінде туындайтын негізгі ғылыми-техникалық проблемаларды бағалау. Білу: - осы курспен қамтылған элементтер қосылыстарының химиясын еркін игеру. Меңгеруі: - белгілі формулалар мен теңдеулерді қолдана отырып, термодинамикалық және кинетикалық есептеулерді жүргізу әдістері, соның ішінде компьютерлік бағдарламалар, стандартты химиялық өлшеулерді жүргізу, алынған білімді шығармашылық жалпылау дағдыларын қолдану, жазбаша және ауызша түрде өз білімдерін нақты және объективті ұсыну, химиялық синтездің ерекшелігі туралы негізгі білімді меңгеру. Бағдарламаны іске асыру процесінде пайдаланылатын оқыту әдістері мен технологиялары: сөздік әдістер, көрнекі әдістер; оқытудың техникалық құралдарын (ТЖҚ) қолдану, мультимедиялық құралдар, презентация және т. б. ЗЕРТХАНАЛЫҚ САБАҚТАРДЫҢ МАҚСАТЫ МЕН МІНДЕТТЕРІ Зертханалық сабақтардың мақсаты - эксперименттерді орындау барысында алынған теориялық білімді бекіту және тереңдету, зертханалық зерттеулерді жүргізудің практикалық дағдыларын игеру. Зертханалық сабақтардың міндеттері: - әдістемені меңгеру және эксперименттік зерттеулер жүргізу тәжірибесін меңгеру; - химиялық талдаулар жүргізу әдістемесін меңгеру және тәжірибе жинақтау; - техникалық құралдар мен зертханалық жабдықтарды пайдалану дағдыларын игеру; - тәжірибелік деректерді өңдеу, жұмыс нәтижелерін ресімдеу және ұсыну дағдыларын қалыптастыру; - зерттеу нәтижелерін талдау және процестің тиімділігі туралы тұжырымдарды тұжырымдау кезінде шығармашылық қабілеттер мен тәуелсіз шешім қабылдауды дамыту. ЗЕРТХАНАДА ЖҰМЫС ІСТЕУ ЕРЕЖЕЛЕРІ Химиялық зертханада реактивтермен жұмыс істеу кезіндегі қауіпсіздік техникасы Магистрант зертханалық халатта және таза аяқ киімде оқуға рұқсат етіледі; ол тұрақты жұмыс орнында болуы, тазалық, тыныштық пен тәртіпті сақтауы; жабдыққа, ыдыс-аяқ пен реактивтерге ұқыпты қарауы тиіс. Реактивтермен жұмыс істеу кезінде оқу аудиториясынан заттарды қайта орналастыруға немесе шығаруға, олардың дәмін татуға тыйым салынады; қышқылдардың, негіздердің және улы заттардың ерітінділерін ауызбен соруға жол берілмейді, оларды арнайы жабдықталған тамшуырлармен жинау керек; зиянды улы газдармен, от қауіпті және жарылғыш заттармен жұмыс істеу, Ұшпа қосылыстарды булау және қыздыру тек сору шкафында жүргізіледі; құрғақ реагентті тек құрғақ және таза қалақшамен немесе қасықпен алу; күміс, сынап, күшті әсер ететін заттар қосылыстарының пайдаланылған ерітінділерін, органикалық еріткіштерді шығарылған газдарды алыстан сорып алу керек, ауа ағынын ыдыстан өзіңізге сәл бағыттаңыз; шашыраудың алдын алу үшін сұйықтық қызған кезде қайнаған сұйықтықпен ыдысқа еңкеймеңіз. Тыйым салынады: жерлендірілмеген аспаптармен жұмыс істеуге; қосылған аспапты (су моншаларын, спиртовкаларды) қараусыз жылжытуға және қалдыруға; химиялық зертханада тамақ ішуге; жұмыс жоспарында көзделмеген тәжірибелер жүргізуге. Ұшпа сұйықтықтар жанған кезде оларды құммен жабыңыз, содан кейін құмды алып тастаңыз, бетін шайыңыз. Күйіп қалған жағдайда (қыздырылған затпен немесе жалынмен), күйдірілген орынды калий перманганатының күшті ерітіндісімен өңдеңіз, синтомицин эмульсиясымен майлаңыз (алғашқы медициналық көмек жинағынан). Егер теріге қышқыл немесе сілтінің шашырауы түссе, оларды дереу көп мөлшерде сумен жуып тастау керек. Содан кейін терінің зақымдалған аймағын ас содасының ерітіндісімен (қышқыл түскен жағдайда) немесе бор қышқылының ерітіндісімен (сілті түскен жағдайда) өңдеңіз. 1 ЗЕРТХАНАЛЫҚ ЖҰМЫС ГАЛОГЕНДЕР ЖӘНЕ ОЛАРДЫҢ ҚОСЫЛЫСТАРЫ 1 ЖҰМЫСТЫҢ МАҚСАТЫ МЕН МІНДЕТТЕРІ Магистранттарды галогендер және олардың сілтілік қосылыстары негізіндегі химиялық заттардың қасиеттерімен және сапасын бағалау әдіснамасымен таныстыру. 2 ҚЫСҚАША ТЕОРИЯЛЫҚ МӘЛІМЕТТЕР Фтор, хлор, бром, йод және жаңадан ашылған радиоактивті элемент астатин галогендер деп аталатын элементтер тобын құрайды. Астатинді қоспағанда, бұл элементтердің физикалық және химиялық қасиеттері жан-жақты зерттелген. Олар периодтық кестеде VII топты алады және олар үшін физикалық қасиеттердің тұрақты өзгерісі байқалады. Галогендердің туыстығы олардың химиялық қасиеттерінің ұқсастығымен де суреттеледі, бұл топтың әр элементі атомының сыртқы электронды қабығында жеті электронның орналасуымен байланысты. Топтың барлық мүшелері сутекпен қосылыстар түзеді, Атом массасының төмендеуімен қосылыстың жеңілдігі артады. Сол сияқты әр түрлі тұздардың түзілу температурасы галогендердің атомдық массасының жоғарылауымен төмендейді. Галоид қышқылы мен олардың тұздарының қасиеттері олардың ортақтығын көрсетеді; органикалық галоидты қосылыстардың ұқсастығы анық, бірақ олардың химиялық құрамы күрделірек болғандықтан, молекуланың басқа компоненттерінің сипаттамалары мен әсері. Галогендер химия өнеркәсібінде, су мен қалдықтарды тазарту үшін, пластмасса, фармацевтика, целлюлоза және қағаз, маталар, майлау материалдары өндірісінде қолданылады. Бром, хлор, фтор және йод химиялық аралық, ағартқыш және дезинфекциялық заттар ретінде қызмет етеді. Бром мен хлор тоқыма өнеркәсібінде жүнді ағарту және шөгуді болдырмау үшін қолданылады. Бром сонымен қатар алтын алу процестерінде және мұнай мен газ ұңғымаларын бұрғылау кезінде қолданылады. Ол пластмассалар өндірісінде жалынға қарсы құрал ретінде және гидравликалық сұйықтықтар, хладагенттер, ылғал жұтқыштар және шаш бұйралауға арналған құралдар өндірісінде аралық буын ретінде қолданылады. Бром - бұл улы газдар мен отқа төзімді сұйықтықтардың бөлігі. Хлор қалдықтарды тазарту және бассейндердегі ауыз су мен суды тазарту үшін дезинфекциялық құрал ретінде қолданылады. Ол жуу кезінде, сондай-ақ целлюлоза мен қағаз өндірісінде ағартқыш ретінде қызмет етеді. Хлор арнайы аккумуляторлар мен хлорланған көмірсутектерді өндіруде, ет, көкөністер, балық және жемістерді өңдеуде қолданылады. Сонымен қатар, ол отқа төзімді зат ретінде әрекет етеді. Хлор диоксиді тазарту қондырғыларында және бассейндерде суды тазарту, сыртқы дәм мен иісті жою үшін қолданылады. Ол тамақ, былғары, тоқыма, целлюлоза және қағаз өнеркәсібінде ағартқыш, сонымен қатар тотықтырғыш, бактерицид және антисептик ретінде қызмет етеді. Ол теріні тазарту және жұмсарту үшін және целлюлозаны, майларды және балауызды ағарту үшін қолданылады. Азот трихлориді ағартқыш және ұн қоспасы ретінде қолданылған. Йод, сондай-ақ су және ағынды суларды дезинфекциялық, сондай-ақ органикалық емес йодидтер, калий йодиді, және органикалық йод қосылыстар өндіру үшін химиялық аралық ретінде пайдаланылады. Зымыран отынына арналған фтор монооксиді, фтор, бес фторлы бром және үш фторлы хлор - тотықтырғыштар. Фтор сонымен қатар төрт фторлы уранды алты фторлы уранға айналдыруда қолданылады, ал үш фторлы хлор ядролық реакторлар мен мұнай құбырларын кесу үшін отында қолданылады. Флюорит минералындағы кальций фторы фтор мен оның қосылыстарының негізгі көзі болып табылады. Ол шлактың аққыштығын арттыратын ағын ретінде темірді балқыту кезінде қолданылады. Кальций фториді оптика, шыны және электроника өндірісінде де қолданылады. Сутегі бромиді және оның сулы ерітінділері органикалық және бейорганикалық бромидтер өндірісінде, сондай-ақ тотықсыздандырғыштар мен катализаторлар өндірісінде қолданылады. Сонымен қатар, олар хош иісті қосылыстарды алкилдеу үшін қолданылады. Калий бромиді фотопластинкалар мен фотоқағаздар жасау үшін қолданылады. Көптеген өнеркәсіптік синтез процестері, соның ішінде бояғыштар өндірісі үшін көп мөлшерде фосген қажет. Көміртегі хлориді жауынгерлік улы газдарда және фармацевтикалық препараттарда да қолданылады. Бұл элементтердің химиялық қасиеттерінің ұқсастығы олардың физиологиялық әсерінде айқын көрінеді. Газдар (фтор мен хлор) және бром мен йод буы тыныс алу жүйесін тітіркендіреді; осы газдар мен будың салыстырмалы түрде төмен концентрациясын деммен жұту өткір ыңғайсыздықты тудырады, олар тұншығу, жөтел және кеуде қуысының қысылу сезімімен бірге жүреді. Осы әсерден туындаған өкпе тінінің зақымдануы өкпеде сұйықтықтың жиналуын тудыруы мүмкін, бұл өлімге әкелуі мүмкін ісінуге әкеледі. 3 ҚОНДЫРҒЫ СИПАТТАМАСЫ МЕН ӘДІСТЕМЕСІ Хлормен және хлорсутекпен барлық жұмыстарды сорғыш шкафта жүргізу керек! 3.1 Жабдықтар, техникалық және аспаптық құралдар: 1. Аналитикалық таразылар 2. Пробиркалар 3. Хлор алуға арналған қондырғы 4. Химиялық реактивтер 3.2 Жұмыстың жүргізу тәртібі Зертханадағы хлор концентрацияланған тұз қышқылының тотықтырғышпен әрекеттесуі арқылы алынады, ол әдетте марганец диоксиді, калий перманганаты немесе калий дихроматы қолданылады. Хлор өндіруге арналған құрылғы 1 суретте көрсетілген.  1-сурет Хлор алуға арналған қондырғы Тотықтырғыш колбаға (1) құйылады және біртіндеп тамшылатып шұңқырдан (2) тұз қышқылын қосады. Реакция баяулаған жағдайда реагенттері бар колбаны сәл қыздырады. Газ тәрізді хлорды тазарту үшін оны сумен шаю сауыты (3) арқылы және кептіру үшін – қойылтылған күкірт қышқылы бар сауыты (4) арқылы өткізеді. Хлор газы қабылдағышқа жиналады (5), ол сұйық хлор алу қажет болған кезде қатты көміртегі оксидімен салқындатылады (IV). 2) Металл хлоридтерін алу Сорғыштың астына хлор алу және тазарту үшін қолданылатын құрылғыны жинаңыз, оған 1 г темір сымнан тұратын шыны түтікті тоттан тазартып, спиральға ораңыз (сурет.2). 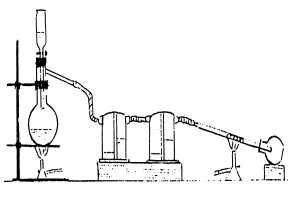 2-сурет Металл хлоридтерін алуға арналған қондырғы Құрылғыдан ауаны шығару үшін хлор тогын алдын-ала өткізіңіз; содан кейін сым салынған түтіктің орнын қыздырыңыз. Қоңыр бу түрінде пайда болған темір (III) хлориді қабылдағыштың суық қабырғаларында конденсацияланады. Реакция аяқталғаннан кейін қабылдағышты тығынмен жауып, алынған хлоридті өлшеңіз, оның шығуын теориялық тұрғыдан есептеңіз. Тазартылған темір хлоридінің бірнеше кристалдарын ерітіңіз ерітіндіде Fe3+ және Cl- иондарының болуын дәлелдеңіз. Дәл осындай әдіспен мырыш хлориді, хром және т. б. алуға болады. 3) хлордың металл емес және күрделі заттармен өзара әрекеттесуі а) хлорды кішкене колбаға жинап, оны шыны табақпен жабыңыз. Хлор бар колбаға қасыққа аз мөлшерде қызыл фосфор қосыңыз. Не байқалады? Реакция теңдеуін жазыңыз. б) алдын ала қыздырылған құрғақ түтіктің түбіне скипидармен(C10H16) суланған сүзгі қағазының бір бөлігін салыңыз. Газ шығаратын түтікті түтіктің түбіне түсіріп, хлорды түтікке өткізіңіз. Не байқалады? Реакция теңдеуін жазыңыз. 4) хлор кристаллогидратын алу Дистилденген суы бар (5-10 мл) пробирканы ұсақталған мұзға салыңыз, су арқылы хлорды өткізіңіз. Хлор гидраттың пайда болған ұсақ кристалдары Cl2⋅6H2O түтікті қолмен қызған кезде тез ериді. Кристаллдарды ерітіп, ерітіндіге көміртегі тетрахлоридін құйыңыз. Түтікті шайқаңыз және су қабаты мен төрт хлорлы көміртектің түзген қабаттарының түсін салыстырыңыз. Хлордың судағы және органикалық еріткіштеріндегі ерігіштігі туралы қандай қорытынды жасауға болады? 5) бром алу және оның қасиеттері Пробиркаға 10-12 мл натрий бромидінің концентрацияланған ерітіндісін құйып, ерітінді арқылы хлор тогын өткізіңіз (ерітіндінің түсінің өзгеруі тоқтағанша). Пробирканың ішіндегісін шағын ретортқа құйып, бромды қармен салқындатылатын таза шағын колбаға айдаңыз. Колбада бром судағы бром ерітіндісінің кішкене қабаты астында қара тамшы түрінде конденсацияланады. Бромнан суды ағызып, шпательдің ұшынан ұнтақты немесе кішкене алюминий жоңқаларын колбаға абайлап салыңыз. Егер бір минуттан кейін реакция басталмаса, колбаның түбіне бір стақан жылы су қойыңыз. Реакция теңдеуін жазыңыз. 6) йод алу және оның қасиеттері а) пробиркаға калий иодидінің 5 мл қаныққан ерітіндісін құйып, ол арқылы хлор тогын өткізіңіз. Алынған затты сүзіп, ауада құрғатыңыз. б) кішкене фарфор шыныаяғына аз мөлшерде құрғақ алюминий ұнтағын (магний немесе мырыш) құрғақ йод ұнтағымен ақырын араластырыңыз (ТӘЖІРИБЕ СОРҒЫШ ШКАФТА ӨТКІЗІЛЕДІ). Дайындалған қоспаға тамшуырмен 1-3 тамшы су қосыңыз. Не байқалады? Бұл тәжірибеде су маңызды рөл атқарады ма? Реакция теңдеуін жазыңыз. 7) хлор, бром және йод суы а) судағы хлор, бром және йод ерітінділері сәйкесінше хлор, бром және йод суы деп аталады. Лакмуста хлорлы, бромды және йод суын сынап көріңіз, галогендердің суда еруімен бірге жүретін реакция теңдеулерін жазыңыз. Тепе-теңдік қай бағытқа ауысады? Хлор иісі кеткенше 2-3 мл хлор суы бар пробиркаға тамшы гидроксиданатрий ерітіндісін құйыңыз. Хлор иісінің жоғалуын қалай түсіндіруге болады? Жаңадан дайындалған бром және йод суларымен ұқсас тәжірибелер жасаңыз. Бром мен йод суының түсінің сілті қосылғғанынан кейін өзгеруін түсіндіріңіз. б) үш пробиркаға 1 мл ерітінді құйыңыз: біреуінде – калий бромиді және қалған екеуінде – калий иодиді. Калий бромиді бар пробиркаға 2-3 тамшы хлор суын қосыңыз, араластырыңыз. Содан кейін 1 мл бензол құйып, пробирканы шайқау арқылы қайтадан араластырыңыз. Калий иодидінің ерітіндісімен де дәл осындай тәжірибе жасаңыз. Үшінші түтікке (KI-мен) 1-3 тамшы бром суын қосыңыз, содан кейін бензолды құйып, жақсылап шайқаңыз. Тәжірибе нәтижелері бойынша қорытынды жасаңыз, реакция теңдеулерін жазыңыз. в) үш пробиркаға 1 мл күкіртсутекті су қосып, біріншісінде - хлорлы, екіншісінде - бромды, үшіншісінде - йодты суда бұлдырлық пайда болғанға дейін тамшылап қосыңыз. Реакция теңдеулерін жазыңыз. 8) галогенид-иондарының қалпына келтіру қасиеттерін салыстыру а) үш құрғақ түтікке кішкене мөлшерде хлорид, бромид және калий иодидің кристалдық тұздарын бөлек салып, әрбір пробиркаға концентрацияланған күкірт қышқылының ерітіндісін бірдей мөлшерде қосыңыз. Реакцияның басында әр түтікте (HCl, HBr, HI) ақ түтіннің шығуын бақылаңыз, содан кейін екінші және үшінші түтіктерде түзілетін бром мен иод – HBr, HI пен H2SO4 тотығу-тотықсыздану нәтижесінде түзілетін қоңыр будың пайда болуын атап өтіңіз. б) KBr и KI ерітінділері бар екі пробиркаға хлорлы темір ерітіндісінің бірнеше тамшысын қосыңыз. Қандай жағдайда темір қалпына келтірілді? Реакция теңдеулерін жазыңыз және галогендік иондардың әр түрлі қалпына келу қабілетін түсіндіріңіз. 9) галогендік иондарға сапалы реакциялар Үш пробиркаға бөлек натрий хлориді, натрий бромиді және калий иодиді ерітінділерінің 3-4 тамшысын салыңыз. Әр түтікке тұмба түзілгенше 1-2 тамшы күміс нитратының ерітіндісін қосыңыз. Олардың түсін белгілеңіз. Тұмбаның азот қышқылы мен аммиак ерітіндісіне қатынасын тексеріңіз. Реакциялардың барлық теңдеулерін жазыңыз. 10) хлораттар мен иодаттардың қасиеттері а) Аз мөлшердегі бертолет тұзына бірнеше тамшы концентрацияланған тұз қышқылы қосыңыз. Әрекеттесуін бақылаңыз және реакция теңдеуі жазыңыз. б) құрғақ түтікке бірнеше кішкентай KСlO3 кристалдарын салыңыз және оны штатив қысқышына бекітіңіз. Тамшуырды пайдаланып, кристаллдарды концентрацияланған күкірт қышқылымен сулаңыз. Реакция теңдеуін жазыңыз, егер ClO2 жасыл-сары хлор диоксидінен басқа HСlO4 пайда болатынын ескеріңіз. в) Араластыра отырып KI-нің сұйылтылған ерітіндісіне хлор суын қосыңыз. Неліктен алдымен қара қоңыр түс пайда болады, содан кейін ол жоғалады? реакциялардың теңдеулерін жазыңыздар. 4 АЛЫНҒАН НӘТИЖЕЛЕРДІ ӨҢДЕУ Әр тәжірибе қорытындысын жазыңыз 5 БАҚЫЛАУ СҰРАҚТАРЫ 1. Галоген терминін түсіндіріңіз? 2. Галогендер мен олардың қосылыстарының адам ағзасындағы рөлі. 3. Галогендер мен олардың қосылыстарының химиялық қасиеттері. 4. Галогендердің химиялық қасиеттері мен маңызы 5. Галогендер мен олардың қосылыстарын қолдану 6. Галогендер мен олардың қосылыстарын алу |
