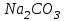отчет. Документ Microsoft Word (2). Исследование гидролиза солей
 Скачать 128.55 Kb. Скачать 128.55 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «НАЦИОНАЛЬНЫЙ МИНЕРАЛЬНО-СЫРЬЕВОЙ УНИВЕРСИТЕТ «ГОРНЫЙ» Кафедра физической химии Отчет по лабораторной работе № 4 По дисциплине: Химия Тема: Исследование гидролиза солей. Автор: студент группы ТПР-14 ___________/ (подпись) (Ф.И.О.) ОЦЕНКА: ____________ Дата: ________________ Проверил: доцент кафедры ВМ ___________/ Жадовский И. Т./ (подпись) (Ф.И.О.) Санкт-Петербург 2014 Цель работы: Ознакомиться с особенностями протекания обмена между электролитами и научиться составлять их уравнения. Общие теоретические сведения. Гидролиз– процесс химического взаимодействия солей с водой. Продуктами гидролиза являются малодиссоциированные соединения в растворе, иногда – осадки или газы. Соответственно соли, образованные сильной кислотой и сильным основанием не гидролизуются (хлориды, нитраты, сульфаты щелочных металлов, стронция, бария). Различают три типа гидролизующихся солей: Соли, образованные сильной кислотой и слабым основанием, гидролизуются по катиону. В процессе реакции происходит выделение H+; реакция среды – кислая. Продуктами реакции могут являться слабое основание или растворимый гидроксокомплекс(pH<7). Соли, образованные слабой кислотой и сильным основанием, гидролизуются по аниону с образованием слабой кислоты или иона кислой соли. В растворах солей этой группы накпливаются ионы гидроксила OH-, в результате чего реакция среды щелочная (pH>7). Соли, образованные слабой кислотой и слабым основанием, гидролизуются по обоим составляющим их ионам с образованием сразу двух слабых электролитов. Среда в растворах таких солей зависит от относительной силы образующихся в результате гидролиза кислоты и основания, но в целом близка к нейтральной. Степень гидролиза многократно выше, чем у солей первых двух групп, гидролизующихся только по одному иону. Если продуктами реакции являются труднорастворимые соединения или газы, то гидролиз протекает полностью. Доля вещества, подвергающаяся гидролизу – степень гидролиза. Константа гидролиза – характеризует способность вещества подвергаться гидролизу. Степень гидролиза солей зависит от ряда факторов, определяемых принципом Ле-Шателье. Чем слабее кислота или основание, образующееся в результате гидролиза, тем выше глубина протекания процесса. С увеличением количества воды, то есть с разбавлением раствора, степень гидролиза возрастает. Поскольку гидролиз всегда протекает с поглощением тепла, является эндотермической реакцией, степень гидролиза повышается при нагревании раствора. Гидролиз солей первой группы может быть подавлен добавлением кислоты, а во второй группе солей – добавлением щелочи. При смешивании растворов солей первой и второй групп происходит взаимное усиление гидролиза. Порядок выполнения работы Опыт №1:«Гидролиз солей»
 Вывод: При гидролизе 2, 3 универсальный индикатор реагирует на катион водорода, и при этом раствор окрашивается в малиновый цвет (сильная кислота, слабое основание - среда кислая). А при гидролизе 1,4 и 5 универсальный индикатор реагирует на присутствие в растворе аниона гидроксида, и при этом раствор окрашивается в тёмно-синий цвет (слабая кислота, сильное основание- среда щелочная). Опыт №2: «Влияние температуры на степень гидролиза» Опустим в пробирку с дистиллированной водой Na2SO3и добавим фенолфталеин. Раствор нагреем. Na2SO3 + H2ONaHSO3 + NaOH 2Na+ + SO32– + HOH 2Na+ + HSO3– +OH– При нагревании бледно-розовая окраска сменяется на ярко-розовую. Вывод: степень гидролиза повышается при нагревании. Опыт №3: Растворение металлов в продуктах гидролиза солей. Наливаем в пробирку раствор ZnCl2. Внесём кусочек Zn. ZnCl2 + H2OZnOHCl + HCl Zn2+ + 2Cl– + HOH ZnOH+ + 2Cl– + H+ Zn2+ + HOHZnOH+ + H+ Zn + 2HCl ZnCl2 + H2 Вывод:Znрастворяется в соляной кислоте и выделяются пузырьки газа Н2. Опыт 4: Взаимное усиление гидролиза при взаимодействии растворов двух солей. В одну пробирку наливаемFeCl3, во вторую Al2(SO4)3, втретью Cr(SO4)3. В первые две пробирки добавимNa2CO3, в третью Na2S.  Вывод: взаимное усиление гидролиза при взаимодействии растворов двух солей. Общие выводыВ процессе работы мы на практике ознакомились с процессом гидролиза. Убедились, что в реакцию гидролиза вступают соли, образованные слабой кислотой и слабым основанием, слабым основанием и сильной кислотой и слабой кислотой и сильным основанием, а соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются, т. к. ионы таких солей не могут образовывать с водой слабых электролитов. В рассмотренных нами случаях гидролизу подвергается не все количество соли, а только часть его, т. е. в растворе устанавливается равновесие между солью и образующими ее кислотой и основанием. Для большинства солей гидролиз – процесс обратимый и протекает примерно на 15 – 20%. Процесс гидролиза может быть ступенчатым (например, гидролиз Al2(SO4)3, FeCl3). Анализируя результаты опытов приходим к выводу, что чем слабее кислота, тем в большей степени подвержены гидролизу ее соли; чем слабее основание, тем в большей степени подвержены гидролизу образованные ею соли Также опытным путем было установлено, что для того, чтобы усилить гидролиз соли, надо разбавить раствор соли или нагреть его. Это обычно позволяет довести гидролиз до конца. |