Исследование оптимальных условий для получения наночастиц серебра. Работу выполнила Ученица 10М класса Бахно Ирина
 Скачать 270 Kb. Скачать 270 Kb.
|
- Усилитель, в котором усиление сигнала (через коэффициент усиления) работает только для сигнала с частотой модуляции, все остальные гасятся.- Регистрирующее устройство, в качестве которого часто используют амперметр, который регистрирует значение силы тока.В атомно-абсорбционных методах концентрацию элемента определяют, используя градуировочные графики или метод добавок. Методом ААС можно определять более 70 элементов. Предел обнаружения элементов методом ААС равен 10-5 – 10-8 % или 10-9 – 10-12 г. Воспроизводимость результатов измерения аналитических сигналов равна 1 – 2 %.3.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.Синтез наночастиц серебра проводили путем восстановления водного раствора нитрата серебра (AgNO3). В качестве восстановителя использовали цитрат натрия (Na3C6H12O7). Все растворы готовили на бидистиллированной воде.Золь готовили смешением растворов нитрата серебра с глюкозой в соотношении объемов 1:1. Обработку смеси проводили раствором гидроксида аммония до рН 8-9, так как размеры наночастиц серебра зависят от рН среды..Золь экспонировали при температуре 96-98°С в течение 120 минут. Полученный золь стабилизировали с использованием токов высокой частоты. Исходные концентрации растворов нитрата серебра и глюкозы были подобраны таким образом, чтобы получаемый золь имел желтую окраску, так как цвет золя коррелирует со средними размерами частиц [2]. Для получения наночастиц (НЧ) серебра применяется реакция Толленса [3]:[Ag(NH3)2] + (aq) + R-CHO(aq) → Ag(s) + -RCOOH(aq),где R-CHO – альдегид или углеводород.Аммиачный комплекс оксида серебра образуется при взаимодействии нитрата серебра с аммиаком:AgNO3 + 3NH3·H2O = [Ag(NH3)2]OH +NH4NO3 + 2H2O.Вследствие высокой восстановительной способности глюкозы на начальном этапе образуется большое количество мелких кластеров, при дальнейшей необратимой агрегации которых получаются более крупные агломераты [Там же]. Тетроборат натрия является одновременно восстановителем и стабилизатором. Продукт окисления цитрат натрия – может адсорбироваться на поверхности НЧ и контролировать их рост. В данных условиях образующиеся НЧ серебра не склонны к агрегации.Предполагаемая схема протекания химической реакции:2AgNO3 + Na3C6H12O7 + H2O Na3C6H12O8 + 2Ag + 2HNO3Для исследования нанокомпозитов использовался комплекс физико-химических методов: оптическая спектроскопия в видимой и УФ областях.Характерной чертой наночастиц является сильное и специфическое взаимодействие с электромагнитным излучением. Особенностью спектров поглощения наночастиц размером более 2 нм является присутствие широкой полосы поверхностно-плазменного резонанса (ППР) в видимой области или в прилегающей к ней ближней УФ-области.Спектральный максимум вблизи 400 нм соответствует ППР изолированных и слабо взаимодействующих наночастиц серебра. На спектре поглощения (рис. 2) фиксируется выраженный максимум при длине волны 430 нм.После экспозиции в течение 7, 14 суток спектр поглощения золя практически не изменяется, что свидетельствует об отсутствии активной агрегации частиц.Максимум при длине волны 430 нм соответствует частицам серебра размерами до 50 нм. В типичной методике синтеза к раствору (10 мл) нитрата серебра определенной концентрации (0,0001 М – 0,005 М) добавляли такой же объем раствора восстановителя (0,001 М – 0,05 М) и доводили рН до заданного значения с помощью раствора аммиака. В качестве восстановителей применяли натрий лимоннокислый.Оборудование и реактивы. Для проведения эксперимента были приготовлены растворы AgNO3 , Na3C6H12O7, C6H8O6,NaBH4,NH3*H2O разной концентрации: AgNO3 5*10-3M; 1*10-3M; 5*10-4M; 1*10-4M; C6H12O6 1*10-2M; 1*10-3M; C6H8O6 1*10-2M; 2*10-2M; NaBH4 1*10-2M; NH3*H2O 25%; «Аскорбиновая кислота с глюкозой» ГОСТ-000906.05 Все реактивы, используемые в работе, имели квалификацию ч.д.а. и дальнейшей очистке не подвергались. Получение наночастиц серебра. К раствору нитрата серебра определенной концентрации добавляли раствор восстановителя ( боргидрида натрия,»). Соотношение объемов 1:1. Приготовленные растворы подвергали нагреванию на плитке (t=96 -980 С) в течение 15 мин. После синтеза гидрозоли серебра исследовались спектрофотометрическим методом, а также визуально отмечалось изменение окраски растворов и/или образования осадка. Спектры поглощения Ag-гидрозоля регистрировали при комнатной температуре в области 300-700 нм на спектрофотометре ПЭ-5400В (кювета (Q) – 1см). Приготовление раствора «цитрата натрия» Готовили раствор с молярной концентрацией равной 0,01моль/л Расчет вели на 500 мл раствора приготовленного m(навески) = 0,0096г: Взвешивали на весах «ОКБ –Веста» с точностью до четвертого знака и растворяли в дистиллированной воде. Приготовление раствора «нитрата серебра» Готовили раствор с молярной концентрацией равной С(AgNO3) = 0,0001М, 0,0005М, 0,001М; 0,005М Расчет вели на 500 мл раствора приготовленного m(навески) = 0,0096г: Взвешивали на весах «ОКБ –Веста» с точностью до четвертого знака и растворяли в дистиллированной воде. 4.Обсуждение результатов После проведенных исследований, было установлено, что эффективными восстановителями являются натрий лимоннокислый. При восстановлении натрий лимоннокислый раствор светло-коричневого (желтого) цвета, что указывает на наличие более мелких частиц серебра. Спектр исходного раствора представлен на рисунках 2 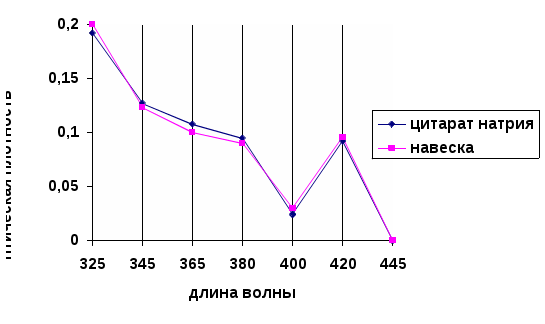 Рисунок 2 - Спектры оптического поглощения исходных растворов Изучение влияния концентрации AgNO3 на величину плазменного пика. Приготовление растворов проводили в соответствии с методикой. Концентрацию растворов AgNO3 варьировали в интервале 0,0001М – 0,005М. Концентрация натрий лимоннокислого была постоянна и равна 0,01М. Полученные результаты представлены на рисунке 3. 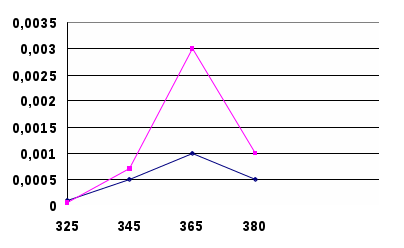 Рисунок 3 - Спектры оптического поглощения гидрозоля серебра, полученного восстановлением AgNO3 глюкозой ( – С(AgNO3) = 0,0001М, - С(AgNO3) = 0,0005М, С(AgNO3) = 0,001М; – С(AgNO3) = 0,005М). Цвет раствора в зависимости от концентрации изменяется от прозрачного и бледно-желтого до ярко-желтого и коричневого. С ростом исходной концентраций ионов серебра наблюдается увеличение максимума поглощения при 420нм, что возможно связано с увеличением количества образующихся наночастиц. Изучение влияния рН на процесс восстановления серебра Приготовление растворов проводили в соответствии с методикой. рН растворов варьировали в интервале 5 – 11. Концентрации натрий лимоннокислый и нитрата серебра были постоянны и равны соответственно 0,001М и 0,001М. Результаты представлены на рисунке 4. 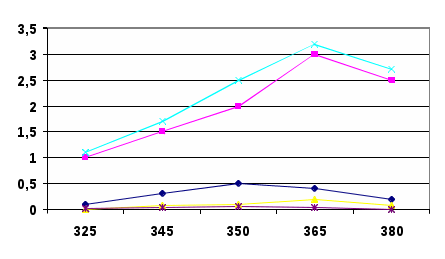 Рисунок 4 - Спектры оптического поглощения гидрозоля серебра, полученного восстановлением AgNO3 цитратом натрия (– рН = 11,21; рН= 10,24;– рН = 8,34; - рН = 7,15; -- – рН = 5,16;). Окраска полученных систем с увеличением значения рН изменялась от бледно-желтой (рН = 5,16) до темно-коричневой (рН = 11,21). Также следует отметить, что растворы с рН = 10,24 и рН – 11,21 являлись неустойчивыми: появлялась муть и практически сразу в осадок выпадало металлическое серебро. Таким образом, из представленных графиков видно, что эффективное значение рН = 8,34, процесс восстановления идет более эффективно. Максимум поглощения наблюдается на длине волны λ = 420 нм. По литературным данным, это соответствует поглощению серебряных частиц размером несколько нанометров [4]. Быстрый рост поглощения в максимуме полосы свидетельствует о формировании в системе новых частиц серебра данного размера. 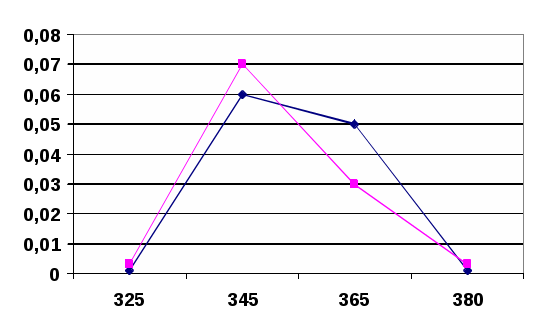 полученного восстановлением AgNO3 натрий лимоннокислый ( С = 0,001М, -С = 0,005М, С = 0,01М, = 0,05М). Исследование влияния концентрации восстановителя – натрия лимоннокислого на свойства получаемых наночастиц серебра Приготовление растворов проводили в соответствии с методикой. Концентрацию растворов глюкозы варьировали в интервале 0,001М – 0,05М. Концентрация нитрата серебра была постоянна и равна 0,001М. Химическое восстановление является многофакторным процессом и зависит от подбора пары окислитель – восстановитель и их концентрации. В работе проведено исследование влияния концентрации восстановителя – глюкозы на свойства получаемых наночастиц серебра. Прирост интенсивности в максимуме полосы поглощения при увеличении концентрации глюкозы, по-видимому, связан с повышением эффективности процесса восстановления Ag+. Исследование оптических свойств наночастиц серебра С помощью спектрофотометра определили коэффициент экстинкции и используя формулу: Cext =24 πRε 3/2м/λε (1) (где R - радиус наночастицы, εм-диэлектрическая проницаемость среды, ε - диэлектрическая проницаемость частиц, λ- длина волны падающего света, Cext - коэффициент экстинкции). Оценили размер наночастицы. Таблица -2
ВЫВОДЫ: 1. В ходе работы ознакомились с методами синтеза наночастиц серебра в водных растворах. 2. Провели синтез наночастиц серебра путем восстановления водного раствора нитрата серебра натрий лимоннокислым. Определены оптимальные условия восстановления серебра: восстановитель – глюкоза; С(AgNO3) = 0,0001М; С(C6H12O6 ) = 0,05М; рН = 8,34. 4.- Установлено, что при восстановлении образуются наночастицы серебра размером до 2,98*10-4 нм; СПИСОК ЛИТЕРАТУРЫ: 1. Б.Г.Ершов Наночастицы металлов в водных растворах: электронные, оптические и каталитические свойства/Ершов Б.Г.//Журнал российского химического общества им. Д.И. Менделеева. – 2001. - Т. XLV, № 3.- С.5-9. 2. Meng Chen Preparation and Study of Polycryamide-Stabilized Silver Nanoparticles through a One-Pot Process/ Meng Chen, Li-Ying Wang, Jian-Tao Han, Jun-Yan Zhang, Zhi-Yuan Li, Dong-Jin Qian//Department of Chemistry and Laboratory of AdVanced Materials, Fudan UniVersity. – 2006. – С.34-38. 3. Кузьмина Л.Н.Получение наночастиц серебра методом химического восстановления/Л.Н.Кузьмина, Н.С.Звиденцова, Л.В Колесников// Журнал Российского химического общества им. Д.И. Менделеева. – 2007. - Т. XХХ, № 8. – С.7 -12. 4. Сергеев Б.М.. Получение наночастиц серебра в водных растворах полиакриловой кислоты/ Б.М.Сергеев, М..В. Кирюхин, А.Н.Прусов, В.Г Сергеев // Вестник Московского Университета. Серия 2. Химия – 1999. – Т.40, №2. – С. 129-133. 5. Lilia Coronato Courrol A simple method to synthesize silver nanoparticles by photo-reduction/ Lilia Coronato Courrol, Flґavia Rodrigues de Oliveira Silva, Laґercio Gomes// EPUSP. – 2007. – Vol.18, №6. –Р.12 – 16. 6. Wanzhong Zhang Synthesis of silver nanoparticles—Effects of concerned parameters in water/oil microemulsion/Wanzhong Zhang, Xueliang Qiao, Jianguo Chen// State Key Laboratory of Material Processing and Die & Mould Technology. – 2007. – Р.17 – 21. 7. Вегера, А.В. Синтез и физико-химические свойства наночастиц серебра/ А.В. Вегера, А.Д. Зимон// Московский государственный университет технологии и управления. – 2006. - 5 – 12. 8. Степанов А.Л. Особенности синтеза металлических наночатиц в диэлектрике методом ионной имплантации/ А.Л.Степанов //Журнал Технического университета Аахена, Германия. – 2007. – С.2 – 7. |
