отчет по химии. лаба. Исследование реакций в растворах электролитов
 Скачать 46.88 Kb. Скачать 46.88 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ С  АНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ Кафедра общей химии Отчётпо лабораторной работе №2 «Исследование реакций в растворах электролитов» Выполнил:студент гр. НД-21-2 __________ /Потапчук У.Н./ (подпись) (Ф.И.О.) Проверил: __________ /________________/ (подпись) (Ф.И.О.) Санкт-Петербург 2022 год Цель работы: Ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять их уравнения. Общие сведения. Электролитической диссоциацией называется процесс распада электролитов на ионы при растворении. Качественная характеристика электролитической диссоциации – степень электролитической диссоциации α. 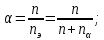 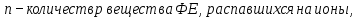 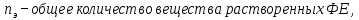 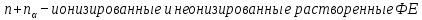 . .Если вещество при растворении не диссоциирует (n=0,  , α=0), то оно неэлектролит. , α=0), то оно неэлектролит.Если α=1, тоn= 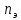 и соединение – сильный электролит. и соединение – сильный электролит.Слабые электролиты: 0<α<<1, а следовательно,n<< 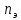 . .Процесс диссоциации слабых электролитов приводит к равновесию между недиссоциированными молекулами и ионами и, следовательно, должен подчиняться закону действующих масс. Так, слабый электролит АВ при растворении в воде диссоциирует по уравнению: AB↔A+ + B- Константа диссоциации Кдисс - постоянная при данной температуре для данного слабого электролита величина, которая связывает между собой равновесные молярные концентрации ионов и недиссоциированных молекул в растворе 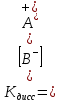 Оборудование и реактивы В штативе: хлорид железа(III), сульфат меди(II), сульфат никеля(II), нитрат свинца(II), иодид калия, хлорид бария, сульфат хрома(III), гидроксид аммония, гидроксид натрия – растворы концентрацией 5 %; метилоранж. В вытяжном шкафу: соляная кислота – раствор концентрацией 15 %; гидроксид натрия, гидроксид калия – 6 н растворы; гидроксид аммония – концентрированный раствор; сульфид натрия – раствор концентрацией 5 %; уксусная кислота – 2 н раствор. Получить у преподавателя: пробирки – 5 шт., стеклянные палочки для перемешивания. Содержание протокола: Опыт №1. Образование малорастворимых оснований: В одну пробирку наливаю 5 капель раствора соли железа (III), в другую – столько же раствора соли меди (II), в третью – раствора соли никеля (II). В каждую пробирку добавляю по несколько капель раствора щелочи до выпадения осадков. FeCl3+3КOH →Fe(OH)3↓+3KCl Fe3++3Cl-+3K++3OH-→ Fe(OH)3↓+3K++3Cl- Fe3++3OH- → Fe(OH)3 При реакции хлорида железа (III) и гидроксида калиянаблюдается появление осадка бурого цвета. CuSO4 + 2KOH →Cu(OH)2↓+K2SO4 Cu2+ + SO42- + 2K++2OH-→ Cu(OH)2↓+2K++SO42- Cu2+ + 2OH- →Cu(OH)2↓ При реакции сульфата меди (II) и гидроксида калия наблюдается появление осадка синего цвета. NiSO4 + 2KOH → Ni(OH)2+K2SO4 Ni2++SO4+2K++2OH-→Ni(OH)2↓+2K++SO42- Ni2++2OH- → Ni(OH)2↓ При реакции сульфата никеля (II) и гидроксида калия наблюдается появление осадка светло-зеленого цвета. Данные (полученные в ходе реакции) гидроксиды не являются сильными основаниями, так как образованные металлами, не относящимися к IФ группе(щелочные металлы) и к IIА группе, способным образовывать сильные основания. Опыт №2. Растворение малорастворимых оснований: Fe(OH)3 + 3HCl→ FeCl3+ 3H2O Fe(OH)3+3H++3Cl-→ Fe3++3Cl-+ 3H2O Fe(OH)3 + 3H+ → Fe3+ + 3H2O При реакции гидроксида железа и соляной кислоты раствор становится желтым. Cu(OH)2 +2HCl→ CuCl2+2H2O Cu(OH)2+2H-+2Cl-→ Cu2++2Cl-+2H2O Cu(OH)2+2H+ → Сu2++2H2O При реакции гидроксида меди и соляной кислоты раствор становится светло- голубым. Ni(OH)2+2HCl→ NiCl+2H2O Ni(OH)2+2H++2Cl-→ Ni2++ 2Cl-+H2O Ni (OH)2+2H+ → Ni2++2H2O При реакции гидроксида никеля и соляной кислоты прозрачно-зеленый раствор. При растворении оснований в кислоте образуется соль металла, образующего основания. Опыт №3. а). Образование малорастворимых солей: Pb(NO3)2+2KI → PbI2↓+2KNO3 Pb2++2NO3-+2K++2I-→PbI2↓+2K++2NO3- Pb2++2I- → PbI2↓ При реакции нитрата свинца (II) и йодида калия образуется ярко-желтый осадок. Pb(NO3)2+BaCl2 → PbCl2+Ba(NO3)2 Pb2++2NO3-+Ba2++2Cl- → PbCl2↓+Ba2++2NO3- Pb2++2Cl- → PbCl2 При реакции нитрата свинца (II) и хлорида бария образуется мутно-белый осадок в виде хлопьев. б). Образование малорастворимых солей. Na2SO4+BaCl2→2NaCl+BaSO4 Ba2++2Cl-+2Na++SO42-→ BaSO4+2Na++2Cl- Ba2++SO42-→ BaSO4 При реакции сульфата натрия и хлорида бария образуется мутно-белый осадок. Cr2(SO4)3+3BaCl2→2CrCl+3BaSO4 2Cr3++3SO42-+3Ba2++6Cl- → 3BaSO4+2Cr3++6Cl- SO42-+Ba(2→ BaSO4 При реакции сульфата хрома (III) и хлорида бария образуется мутно-серый осадок. В каждом из опытов наблюдается образование нерастворимых или малорастворимых осадков. Опыт №4а). Изучение свойств амфотерных гидроксидов: ZnSO4+2NaOH → Zn(OH)2↓+2NaCl Zn²⁺+2Cl⁻+2Na⁺+2OH⁻ → Zn(OH) 2↓+2Na⁺+2Cl⁻ Zn²⁺+2OH⁻ → Zn(OH) 2↓ При реакции соли цинка (II) и гидроксида натрия выпадает белый осадок в виде хлопьев. Zn(OH) 2+2HCl → ZnCl2+2H2O Zn(OH) 2+2H++Cl-→ Zn2++2Cl-+2H2O Zn(OH) 2+2H+→ Zn2++2H2O При реакции гидроксида цинка и соляной кислоты осадок растворяется. Zn(OH) 2+2NaOH → Na2ZnO2+2H2O Zn(OH) 2+2Na++2OH- → 2Na++ZnO22-+2H2O Zn(OH) 2+2OH- → ZnO22-+2H2O При реакции гидроксида цинка и гидроксида натрия осадок растворяется. б). Изучение свойств амфотерных гидроксидов: Al2(SO4)3+6NaOH → 2Al(OH)3↓+3Na2SO4 2Al+3+3(SO4) -2+6Na++6OH- → 2Al(OH)3↓+6Na++3(SO4) -2 Al++3OH- → Al(OH)3↓ При реакции сульфида алюминия и гидроксида натрия выпадает белый осадок в виде хлопьев. Al(OH)3+3HCl(разб.) → AlCl3+3H2O Al(OH)3+3H++3Cl- → Al3++3Cl-+3H2O Al(OH)3+3H+ → Al3++3H2O При реакции гидроксида алюминия и соляной кислоты осадок растворяется. Al(OH)3 NaOH(конц. ) → Na[Al(OH)4] Al(OH)3+Na++OH- = Na++[Al(OH)4]- Al(OH)3+OH- → [Al(OH)4]- При реакции гидроксида алюминия и гидроксида натрия осадок растворяется. в). Изучение свойств амфотерных гидроксидов: Cr2(SO4)3+6NaOH(разбав) → 2Cr(OH)3↓+3Na2SO4 2Cr3++3SO42-+6Na++6OH- → 2Cr(OH)3↓+6Na++3SO42- 2Cr3++6OH- → 2Cr(OH)3↓ При реакции сульфата хрома (III) и гидроксида натрия происходит окраска раствора в болотисто-зеленый цвет. Cr(OH)3+3HCl → CrCl3+3H2O Cr(OH)3+3H++3Cl- → Cr3++3Cl-+3H2O Cr(OH)3+3H+ → Cr3++3H2O При реакции гидроксида хрома (III) и соляной кислоты раствор становится мутным и серым. Cr(OH)3+3NaOH(конц) → Na3[Cr (OH)6] Cr(OH)3+3Na++3OH- → 3Na++[Cr (OH)6]3- Cr(OH)3+3OH- → [Cr (OH)6]3- При реакции гидроксида хрома (III) и избытка раствора гидроксида натрия осадок растворяется. Опыт №5. Образованиемалодиссоциированных соединений: NH4Cl+NaOH → NaCl+NH3↑+H2O NH4++Cl- + Na++OH- → Na++Cl-+NH3+H2O NH4++OH- → NH3+Н2О В результате реакции хлорида аммония и гидроксида натрия произошло выделение аммиака. Опыт №6. Образование комплексов: 2CuSO4+2NH3 +5H2O→ (CuOH)2SO4↓+(NH4)2SO4 2Cu2++2SO42-+2NH3+5H2O → (CuOH)2SO4↓+2NH4++SO42- 2Cu2++SO42-+2NH3 +5H2O → (CuOH)2SO4↓+2NH4- В результате реакции образовался осадок зелено-голубого цвета (сульфат гидроксомеди(II)). (CuOH)2SO4+10NH4 * H2Oконц= [Cu(NH3)4](OH)2+(NH4)2SO4+8H2O В результате реакции произошло растворение голубого осадка с образование раствора аминокомплекса меди синего цвета. Опыт №7. Образование газов: Na2CO3+H2SO4→ Na2 SO4+CO2+H2O 2Na++CO32-+2H++SO42- → 2Na++SO42-+CO2+H2O CO32-+ 2H2-→ CO2+H2O В результате реакции карбоната натрия и серной кислоты произошло выделение углекислого газа. Вывод: в ходе лабораторной работы я ознакомилась с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научилась составлять их уравнения. |
