История открытия
 Скачать 264.34 Kb. Скачать 264.34 Kb.
|
|
Сера — элемент 16-й группы , третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. sulfur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде. История открытия Точное время открытия серы не установлено, но этот элемент использовался до нашей эры. Сера использовалась жрецами в составе священных курений при религиозных обрядах. Она считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII века китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы. Природные минералы серы Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и в связанном виде. Важнейшие природные минералы серы: FeS2 — железный колчедан, или пирит, ZnS — цинковая обманка, или сфалерит (вюрцит), PbS — свинцовый блеск, или галенит, HgS — киноварь, Sb2S3 — антимонит, Cu2S — халькозин, CuS — ковеллин, CuFeS2 — халькопирит. обусловливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах. В земной коре содержится около 0,047% серы. В водах Мирового океана ее концентрация составляет около 1 г/л (главным образом в виде растворенного сульфата магния MgSO/(). обусловливает «постоянную» жёсткость пресной воды. В атмосфере сера присутствует в очень малых концентрациях. В атмосферу это вещество попадает при извержении вулканов в виде серного ангидрида S03, сернистого газа S02, сероводорода H2S и элементарной cepы. Сера активно циркулирует между атмосферой, гидросферой и литосферой. Для круговорота этого элемента характерен обширный резервный фонд в литосфере 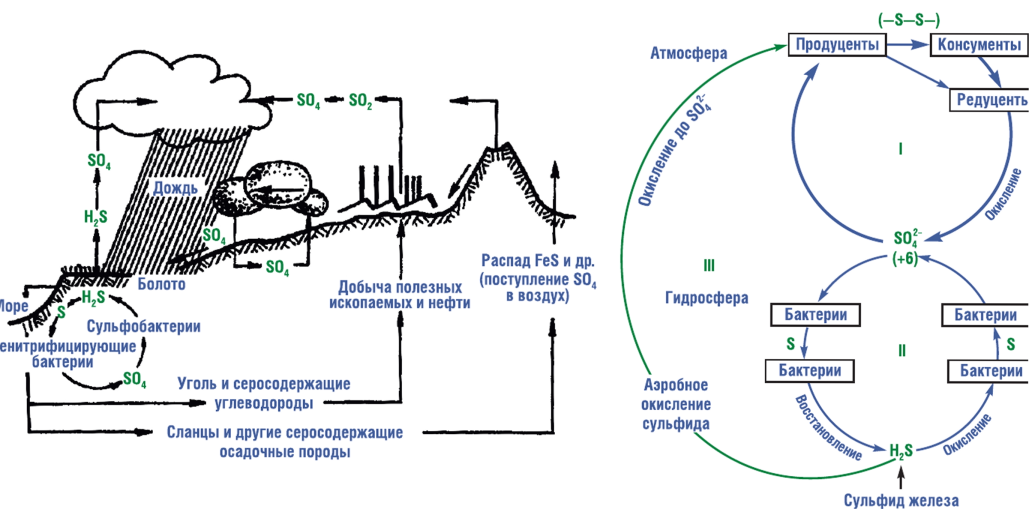 В почву сера попадает в результате естественного разложения серосодержащих горных минералов (в частности, серного и медного колчеданов) вместе с атмосферными осадками, а также при разложении природных органических веществ В почве круговорот серы осуществляется в основном за счет широкого спектра бактерий. Среди них имеются как бактерии, восстанавливающие соединения серы (сульфаты) до сероводорода, так и аэробные микроорганизмы, окисляющие соединения серы органических остатков до сульфатов. Сульфаты поглощаются растениями и вновь попадают в круговорот. Перемещение растворимых в воде соединений серы происходит при выветривании коры из литосферы в гидросферу с речным стоком. Обратно на сушу из Мирового океана серы поступает значительно меньше с воздушными массами, когда сера возвращается в атмосферу из вод в виде сероводорода и окисляется здесь до двуокиси серы (S02), которая, соединяясь с парами воды, превращается в сернистую кислоту. Основное накопление серы происходит в океане, куда сульфатные ионы непрерывно поступают с суши с речным стоком. Обитающие в водной среде некоторые бактерии способны концентрировать серу в своих организмах. После их отмирания происходит накопление серы на дне морей и океанов. Сера, находящаяся в глубоководных отложениях, в свою очередь подвергается воздействию анаэробных микроорганизмов (сульфатредупирующих бактерий), в результате образуется сероводород (Ii2S), который, поднимаясь в верхние слои воды, частично окисляется растворенным в воде 02. Вред и польза Кислотные дожди как одна из глобальных проблем загрязнения окружающей среды Одними из главных причин кислотных осадков:· сгорание топлива, применение химикатов, автотранспорт и т.д.· стабильность атмосферы, частота выпадения осадков, присутствие индивидуальных компонентов атмосферы· скопление примесей в нижней тропосфере Химические превращения соединений серы: Сера входит в состав в неполностью окисленной форме (степень окисления ее равна 4). Если соединения серы находятся в воздухе в течение достаточно длительного времени, то под действием содержащихся в воздухе окислителей они превращаются в серную кислоту или сульфаты. Прямое воздействие соединений серы на человека. Естественно, атмосферные кислотные микроэлементы не щадят и человека. Однако здесь речь идет уже не только о кислотных дождях, но и о том вреде, который приносят кислотные вещества (двуокись серы, двуокись азота, кислотные аэрозольные частицы) при дыхании. Уже давно установлено, что существует тесная зависимость между уровнем смертности и степенью загрязнения района. При концентрации около 1 мг/м3 возрастает число смертельных случаев, в первую очередь среди людей старшего поколения и лиц, страдающих заболеваниями дыхательных путей. Статистические данные показали, что такое серьезное заболевание, как ложный круп, требующее моментального вмешательства врача и распространенное среди детей, возникает по этой же причине. То же самое можно сказать и о ранней смертности новорожденных в Европе и Северной Америке, которая ежегодно исчисляется несколькими десятками тысяч. Применение соединений серы в сельском хозяйстве. Для устранения избыточной щелочности солонцовых и солонцеватых почв проводят гипсование — внесение гипса CaS04 -2H20 (см. гл. 16). Катионы предпочтительно вносить в почву в виде сульфатов, потому что сера — биогенный элемент, который может быть использован растением. Так, в мировом производстве азотных удобрений сульфат аммония (NH^SC^ составляет около 25%. Меньше производят сульфата калия K9SO4. Многие микроудобрения, например CuS04-5H20, MnS04*7H20, Z11SO4 • 7H2Q вносят в почву в виде сульфатных добавок к фосфорным или азотным макроудобрениям. |
