реферат философия. История развития химии индола и его биологически активных производных
 Скачать 190 Kb. Скачать 190 Kb.
|
|
Министерство образования и науки Российской Федерации Московский государственный университет тонких химических технологий им. М.В. Ломоносова кафедра философии Реферат по истории науки На тему: «История развития химии индола и его биологически активных производных» Научный руководитель: д.х.н., проф. Себякин Ю.Л. Руководитель от кафедры философии: д.ф.н., проф. Иванова А.А. Аспирант кафедры ХТБАС: Истомина О.В. Москва - 2012 Оглавление Введение 3Индол и индольные алкалоиды: синтез и биологическая активность 4Оксигенированные производные индола: индоксилы и индогениды 7Новые направления развития химии индолов 12Список используемой литературы 15ВведениеИнтерес к химии индолов обусловлен значительными синтетическими возможностями этого класса соединений. Индол и его производные широко используются в качестве промежуточных продуктов для синтеза лекарственных препаратов, индигоидных красителей и пестицидов. Индолиноновая структурная основа алкалоидов триптантрина и индирубина, а также их синтетических аналогов халконового типа в настоящее время широко используется в качестве скаффолдов в поиске лекарственных препаратов широкого профиля действия, в том числе, антилейкозных, нейропротекторных, противоопухолевых и противотуберкулезных. Индол и индольные алкалоиды: синтез и биологическая активностьХимия индола зародилась в середине XIX века и неразрывно связана с деятельностью выдающегося немецкого химика-органика, лауреата Нобелевской премии по химии, Адольфа фон Байера. Индол, также называемый бензопирролом, - гетероциклическое органическое соединение, встречающееся в некоторых эфирных маслах, таких как жасмин, и каменноугольной смоле. Слово индол происходит от слова «Индия». Этот голобой краситель, ввезенный из Индии, был известен как «индиго» в шестнадцатом веке. Химическая деградация красителя давала оксигенированные индолы, которые были названы индоксилами и оксииндолами. Сам индол впервые был выделен Байером в 1866 году путем восстановления оксииндола цинковой пылью. Позже, в 1869 году, совместно с немецким химиком Эмерлингом он синтезировал индол сплавлением орто-нитрокоричной кислоты с гидроксидом калия, а затем и его производные, в том числе изатин. В 1882 году Байер осуществил синтез индиго из 2-нитробензальдегида и ацетона в щелочной среде. В 1883 году немецкий химик Эмиль Фишер предложил метод получения замещенных по второму и/или по третьему положениям индолов путем конденсации фенилгидразина с альдегидами или кетонами в кислой среде (схема 1). Частный случай этой реакции – получение индола из фенилгидразина и пировиноградной кислоты с последующим декарбоксилированием образующейся индол-2-карбоновой кислоты. Этот метод до настоящего времени остается наиболее важным и гибким способом синтеза индолов.  Схема 1. Синтез индолов по Фишеру. Многие ученые XIX – XX вв. предлагали свои методы синтеза индола и его производных. Так, в 1892 году немецкие химики Бихлер и Мёхлау синтезировали 2-фенилиндол из α-бромацетофенона и анилина. Этот метод не получил широкое распространение из-за суровых условий реакции. Позже он был модифицирован путем введения бромида лития в качестве катализатора. В 1897 году Райссерт провел серию реакций, направленных на получение индола и его 4- и 5-замещенных производных из орто-нитротолуола и диэтилоксалата (диэтилового эфира щавелевой кислоты) в присутствие этилата натрия. Позже, в 1945 году, было показано, что с этилатом калия достигаются лучшие результаты. В 1929 году румынский химик-органик Костин Неницеску синтезировал производные 5-гидроксииндолов из бензохинона и эфиров -аминокротоновой кислоты [1]. В 70 – 80-х гг. XX в. были проведены синтезы Хеместсбергера (получение эфиров 2-индолкарбоновых кислот путем термического разложения эфиров 3-арил-2-азидоакриловой кислоты), Гассмана (получение замещенных индолов из анилина) [2] и Бартоли (получение замещенных индолов из орто-замещенного нитробензола и винилмагнийбромида) [3]. В 1998 году Ларокк [4] синтезировал замещенные индолы из орто-йоданилинов и дизамещенных алкинов. В присутствие карбоната или ацетата палладия и одного эквивалента хлорида лития были достигнуты самые высокие выходы. Главной причиной большого интереса к индолам и их производным является широкий спектр проявления их биологической активности. Природная аминокислота триптофан в результате метаболизма в организме превращается в серотонин - вещество, от концентрации которого в головном мозгу зависит психическая уравновешенность человека. Триптофан является также исходным веществом при синтезе мексамина, который используется для профилактики и лечения лучевой болезни, и мелатонина, применяемого как снотворное. 3-Индолилуксусная кислота способна ускорять рост растений. Производное 3-индолилуксусной кислоты, называемое индометацином, является активным противовоспалительным средством (применяют при ревматизме, подагрическом артрите и других воспалительных заболеваниях). Индометацин обладает ненаркотическим анальгетическим действием и ингибирует биосинтез простагландинов. Помимо триптофана, индиго и индолилуксусной кислоты, многочисленные соединения, выделяемые из растительных или животных источников, содержат индольную молекулярную структуру. Наиболее известная группа этих соединений - индольные алкалоиды, многие из которых уже выделены из растений, представляющих более чем тридцать семейств. Среди этой группы можно выделить псилоцин, псилоцибин, резерпин, стрихнин, атипрозин, винкристин и др. Известно, что индольные алкалоиды обладают разного рода биологической активностью. Известен ряд индольных алкалоидов, обладающих высокой противотуберкулезной активностью: криптолепин, неокриптолепин и димер бискриптолепин, а также пентациклические индолы - алкалоиды ибогаин и воакангин [5]. Быстрое развитие лекарственной устойчивости, токсические и побочные эффекты существующих противотуберкулезных препаратов, отсутствие бактерицидных средств против устойчивых штаммов микобактерий, свидетельствуют о необходимости создания качественно новых противотуберкулезных средств. Так, было обнаружено, что резерпин, первый полный синтез которого был осуществлен в 1956 г. американским химиком-органиком Робертом Вудвордом, а несколько позднее был разработан синтетический метод получения резерпина в нашей стране - во ВНИХФИ профессором О.Ю. Магидсоном, является антимикобактериальным агентом с противотуберкулезной активностью, сравнимой с этамбутолом, используемым в комбинации с другими препаратами для профилактики и лечения устойчивых к лекарствам форм туберкулеза. Оксигенированные производные индола: индоксилы и индогенидыСреди всего многообразия производных индола очень большой интерес вызывают его оксигенированные производные, главным образом индоксилы. Химия индоксила тесно связана с химией индиго, так как индоксил является исходным веществом для получения синего красителя - индиго. Индоксил встречается в природе в виде глюкозида индикана, в растениях Indigofera, произрастающих в Восточной Азии, и в вайде (синили), Isatis tinctoria, культивировавшейся в Европе для изготовления красителя. Гидролиз индикана, как ферментативный, так и кислотный, приводит к образованию индоксила, который легко окисляется в индиго кислородом воздуха. Впервые синтез индоксила был выполнен Байером еще в конце XIX века. Байер обнаружил, что этиловый эфир орто - нитрофенилпропаргиловой (пропиловой) кислоты под действием холодной концентрированной серной кислоты превращается в эфир изатогеновой кислоты, который восстанавливается сульфидом аммония до эфира индоксил-2-карбоновой кислоты. Последний после щелочного гидролиза теряет при нагревании двуокись углерода и дает раствор индоксила (схема 2). 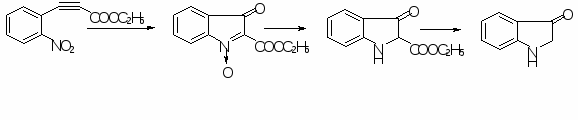 Схема 2. Синтез индоксила по Байеру. Гейман в своем первом синтезе индиго (1890 г) получил индоксил из фенилглицина, но не выделил его. Фенилглицин при сплавлении с едким натром или едким кали при 2600С дает индоксил, который может быть легко превращен в краситель [6]. Было найдено, что этот метод дает низкие выходы красителя. Многочисленные изменения позволили существенно повысить выход индоксила из фенилглицина [6]. Использование цианидов позволило снизить температуру плава до 1200С, а также способствовало немедленному удалению воды из сферы реакции, что привело к увеличению выхода индоксила. Рассматриваемый метод синтеза был распространен и на этиловый эфир анилиномалоновой кислоты [6]. Последний циклизуется при нагревании до 200 - 2600С в эфир индоксиловой кислоты, который может быть после гидролиза и декарбоксилирования превращен в индоксил. Синтез индоксила по второму способу Геймана основан на образовании индоксила из антраниловой кислоты через индоксил-2-карбоновую кислоту, которая получается при сплавлении орто-карбоксифенилглицина со щелочью [6]. Индоксильные алкалоиды широко распространены в природе и давно привлекли к себе внимание исследователей благодаря потенциальным фармакологически полезным свойствам. За последние годы появились данные о различных видах биологической активности - противовоспалительной, антимитотической, нейропротектор- ной и т.д. - 2- и 3-индолинонов и получаемых из них гетероциклов. Основой хемопревентивной активности скаффолдов этого ряда считается Михаэль-акцепторный фрагмент. Этот фрагмент сочетает в своей структуре как енаминовый, так и α,β-еноновый, то есть халконовый фрагменты. Таким образом, соединения, содержащие в своей структуре данный фрагмент, вызывают интерес у исследователей. 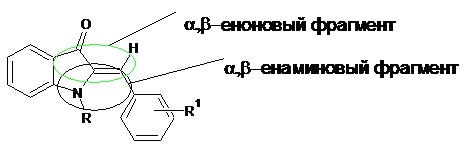 Арилиден-индолиноновая структурная основа природных алкалоидов индирубина и триптантрина и их синтетических аналогов в настоящее время широко используется в качестве скаффолдов в поиске лекарственных препаратов широкого профиля действия. Индирубин был получен Байером и Эмерлингом в 1870 году в качестве побочного продукта синтеза индиго. Впервые индирубин как главный продукт был синтезирован в 1881 году конденсацией изатина (индол-2,3-диона) с индоксилом в присутствии карбоната натрия в спиртовом растворе. Этот метод получения индирубина актуален и на сегодняшний день, однако чаще используются его модификации: конденсация изатина с индоксилом в щелочной среде и конденсация изатина с О-ацетилиндоксилом в метаноле. Другой метод синтеза предполагает конденсацию 2-хлориндоленина-3-она и 2-индолинона при нагревании в колбе с обратным холодильником в среде сухого толуола. Индирубин используются в традиционной китайской медицине для лечения хронической лейкемии. Противоопухолевое действие индирубина хорошо коррелируется с его антимитотическими свойствами. Недавно было установлено, что индирубин является мощным ингибитором циклин-зависимых киназ и гликоген-синтазы-киназы-3β - регуляторов клеточного цикла [7]. В китайской народной медицине он также применяется для лечения туберкулеза [8]. Несмотря на свою высокую ингибиторную активность, доказанную в клинических исследованиях против хронической миелоцитарной и хронической гранулоцитарной лейкемии (у 26% пациентов отмечена полная ремиссия, у 36% - частичная), индирубин как препарат имеет ряд существенных недостатков. Он обладает плохой растворимостью, слабой резорбцией и гастроинстициальной токсичностью. Поэтому необходим поиск его производных с благоприятным набором физико-химических свойств. Интересными соединениями оказались 2-арилиден-1Н-индол-3-оны (названные Байером индогенидами) и 3-арилиден-1Н-индол-2-оны. За последние годы появились данные о различных видах биологической активности - противовоспалительной, антимитотической, нейропротекторной и др. - 2- и 3-индолинонов и получаемых из них гетероциклов. Моноаминооксидазы (МАО) - семейство мембранно-связанных белков, которые катализируют оксидативное деаминирование биогенных аминов, в частности, таких как триптамин и серотонин. Способностью к ингибированию этих белков обладает целая группа соединений, известная как МАО ингибиторы, которые используются в качестве терапевтических средств при различных патологических состояниях. Во второй половине 1980-х гг. было опубликовано много сообщений о существовании в цитозоле различных тканей, плазме, моче и спинномозговой жидкости эндогенных факторов, также способных ингибировать активность моноаминооксидаз. Эти эндогенные ингибиторы были названы «трибулином». Впоследствии трибулин был отождествлён с изатином. В экспериментах invitro некоторые индогениды показали себя как ингибиторы МАО [9]. Целью работы отечественных ученых [9] стало исследование новых, селективно действующих МАО ингибиторов класса производных 3-индолинона. Целенаправленное введение различных заместителей во 2-ое положение индолин-3-оновой системы обнаружило явную закономерность между ингибирующим эффектом этих соединений на активность МАО и структурой индоксильного производного. В ходе работы подтвердились данные о том, что изатин является селективным ингибитором МАО В. Введение различных заместителей во 2-ое положение индоксила резко меняло свойства полученных соединений. В противоположность изатину, производные индоксила показали себя более мощными ингибиторами МАО А, чем МАО В. Из всех исследованных веществ, эффективно и селективно ингибирующих МАО А, наиболее активными являются 2-бензилиден-3-индолинон и 2-(пара-нитро)бензилиден-3-индолинон. Фосфорилирование белков по их сериновым, треониновым и тирозиновым остаткам с использованием аденозинтрифосфата (ATP) или гуанозин-5’-трифосфата (GTP) в качестве фосфорилирующего агента рассматривается как один из главных посттрансляционных механизмов, используемых клетками для настройки их метаболических и регуляторных путей. Ненормальное фосфорилирование является причиной или следствием ряда человеческих заболеваний, таких как рак, болезнь Альцгеймера, диабет и атеросклероз. Повышенная активность циклин-зависимых киназ (CDKs) или отклонение от функциональной нормы других киназ, как было установлено, лежит в основе механизма патологического размножения клеток. Следовательно, ингибирование CDKs может стать способом лечения опухолевых заболеваний. К тому же поскольку рост и метастазирование опухоли зависит от ангиогенеза, капиллярные эндотелиальные клетки, вросшие в опухоль, могут стать мишенью при терапии рака. Недавние исследования показали зависимость между блокированием факторов роста, ингибированием киназ и ингибированием разрастания эндотелиальных клеток и ангиогенеза [10]. Так, в начале 2000-х гг. было показано [10], что производные 2-оксииндола весьма перспективны в качестве ингибиторов киназ после обнаружения у некоторых представителей этого класса соединений (семаксаниб и санитиниб) способности к ингибированию тирозин-киназы. С другой стороны соединение SU9516, имеющее схожую структуру, ингибирует GSK (гликоген-синтазы-киназы), что вызывало апоптоз в колонии клеток карциномы. Классический способ образования индогенидов состоит в конденсации индоксила с ароматическими альдегидами (схема 3). В связи с тем, что индоксил крайне неустойчив на воздухе и быстро превращается в индиго, то в реакции чаще используют его N,O-диацетильное или N-ацетильное производные. При проведении конденсации N-ацетилиндоксила с ароматическими альдегидами в присутствие водного раствора щелочи образуется N-незамещенные индогениды, нагревание N-ацетилиндоксила в бензоле позволяет провести конденсацию с сохранением N-ацетильной группы.  Схема 3. Синтез индогенидов. Новые направления развития химии индоловВидное место среди биологически активных гетероциклов природного и синтетического происхождения занимают конденсированные индолы, в которых индольный фрагмент сочленен ребром [a] или [b] с другим карбо- или гетероциклом. Многочисленные представители индологетероциклов стали прототипами синтетических лекарственных препаратов. В частности известно о противотуберкулезной активности спироиндолинов, спироиндолинонов и спиропирролотиазолов. Физостигмин, имеющий пирролиндольную структуру, является одним из основных представителей антихолинэстеразных веществ обратимого действия. Митомицин, также имеющий пирролиндольную основу, - цитостатический препарат из группы противоопухолевых антибиотиков, угнетающий синтез ДНК, а также снижающий количество РНК в клетке и ингибирующий синтез белка, особенно в поздних (G1 и S) фазах митоза. В настоящее время химия индола активно изучается, в том числе и в России, в частности в лаборатории синтеза биологически активных гетероциклических соединений (СБАГС) ИНЭОС РАН. Основная работа направлена на получение:
Кроме того, в лаборатории СБАГС проводится получение пирролиндолов путем конденсации индогенидов с эфирами -аминокротоновой кислоты. Предполагаются испытания биологической активности полученных соединений. В дальнейшем планируется получение и изучение нового поколения гибридных молекул на основе индолинонового скаффолда, модифицированного порфириновыми фрагментами. Порфирины, как и индолы, уже длительное время успешно используются в терапии онкологических заболеваний. Кроме того, известны примеры применения природных порфиринов для лечения инфекционных заболеваний. Важно, что комплексообразующая способность порфириновой части гибридной молекулы может вмешаться в систему бактериального транспорта железа и способствовать созданию его дефицита, между тем, при отсутствии железа жизнедеятельность бактерий становится невозможной. Для получения целевых гибридных структур предполагается использовать доступные исходные соединения индольного и порфиринового рядов – замещенные фармакофорными группами индоксилы, формилпорфирины и формилхлорины. Данные метиленактивные соединения, как правило, легко вступают в реакцию кротоновой конденсации с альдегидами, в том числе, нет никаких противопоказаний против протекания подобных реакций с альдегидами порфиринового и хлоринового рядов. Таким образом, планируется синтез целевых гибридных халконов всего в одну лабораторную стадию. Далее предполагается изучение таких свойств целевых соединений, как реакции электрофильного и нуклеофильного присоединения и замещения, гетероциклизации, а также испытания биологической активности полученных соединений. Список используемой литературы
|
