|
ееееее. Iv, V, VI аналитикалы_ топ катиондарыны_ _оспасыны_ анализ жолы.. IV, V, vi аналитикалы топ катиондарыны оспасыны анализ жолы
IV, V, VI аналитикалық топ катиондарының қоспасының
анализ жолы
http://www.ncfu.ru/export/uploads/imported-from-dle/op/doclinks2017/LR-po-analitike.pdf
Жүйелі анализдеу барысы
1. Анализ жасамас бұрын, ерітіндінің түсіне және тұнбаның бар, жоғына назар аудару қажет. Fe2+, Fe3+ және Sb3+ катиондарын алдын ала жеке бай-қаулар арқылы анықтауға болады.
2. Егер анықтайтын ерітіндіде тұнба болса, оны араластырып, 35-40 там-шысын сынауыққа тамызып 2н азот қышқылының 8 тамшысын қосып, шыны таяқшамен араластырады және 4-5 минут су моншасында қыздырады. Тұнба қара түсті болмаса, оны сүзгіш қағаздан өткізіп, сұйытылған азот қышқылымен жуады, содан соң сүзгіш қағазда бірнеше тамшы күкіртті сутек суын тамызады. Sb3+ ионы болса, тұнба қызғылт-сары түске боялады. Егер қыздырғаннан соң қара немесе қара-қоңыр түске өзгерсе Sb3+ ионынан басқа тотықсызданған висмут және сынап бар деп болжауға болады. Мұндай жағдайда тұнбаны фарфор табақшасына салып, оны 4-6 тамшы концентрленген азот қышқылында ерітіп, оған 5-7 тамшы дистилденген су қосып сұйылтып Si3+, Sb3+, Sb3+, Hg2+ катиондарын анықтайды.
3. Сұйытылған азот қышқылында тұнба толық ерісе, төртінші топ катион-дарын алдын ала сынамай бөліп алуға болады.
Төртінші, бесінші, алтыншы топ катиондары қоспаларының ерітіндісіне реакция сілтілік орта көрсеткенге дейін (рН=9-10) натрий гидроксидінің ерітіндісін тамшылатып қосады, содан соң сутегінің асқын тотығының 5-6 тамшысын тамызады. Осы қоспаның рН=10-12 болғанға дейін натрий гид-роксидінің ерітіндісін қосу керек. 2-3 минут су моншасында қыздырып, центрифугаттап сүзеді. Бұл кезде тұнбаның (1) құрамында бесінші және алтыншы топ катиондары гидроксид түрінде болады, ал төртінші топ катиондары ерітіндіге өтеді (центрифугат немесе фильтрат I).
4. IV топ катиондарын бөліп алғаннан соң, V және VI топ катиондарының тұнбаларын (I) азот қышқылын қосып ерітеді, содан соң қыздырып, 25% аммиак ерітіндісін көп мөлшерде құйып және аммоний нитратының бірнеше кристалын салып, шыны таяқшамен араластырып, қайтадан су моншасында қыздырып, центрифугаттап сүзеді. Тұнба (II) құрамында бесінші топ катион-дары гидроксид түрінде болады. Бұл тұнбаны жетінші кестедегідей анық-тайды.
Төртінші топ катиондары центрифугат құрамында болғандықтан оны тұз қышқылымен (рН=3-4) бейтараптап және бесінші кестеде көрсетілген жол-мен анықтайды.
Алтыншы топ катиондары бар (II) центрифугат аммиакат түрінде және магний катионымен бірге болады, осыны екі бөлікке бөледі. Біреуінен жеке байқау арқылы Mg2+ катионын анықтаңыздар. Қалған ерітіндіні рН=3-4 дейін бейтараптап, содан кейін тоғызыншы кестеде көрсетілгендей анықтайды.
Сонымен қатар мына төмендегідей әдістер арқылы бөлшектік анализ түрінде анықтауға болады.
Зерттелетін ерітіндіні жақсылап араластырып екіге бөледі. Бірінші бөлігі-нен IV-VI аналитикалық топ катиондарын анықтайды, ал екінші бөлігін ана-лизді қайталау қажет болған жағдайға қалдырады.
I. Алғашқы байқау
1. Ерітінді түсі;
2. Тұнбаның бар-жоғы және оның түсі;
3. Ортаның рН (универсал индикаторымен анықталады).
II. Бөлшектік анализ
Ерітінді түсіне көңіл аудару қажет. Егер, ерітінді түссіз болса, онда зерт-телетін ерітіндіде түсті иондардың Cu2+, Cr3+, Со2+, Ni2+ болмағаны, бірақ сұйылтылған ерітінділерде түсі байқалмайтын иондар Fе3+, Мn2+ немесе түссіз иондар Hg2+, Cd2+ болуы мүмкін.
Егер, зерттелетін ерітіндінің түсі ақшыл-сары болса − Fе3+; ақшыл-жасыл болса − Fе2+, Ni2+; ақшыл-күлгін болса − Мn2+; көк болса − Сu2+; күлгін түсті болса − Со2+ иондары болуы мүмкін.
Егер, рН > 1 болса, онда зерттелетін ерітіндіде сурьма және висмут катион-дары жоқ деуге болады.
Fе2+ катионын aнықтаy
Зерттелетін ерітіндінің 2-3 тамшысына сондай көлемде 2н HCl және 1 там-шы K3[Fe(CN)6] ерітіндісін қосқанда көк түсті "турнбул көгі" тұнбасының түзілуі ерітіндіде Fе2+ ионының бар екенін көрсетеді.
Fе3+ катионын aнықтаy
Зерттелетін ерітіндінің 2-3 тамшысына сондай көлемде 2н НСl және 1-2 тамшы K4[Fe(CN)6] ерітіндісін қосқанда көк түсті "берлин көгі" тұнбасының түзілуі ерітіндіде Fе3+ катионының бар екенін көрсетеді. Немесе калий роданидімен KSCN анықтауға болады.
ІІІ. Жүйелі анализ
1. IV аналитикалық топ катиондарын топ реагенті көмегімен бөлу.
IV-VI аналитикалық топ катиондары қоспасынаН2О2 қатысында NaOH топ реагентін қосып кыздырғанда V, VI аналитикалық топ катиондарының тұн-басы және IV аналитикалық топ катиондарының ерітіндісі түзіледі.
Тұнбада:
V топ гидроксидтері: Fе(ОН)3, Mg(OH)2, SbO(OH)3, MnO(OH)2, Ві(ОН)3.
VI топ гидроксидтері: Cu(OH)2, Со(ОН)3) Ni(OH)2, HgO, Cd(OH)2.
Ерітіндіде: IV топ иондары: 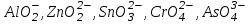 . .
V, VI аналитикалық топ катиондары тұнбаларын центрифуга көмегімен бөліп алып сақтап қояды да, ерітіндісінен 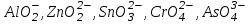 иондарды анықтайды. Ол үшін IV аналитикалық топ катиондарының амфотерлік қасиетін пайдаланып, тұз қышқылымен аниондарды катиондарға ауысты-рады ( иондарды анықтайды. Ол үшін IV аналитикалық топ катиондарының амфотерлік қасиетін пайдаланып, тұз қышқылымен аниондарды катиондарға ауысты-рады (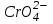 анионы қышқылдық ортада анионы қышқылдық ортада 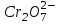 анионына ауысады, анионына ауысады, 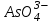 өзгерісіз қалады). өзгерісіз қалады).
Қалайы және алюминий иондарын тұнбаға түсіру.
Қалайы және алюминий катиондарының гидролиздену қасиетін пайда-ланып, оларды басқа катиондардан бөледі.
Зерттелетін ерітіндінің бір бөлігіне (IV аналитикалық топ катиондары) араластыра отырып, аммиак иісі білінгенше немесе дымқылданған лакмус қағазы көгергенше NH4OH ерітіндісін тамшылатып қосады, қыздырады. Алюминий және қалайы катиондары болса Al(OH)3, Sn(OH)4 гидроксидте-рінің тұнбасы түзіледі.
Центрифугамен тұнбаны ерітіндіден бөліп алады (ерітіндіде [Zn(NH3)4]2+, 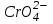 , , 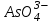 ) Тұнбаны сумен жуып, содан кейін 2н HC1 ерітіндісінде ерітеді, ерітіндіден алдымен А13+ содан соң Sn4+ катиондарын анықтайды. ) Тұнбаны сумен жуып, содан кейін 2н HC1 ерітіндісінде ерітеді, ерітіндіден алдымен А13+ содан соң Sn4+ катиондарын анықтайды.
А13+катионын aнықтаy. Al3+ ализаринмен анықтайды.
Sn4+ катионын aнықтаy. Sn4+ катионын Sn2+ катионына ауыстыру үшін ерітіндіге темір ұнтағын салып 5 минут қайнатады. Қоспаны салқындатып, центрифугамен ерітіндіні бөліп алып, оған тамшылатып NaOН ерітіндісін рН > 10 болғанша қосады. Түзілген тұнбадан ерітіндіні центрифугамен бөліп алып, одан Sn2+ ионын Hg (II) немесе Ві (ІІІ) тұздарымен анықтайды.
Ерітіндідегі 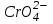 , , 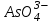 , [Zn(NH3)4]2+иондарына қышқыл қосу арқылы комплексті бұзады, ерітіндіде Zn2+, , [Zn(NH3)4]2+иондарына қышқыл қосу арқылы комплексті бұзады, ерітіндіде Zn2+, 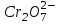 , , 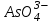 иондары болады. Zn2+, иондары болады. Zn2+, 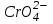 , , 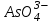 иондарын үшін, қоспаға қаныққан Na2CО3 ерітіндісін (сілтілік орта болғанша) қосады, ақ түсті (ZnOH)2CO3 тұнбасы түзілсе Zn2+ катионы болуы мүмкін. иондарын үшін, қоспаға қаныққан Na2CО3 ерітіндісін (сілтілік орта болғанша) қосады, ақ түсті (ZnOH)2CO3 тұнбасы түзілсе Zn2+ катионы болуы мүмкін.
Zn2+катионынaнықтаy. (ZnOH)2CО3тұнбасын тұз қышқылы ерітіндісінде ерітеді. Zn2+ ионын дитизон немесе K4[Fe(CN)6] көмегімен анықтайды.
As (V) катионынaнықтаy. Ерітіндіден As (V) магнезиалды қоспамен немесе молибден сұйығымен анықтайды.
Сr3+катионынaнықтаy. Центрифугат ерітіндісінің сарғыш түсі 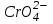 ионының бар екендігін көрсетеді. Сr3+ катионының барын Н2СrО6қышқылына ауыстыру арқылы да білуге болады. ионының бар екендігін көрсетеді. Сr3+ катионының барын Н2СrО6қышқылына ауыстыру арқылы да білуге болады.
V, VI аналитикалық топ катиондары гидроксидтерінің анализі.
Жұмыстың басында сақтап қойған V, VI аналитикалық топ катиондары тұнбасын H2О2 қатысында HNО3 қышқылымен өңдейді де, қыздырады.
Тұнба ериді (Mn4+ → Mn2+, Co3+ → Со2+ өтеді), ерітінді көлемін екі есе су қосып көбейтеді, гидролиз нәтижесінде SbO(OH)3 тұнбаға түседі, ерітіндіде V, VI аналитикалық топ катиондары болады: V топ катиондары − Fe3+, Mg2+, Mn2+, Bi3+және VI топ катиондары − Cu2+, Cd2+, Со2+, Ni2+, Hg2+ түзіледі. Тұнбадан Sb+5 катионын анықтайды.
Sb5+катионынaнықтаy.
SbO(OH)3 тұнбасын HC1 ерітіндісінде ерітіп, оған темір үгіндісін қосып қыздырады (Sb+5 → Sb°) немесе қалайы фольгасында қара түсті металдық сурьмаға дейін тотыксыздандырады.
Тұнбадан центрифугамен бөліп алынған V, VI аналитикалық топ катион-дары бар (Sb+5 басқа) ерітіндіге рН = 8-9 болғанша концентрлі NH4OHерітін-дісін қосады. Ерітіндіде VI аналитикалық топ катиондарының аммиакаттары − [Cu(NH3)4]2+, [Cd(NH3)4]2+, [Hg(NH3)4]2+, [Co(NH3)6]2+, [Ni(NH3)6]2+ болады. Ал тұнбада V аналитикалық топ катиондарының гидроксидтері − Fe(OH)3, Mg(OH)2, Mn(OH)2, Bi(OH)3 түзіледі. Тұнбаны центрифугамен бөліп алып, анализдейді.
Тұнбаның анализі.
Mg2+ катионынaнықтаy.
Тұнбаны бірнеше рет сумен жуады, оған 1 мл концентрлі NH4OHжәне NH4Clерітіндісін қосады. Магний ионы толық ерітіндіге өткенше тұнбаны осылай бірнеше рет өңдейді де, ерітіндіні тұнбадан бөліп алады. Ерітіндіге өткен магний катионын Na2HPО4 арқылы анықтайды. Mg2+ ионынан бөліп алыған тұнбаға сұйытылған HNO3 ерітіндісін қосып, Fе(IIІ), Ві(ІІІ) гидроксид-терін ерітеді, ерітіндіден Fе3+, Ві3+ иондарын анықтайды.
Fе3+катионынaнықтаy.
Үш сынауыққа ерітіндіден 2-3 тамшы алып, біріншісіне KSCN, екіншісіне CH3COONa, үшіншісіне K4[Fe(CN)6] қосады, байқалған өзгерістер бойынша Fe3+ катионының бар немесе жоқ екеніне қорытынды жасайды.
Ві3+ катионынaнықтаy.
2-3 тамшы ерітіндіге калий станиті ерітіндісін қосады, нәтижесінде Ві(ІІІ) бар болса металдық висмуттың қара тұнбасы түзіледі.
Мn2+ катионынaнықтаy.
Mapганец (IV) гидроксиді тұнбасын концентрлі HNО3 ерітіндісін қосып ерітеді және Н2О2 ерітіндісін қосып, қайнатып Мn(ІІ) қосылысына ауысты-рып Мn2+ ионына тән сапалық реакциялары арқылы анықтайды.
VI аналитикалық топ катиондарының комплексті косылыстары ерітіндісінің анализі.
ЕрітіндідеVI аналитикалық топ катиондарының комплексті қосылыстары болады: [Cu(NH3)4]2+, [Cd(NH3)4]2+, [Hg(NH3)4]2+, [Co(NH3)6]2+, [Ni(NH3)6]2+.
Комплекстерді бұзу үшін күкірт қышқылы ерітіндісін қосады, содан соң қара-қоңыр тұнба түзілгенше Na2S2О3 ерітіндісін қосады. Тұнбада мыс және сынап сульфидтері, ал ерітіндіде кобальт, никель және кадмий иондары болады.
CuS (Cu2S+S) тұнбасын азот қышқылында ерітеді, ерітіндіде Cu2+ иондары болады, ал тұнбада HgS қалады.
Cu2+катионын aнықтаy.
Ол үшін ерітіндінің 2-3 тамшысына K4[Fe(CN)6] қосады, Cu2+ ионы болса қызыл-қоңыр түсті Cu2[Fe(CN)6]↓ тұнбасы түзіледі. Немесе басқа сынауыққа 2-3 тамшы зерттелетін ерітіндіні алып оған NH4OH ерітіндісін қосады, сонда көк түсті [Cu(NH3)4]2+ ерітіндісі пайда болады.
Hg2+катионынaнықтаy.
Тұнбаға концентрлі азот қышқылын (HNО3конц.) және сутегі асқын тотығын (H2О2) қосып HgS→Hg2+ ионына айналдырады да, оны мыс пластинкасында бос сынапқа дейін тотықсыздандырып, сынап жылтырының түзілгенінен байқайды
Ni2+катионын aнықтаy.
Ерітіндінің бір бөлігіне диметилглиоксим ерітіндісін қосқанда ашық-қызыл тұнбаның түзілуі ерітіндіде Ni2+ катионының барын көрсетеді.
Cd2+катионынaнықтаy.
2-3 тамшы ерітіндіге сондай көлемде K[BiJ4] немесе KJ + Bi(NО3)2 ерітіндісін қосқанда BiJ3↓ қара тұнбасы түзіледі.
Со2+ катионынaнықтаy.
Ерітіндіге KSCN ерітіндісін қосқанда кобальт(ІІ) бар болса көк түсті калийдің тетрароданокобальтатының (ІІ) K2[Co(SCN)4]↓ тұнбасы түзіледі.
18- кесте. IV, V, VI топ катиондары қоспасының анализ жолы
1. Fe2+, Fe3+, Sb3+ катиондарын жеке байқаулар арқылы анықтауға болады.
|
2. Барлық катиондар қоспасына рН=10-12 болғанға дейін NaOH натрий гидроксидін қосады, Н2О2 ерітіндісін қосып, центрифугаттайды.
|
Тұнба. V және VI топ катиондарының гидроксидтерінің тұнбасын (I) HNО3-пен ерітіп, қыздырады, содан соң NH4OH және NH4 Cl қосып араластырып, қыздырып, центрифугаттайды.
|
Ерітінді. СrО42-, AsO43-, ZnO22-, АIO2-, SnO32- тұз қышқылымен бейтараптап (рН=5-6), 14 кестедегідей анықтайды.
|
Тұнба. бесінші топ ка-тиондары гидроксидтер түрінде болады. Оны бесінші топ катиондарын анықтайтын әдіс-пен анализдейді (16-кестедегідей).
|
Ерітінді. VI топ катиондары аммиакат түрінде және Mg2+ болады.
Mg2+ катионын жеке байқау арқылы анық-тайды. Басқa ерітіндіні рН=3-4 дейін НСl-мен бейтараптап, алтыншы топ катиондарын анықтайды (18 кестедегідей).
|
Анализ смеси катионов IV, V, VI аналитических групп  5488 5488
БОЛЬШЕ ПО ТЕМЕ:
Лабораторные работы.
Аналитические реакции катионов никеля Ni (П).
Аналитические реакции борат-ионов.
Аналитические реакции карбонат-ионов.
Аналитические реакции фосфат-ионов.
Лабораторные работы.
Аналитические реакции анионов третьей группы
Анализ смеси анионов 1-ой, 2-ой и 3-ей групп дробным методом.
Анализ сухой соли. Качественное определение катионов и анионов (занятие 1)
Анализ сухой соли. Качественное определение катионов и анионов (занятие 2).
Стандартизация раствора NaOH пo HC1 (титрование с метиловым оранжевым).
Выполнение определений
В зависимости от того, что представляет собой анализируемый объект – водный раствор без осадка или водный раствор с осадком – выбирают ту или иную схему систематического хода анализа.
А. Анализ раствора без осадка. Если анализируемый объект представляет собой водный раствор без осадка, то применяемая схема заключается в следующем (в конкретных случаях отдельные детали могут быть различными).
Анализированный раствор может быть окрашенным или бесцветным. По окраске раствора высказывают предположения о присутствии или отсутствии катионов, имеющих характерную окраску. Если, например, раствор прозрачный и бесцветный, то можно предположить, что он не содержит катионы Cr 3+, Fe 3+, Cu 2+, Сo 2+, Ni 2+.
Некоторые предварительные указания можно получить и на основании измерения значения рН раствора (например, с помощью универсальной индикаторной бумаги, которая при разных значениях рН водного раствора окрашивается в различные цвета). Если значение рН раствора находится в пределах рН = 2 - 4 (и раствор не содержит осадка), то в нем отсутствуют олово (II), олово (IV), сурьма (Ш), сурьма (V), висмут (Ш), ртуть (II), железо (Ш), так как в противном случае их продукты гидролиза выделялись бы в форме осадков при указанных значениях рН раствора.
Анализируемый раствор обычно делят на три части. Одну часть используют для предварительных испытаний, другую – для проведения систематического анализа, третью – оставляют для контроля.
а) предварительные испытания. В отдельных не больших порциях анализируемого раствора (объемом примерно по 0,3-0,5 мл) определяют наличие катионов IV-VI аналитических групп действием групповых реагентов. Обычно открывают также и некоторые индивидуальные катионы – железа Fe2+ и Fe3+, хрома (Ш) Cr 3+, меди Cu 2+.
Определив наличие катионов различных групп, преступают к разделению их с помощью групповых реагентов.
б) предварительное открытие некоторых катионов четвертой, пятой и шестой аналитических групп. Перед продолжением проведения дальнейшего систематического анализа можно предварительно открыть (хотя это делается не всегда) некоторые катионы в отдельных небольших порциях этого или исходного раствора, например, катионы железа (II) Fe2+, железа (Ш) Fe3+, хрома (Ш) Cr3+, меди (II) Cu2+, мышьяка (V), сурьмы, марганца (II) Mn2+, кобальта (II) Co2+, никеля (II) Ni2+, ртути (II) Hg 2+, висмута (Ш).
Открытие катионов железа. Катионы железа (II) Fe2+ открывают реакцией с гексацианоферратом (Ш) калия К3[Fe(CN)6] в кислой среде (рН = 2 – 3). В присутствии катионов железа Fe2+ образуется темно-синий осадок турнбулевой сини. Если цвет осадка иной, то это свидетельствует об отсутствии катионов железа (II).
Катионы железа (Ш) открывают реакцией с гексацианоферратом (II) калия К4[Fe(CN)6] (также в кислой среде, рН = 3). При наличии в растворе катионов Fe3+ образуется темно-синий осадок берлинской лазури.
Открытие катионов хрома (III) Cr3+. Катионы хрома (Ш) предварительно открывают, окисляя их пероксидом водорода до хромат-ионов в присутствии щелочи.
Открытие катионов меди (II) Cu2+. Катионы меди (II) предварительно открывают в отдельной порции раствора реакцией с концентрированным раствором аммиака, при которой образуется аммиачный комплекс меди (II) [Cu(NH3)4]2+ интенсивно синего цвета.
Если окраска раствора недостаточно характерна, то медь (II) вначале переводят в оксид меди, который затем растворяют в азотной кислоте. Для этого к небольшому количеству анализируемого раствора прибавляют раствор гидроксида натрия (2 моль/л). Выпадает осадок. Смесь нагревают несколько минут на водяной бане; при этом осадок небольшим количеством раствора хлорида аммония (2 моль/л), перемешивают и цинтрифугируют. Осадок отделяют от центрифугата и прибавляют к нему (по каплям) небольшое количество 2 моль/л раствора азотной кислоты до растворения осадка. Оксид меди растворяется и катионы Cu2+ переходят в раствор. Полученный раствор обрабатывают водным 25 %-м раствором аммиака. Образуется аммиачный комплекс меди – раствор принимает интенсивно синюю окраску.
Открытие мышьяка. Мышьяк (V) можно предварительно открыть реакцией с молибденом аммония в присутствии азотной кислоты.
При наличии арсенат-ионов AsO43- образуется желтый кристаллический осадок аммойной соли мышьяковомолибденовой гетерополикислоты:
(NH4)3[AsO4(MoO3)12].
Открытие сурьмы. Сурьму открывают в отдельной порции раствора в том случае, если исходный раствор без осадка имеет значение рН < 1.
К небольшому количеству (несколько капель) раствора прибавляют несколько капель водного раствора 2 моль/л азотной кислоты HNO3, столько же – 3 %-го раствора пероксида водорода. Смесь нагревают на водяной бане. В этих условиях вся сурьма в растворе оказывается в состоянии высшей степени окисления – сурьма (V) – и выделяется из раствора в форме белого осадка сурьмяной кислоты H3SbO4 (формулу которой можно представить также в виде SbO(OH)3 или HSbO3).
Смесь охлаждают и центрифугируют. Осадок отделяют от центрифугата и растворяют в концентрированной хлороводородной кислоте. При этом образуется растворимый хлоридный комплекс сурьмы (V) состава [SbCl6]-. Раствор разбавляют (примерно в 2 раза) дистиллированной водой и подтверждают присутствие в нем сурьмы реакцией с сероводородной водной или сульфидом аммония (выделяется оранжевый осадок сульфида сурьмы Sb2S5), а также реакцией с органическими реагентами – метиловым фиолетовым или с родамином 6Ж. при реакциях комплексов [SbCl6]- с указанными органическими реагентами образуются окрашенные ионные ассоциаты состава R+[SbCl6]-, где R+ - органический катион метилового фиоле-тового или родамина 6Ж, которые экстрагируются из водной фазы бензолом. Экстракт окрашивается в фиолетовый (в случае метилового фиолетового) или розовый (в случае родамина 6Ж) цвет.
Открытие катионов марганца (II). Эти катионы открывают в отдельной порции раствора реакцией окисления Mn2+ до перманганат-ионов MnO4- висмутом натрия NaBiO3 в азотнокислой среде – наблюдается окрашивание раствора в малиново – фиолетовый цвет.
Открытие катионов кобальта (II). Если в растворе присутствуют катионы железа (Ш) и меди (II), то катион кобальта Co2+ открывают капельной реакцией на полоске фильтровальной бумаги с 1-нитрозо-2-нафтолом (реактив Ильинского) в уксуснокислой среде – наблюдается возник-новение окрашенной коричневой зоны вследствие образования комплекса кобальта (пурпурно-красного цвета в чистом виде) с органическим реагентом. Большие количества катионов меди (II) мешают определению.
При отсутствии в растворе катионов Fe3+ и Cu2+ кобальт (II) открывают реакцией с тиоционатами аммония NH4NCS или калия KNCS в присутствии изоамилового спирта (экстрагент) – наблюдается окрашивание органического слоя в ярко-синий цвет вследствии образования синего тиоционатного комплекса [Co(NCS)4]2-, экстрагирующего в органическую фазу.
Мешающее действие железа (Ш) и меди (II) можно устанвить путем их восстановления до железа (II) и меди (I) хлоридом олова (II). Железо (Ш) также маскируют (устраняют его мешающее действие) добавлением фторида натрия NaF – образуется устойчивый бесцветный фторидный комплекс железа (Ш) состава [FeF6]3-, не мешающий, как и железо (II), определению кобальта (II).
Открытие катионов никеля (II). Если в растворе отсутствуют катионы железа (II), то никель (II) открывают капельной реакцей с диметилглиоксимом (реактив Чугаева) в аммиачной среде на полоске фильтровальной бумаги – возникает окрашеная розовая зона вследствие образования комплекса никеля с диметилглиоксимом красного цвета.
Катионы железа (II), меди (II) и других металлов, образующих окрашенные аммиачные комплексы, мешают определению.
Открытие катионов ртути (II). Катионы Hg2+ открывают реакцией с хлоридом олова (II) (точнее – с хлоридными комплексами [SnCl4]2-) – наблюдается выпадение белого осадка каломели Hg2Cl2, который темнеет вследствие выделения тонкодисперсной металлической ртути, образующейся при восстановлении Hg2Cl2 оловом (II).
Открытие катионов висмута (III): если в растворе отсутствуют катионы сурьмы и ртути (II), то висмут (III) открывают реакцией восстановления
висмута (III) до металлического висмута оловом (II) (точнее - комплексами [Sn(OH)4]-), наблюдается образование черного осадка, содержащего металлический висмут.
в) отделение катионов четвертой аналитической группы от катионов пятой и шестой аналитических групп.После предварительного открытия ряда катионов в отдельных порциях раствора (как описано выше) четвертой, пятой и шестой аналитических групп, отделяют сурьму. Для этого к раствору прибавляют небольшие количества водного 2 моль/л раствора азотной кислоты и водного 3%-го раствора пероксида водорода, смесь нагревают несколько минут на кипящей водяной бане. В этих условиях вся сурьма переходит в сурьмяную кислоту HSbO3. Bыпавший белый осадок сурьмяной кислоты отделяют центрифугированием, а раствор, уже не содержащий сурьмы, подвергают действию щелочи для отделения катионов четвертой аналитической группы.
К центрифугату медленно прибавляют водный 2 моль/л раствор гидроксида натрия до нейтральной реакции среды и затем – дополнительно избыток раствора гидроксида натрия и небольшое количество пероксида водорода. Нагревают смесь на кипящей водяной бане. В этих условиях катионы четвертой аналитической группы, образовавшие соответствующие растворимые гидроксокомплексы, остаются в растворе, а катионы пятой и шестой аналитических групп переходят в осадок (смесь гидроксидов и основных солей).
В случае присутствия в растворе катионов хрома (III) смесь продолжают нагревать до изменения цвета раствора из зеленого (цвет катионов Cr3+) до желтого (цвет хромат-ионов CrO42-). При этом весь хром (III) окисляется до хрома (VI). После нагревания (непрореагировавший пероксид водорода удаляется) смесь центрифугируют, осадок отделяют от центрифугата.
Осадок содержит катионы пятой и шестой аналитических групп, а щелочной центрифугат – катионы первой и четвертой аналитических групп.
В части центрифугата открывают катионы четвертой аналитической группы.
г) разделение и открытие катионов пятой и шестой аналитических групп. Полученный свежевыпавший осадок гидроксидов, гидротированных оксидов и основных солей катионов пятой и шестой аналитических групп обрабатывают при нагревании раствором азотной кислоты (1:1) в присутствии пероксида водорода.
В раствор переходят все катионы обеих групп, за исключением сурьмы, которая остается в осадке в форме метасурьмяной кислоты HSbO3. этот осадок отделяют центрифугированием, растворяют в небольшом количестве концентрированной хлороводородной кислоты и в растворе открывают сурьму реакцией с родомином Б.
Азотнокислый раствор после отделения сурьмы нейтрализуют 1 моль/л раствором соды Na2CO3 до начала помутнения, прибавляют двух-трехкратный объем концентрированного раствора аммиака и нагревают до 40-50 0С. При этом катионы шестой аналитической группы переходят в раствор в виде комплексных аммиакатов состава [Co(NH3)6]2+ , [Ni(NH3)6]2+ , [Cu(NH3)4]2+ , [Cd(NH3)4]2+ и [Hg(NH3)4]2+. В осадке остаются гидроксиды катионов пятой группы.
Смесь центрифугируют. Центрифугат, содержащий катионы шестой аналитической группы, отделяют от осадка, содержащего катионы пятой аналитической группы. Центрифугат и осадок анализируют раздельно.
Осадок промывают 2 моль/л раствором аммиака, водой, растворяют в 2 моль/л растворе азотной кислоты и в полученном растворе открывают катионы пятой аналитической группы.
Аммиачный центрифугат, содержащий катионы шестой аналитической группы, нейтрализуют 1 моль/л раствором серной кислоты до слабо кислой реакции и в полученном растворе открывают катионы шестой аналитической группы.
Б. Анализ раствора с осадком. Если анализируемый объект представляет собой раствор с осадком, то вначале эту смесь центрифугируют, отделяют осадок от раствора и обе фазы анализируют раздельно.
Наличие осадка свидетельствует о возможности присутствия в нем продуктов гидролиза соединений олова, сурьмы, висмута, арсенатов и арсенитов.
Осадок испытывают на растворимость в разбавленных растворах уксусной, хлороводородной, азотной кислотах. Если он полностью растворяется в какой-то из этих кислот, то раствор, полученный после растворения осадка, либо присоединяют к центрифугату и анализируют далее вместе, либо анализируют отдельно на присутствие тех или иных катионов.
Если осадок не растворяется в указанных разбавленных кислотах, то испытывают его растворимость в других растворителях – в более концентрированной (1:1) азотной кислоте, в водном растворе винной кислоты.
В азотной кислоте растворяются осадки оксохлорида висмута BiOCl, в водном растворе винной кислоты – оксохлориды сурьмы SbOCl и SbO2Cl, в водном растворе ацетата аммония – осадок сульфата свинца. В пробах полученных растворов открывают соответствующие катионы характерными реакциями на эти катионы.
Систематический анализ осадка. Обрабатывают осадок горячей азотной кислотой и центрифугируют полученную смесь. В центрифугат переходят мышьяк (III), мышьяк (V), висмут (III), которые открывают в отдельных пробах центрифугата характерными реакциями.
Отделенный от раствора осадок может содержать смесь оксохлоридов SbOCl, SbO2Cl. Осадок промывают дистиллированной водой и прибавляют к нему раствор винной кислоты при нагревании. В раствор переходит сурьма, которую открывают в пробах раствора реакциями на сурьму.
4. Тест-контроль 2 по темам: «Аналитические реакции катионов четвертой, пятой, шестой групп». Примерный вариант.
1. Рассчитайте рН буферного раствора, 1 л которого содержит 0,1 моль уксусной кислоты и 0,01 моль ацетата натрия. Константа диссоциации уксусной кислоты Ка = 1,74.10 -5, рКа = 4,76 .
2. Желтый раствор с NаОН и Н2О2 образует катион четвертой группы:
a) Sn2+ б) Zn2+ в) Cr3+ г) Al3+
Напишите соответствующее уравнение реакции.
3. Растворы синего, желтого и сине-фиолетового цвета в избытке NН3 соответственно образуют катионы шестой группы:
а) Cu2+; Со2+; Ni2+
|
б) Со2+; Hg2+; Cd2+
|
в)Hg2+; Ni2+; Cd2+
|
г) Hg2+; Cu2+; Со2+
|
Напишите уравнения соответствующих реакций. Укажите их эффект.
4. Буферная емкость: определение, расчетные формулы, значение.
V. Литература.
1. Ю. Я. Харитонов. Аналитическая химия. Ч. 1. Высшая школа, М., 2001, гл. 6, с. 130-152, 336-343.
2. В.П. Васильев. Аналитическая химия. Книга 1. Титриметрические и гравиметрический методы анализа. Высшее образование. М., 2004 г. С. 112-117.
3. Ю. Я. Золотов. Основы аналитической химии. Практическое руководство. Высшая школа, М., 2001. C. 121-135
4. Лекции.
З А Н Я Т И Е № 6.
II. Тема: Аналитические реакции анионов первой группы.
II. Цель: 1. Научиться производить расчеты по определению ОВ потенциала редокс - пар с учетом активности ионов и ионной силы раствора, а также предсказывать возможность протекания ОВР.
2. Уметь определять анионы 1-ой группы в растворе.
III. Исходный уровень.
1. Основные положения теории ОВР.
2. Умение составлять и уравнивать ОВР методами электронного баланса и полуреакций.
3. Знание понятий и расчет активности ионов и ионной силы раствора.
IV. Содержание занятия.
1. Контроль выполнения домашнего задания.
2. Практическая часть.
Учебно - целевые вопросы.
2.1. Окислительно - восстановительная система.
2.2. Окислительно - восстановительные потенциалы редокс-пар:
а) редокс – потенциалы;
б) электродные окислительно - восстановительные потенциалы.
2.3. Потенциалы реакции (ЭДС реакции).
2.4. Направление протекания ОВР и глубина протекания ОВР.
2.5. Влияние различных факторов на глубину протекания ОВР.
2.6. Значение ОВР в химическом анализе.
2.7. Аналитическая классификация анионов по группам.
2.8. Аналитические реакции анионов 1 группы.
Задачи.
2.9. Рассчитайте реальный ОВ потенциал системы полученной при смешивании 80 мл раствора, содержащего церий (IV) при концентрации
С'(Се+4) =0,15 моль/л с 20 мл раствора, содержащего Се (III) при концентрации С(Се+3) = 0,05 моль/л. Коэффициенты активности ионов Се 4+ и Се 3+ считать равными 1. Стандартный ОВ потенциал редокс – пары Се 4+/Се 3+ равен
Е° = 1,77 В при t = 25°.
2.10. Рассчитайте чему равно отношение активностей окисленной и восстановленной форм редокс - пары Fe 3+/Fe 2+ в водном растворе, если известно, что для этой редокс - пары реальный и стандартный ОВ потенциалы равны соответственно Е = 0,71 В, Е° = 0,77 В при t = 25° С.
2.11. Покажите, можно ли в стандартных состояниях веществ окислить Сl- перманганат - ионами МnО4- в кислой среде при 25° С. Стандартные ОВ потенциалы редокс - пар С12/Сl- и МnО4-, Н+/Мn2+ равны соответственно 1,36 и 1,51В.
2.12. Рассчитайте константу равновесия К реакции  Sn2++2Cе3+→Sn6++Cе3- протекающей в водном растворе при комнатной температуре. Стандартные ОВ потенциалы редокс - пар Се4+/Се3+ и Sn4+/Sn2+ при комнатной температуре соответственно равны 1,77 и 0,15 В. Sn2++2Cе3+→Sn6++Cе3- протекающей в водном растворе при комнатной температуре. Стандартные ОВ потенциалы редокс - пар Се4+/Се3+ и Sn4+/Sn2+ при комнатной температуре соответственно равны 1,77 и 0,15 В.
https://studepedia.org/index.php?vol=1&post=57430 |
|
|
 Скачать 64.69 Kb.
Скачать 64.69 Kb.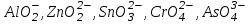 .
.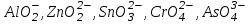 иондарды анықтайды. Ол үшін IV аналитикалық топ катиондарының амфотерлік қасиетін пайдаланып, тұз қышқылымен аниондарды катиондарға ауысты-рады (
иондарды анықтайды. Ол үшін IV аналитикалық топ катиондарының амфотерлік қасиетін пайдаланып, тұз қышқылымен аниондарды катиондарға ауысты-рады (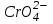 анионы қышқылдық ортада
анионы қышқылдық ортада 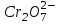 анионына ауысады,
анионына ауысады, 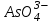 өзгерісіз қалады).
өзгерісіз қалады).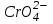 ,
, 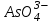 ) Тұнбаны сумен жуып, содан кейін 2н HC1 ерітіндісінде ерітеді, ерітіндіден алдымен А13+ содан соң Sn4+ катиондарын анықтайды.
) Тұнбаны сумен жуып, содан кейін 2н HC1 ерітіндісінде ерітеді, ерітіндіден алдымен А13+ содан соң Sn4+ катиондарын анықтайды.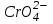 ,
, 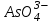 , [Zn(NH3)4]2+иондарына қышқыл қосу арқылы комплексті бұзады, ерітіндіде Zn2+,
, [Zn(NH3)4]2+иондарына қышқыл қосу арқылы комплексті бұзады, ерітіндіде Zn2+, 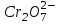 ,
, 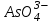 иондары болады. Zn2+,
иондары болады. Zn2+, 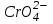 ,
, 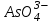 иондарын үшін, қоспаға қаныққан Na2CО3 ерітіндісін (сілтілік орта болғанша) қосады, ақ түсті (ZnOH)2CO3 тұнбасы түзілсе Zn2+ катионы болуы мүмкін.
иондарын үшін, қоспаға қаныққан Na2CО3 ерітіндісін (сілтілік орта болғанша) қосады, ақ түсті (ZnOH)2CO3 тұнбасы түзілсе Zn2+ катионы болуы мүмкін.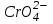 ионының бар екендігін көрсетеді. Сr3+ катионының барын Н2СrО6қышқылына ауыстыру арқылы да білуге болады.
ионының бар екендігін көрсетеді. Сr3+ катионының барын Н2СrО6қышқылына ауыстыру арқылы да білуге болады.