химия 4. Изучить понятие скорость реакции, зависимость скорости реакции от концентрации
 Скачать 191.21 Kb. Скачать 191.21 Kb.
|
Лабораторная работа 4Скорость химической реакцииЦель работы: изучить понятие «скорость реакции», зависимость скорости реакции от концентрации (закон действия масс) и температуры (правило Вант-Гоффа). Задание: провести реакцию между тиосульфатом натрия и серной кислотой и установить зависимость скорости реакции от концентрации и температуры. Выполнить требования к результатам опытов, оформить отчет, решить задачу. Теоретическое введениеСкоростью реакции называется изменение концентрации какого-либо из веществ, вступающего в реакцию или образующегося при реакции, за единицу времени. Скорость химических реакций зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов. Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. В общем случае для реакции nA + mB = pАВ где k – константа скорости реакции; 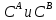 – концентрации реагирующих веществ; n и m – коэффициенты перед веществами А и В. – концентрации реагирующих веществ; n и m – коэффициенты перед веществами А и В. 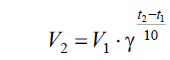 Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: в гомогенной системе при повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2−4 раза: Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: в гомогенной системе при повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2−4 раза: где V2 и V1 – скорость реакции при температурах t2 и t1; γ – температурный коэффициент скорости реакции. Выполнение работыЗависимость скорости реакции от концентрации реагирующих веществ и температуры удобно исследовать на примере взаимодействия тиосульфата натрия с серной кислотой: Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓ + H2O. Признаком окончания реакции является помутнение раствора вследствие выделения серы. Время, которое проходит от начала реакции до заметного появления мути, позволяет судить об относительной скорости реакции. Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ 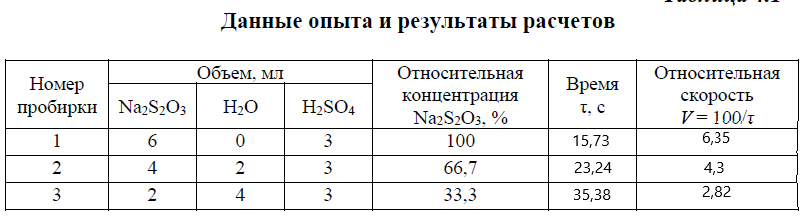  Зависимость скорости реакции и от концентрации реагирующих веществ Зависимость скорости реакции и от концентрации реагирующих веществЗависимость скорости реакции от концентрации выражается линией, которая не проходит через начало координат т.к. при нулевой концентрации реакция происходить не будет. Вывод: при увеличении концентрации реагирующих веществ увеличивается скорость реакции. 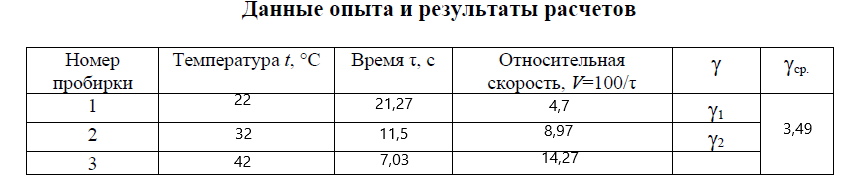 Опыт 2. Зависимость скорости реакции от температуры Опыт 2. Зависимость скорости реакции от температурыЗависимость скорости реакции от температуры  Зависимость скорости реакции от температуры выражается пароболой Вывод: при увеличении температуры увеличивается скорость реакции. |
