шпор химия. Шпаргалка по Химии_kaz. Ж. Л. Пруст 8 Орынбасу реакциясы
 Скачать 279.49 Kb. Скачать 279.49 Kb.
|
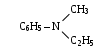 361 C3H3N формуласына сәйкес келетін изомерлер саны 4 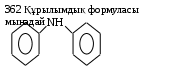 Аминнің аталуы дифениламин 363 Нитроқосылыстарға бір реагентпен әсер етіп, аминге айналдыруға болады. Бұл зат: сутек 364 Амин формуласы (C6H5)3N 365 1л метиламиннің (қ.ж) массасы (г) 1,38 366 Фениламин молекуласындағы σ мен π – байланыстарының қатынасы 14:3 367 4,5г диметиламиннің зат мөлшері (моль) 0,1 368 5,9г триметиламиннің (қ.ж) көлемі (л) 2,24 369 9 г этиламиннің молекула саны 1,2 ∙1023 370 0,5 моль анилиннің массасы (г) 46,5 371 4 моль фениламиннің көлемі (л) 89,6 372 2,4 · 1022 молекуласы бар фениламиннің массасы (г) 3,7 373 31г метиламин 18г сумен әрекеттескенде түзілген метиламмоний гидроксидінің массасы (г) 49 374 9,3г метиламин 3,65г тұз қышқылымен әрекеттескенде түзілген метиламмоний хлоридінің массасы (г) A) 2,56 B) 3,62 C) 4,83 D) 5,48 E) 6,75 {Правильный ответ}= {Сложность}=B {Учебник}= химия,11,Н.Нурахметов и др.,2007ж. {Класс}=11 {Четверть}=4 $$$031 375 5г метанды хлорлаған кезде (бірінші саты) түзілген хлорсутекті 13,95г анилинмен әрекеттестіргенде алынған фениламмоний хлоридінің массасы (г) 19,4 376 8л метиламинді жағуға жұмсалатын ауаның (қ.ж) көлемі (ауадағы оттегінің үлесі 21 %) 85,7 л 377 Негіздік қасиеттің өсуіне қарай орналасқан қатар фениламин– диметиламин – триметиламин 378 Аммиакпен салыстырғанда ең күшті негіздік қасиет көрсететін амин метилэтиламин 379 Метиламиннің жану реакциясы теңдеуіндегі бастапқы заттардың формулалары алдындағы коэффициенттердің қосындысы 13 380 Этиламиннің жану реакциясы теңдеуіндегі барлық заттардың формулалары алдындағы коэффициенттердің қосындысы 43 381 Этиламиннің молекуласындағы σ – байланыстарыныыыың саны 9 382 2 моль метиламин жанғанда түзілген азоттың зат мөлшері (моль) 1 383 4 моль этиламин жанғанда түзілген көміртегі (IV) оксидінің массасы (г) 352 384 46,5г анилин 240г броммен әрекеттескенде түзілген 2,4,6-триброманилиннің зат мөлшері (моль) 0,5 385 Нәтижесінде 6,6 г 2,4,6 – триброманилин түзілген болса, броммен әрекеттескен анилиннің массасы (г) 1,86 386 Құрамында 5% қоспасы бар 40г метиламин жанғанда түзілген азоттың массасы (г) 17,16 387 Нәтижесенде 37,2г анилин түзілген болса, Зинин реакциясы бойынша реакцияға кіріскен нитробензолдың массасы (г) 49,2 388 Сутек бойынша тығыздығы 22,5-ке тең және құрамында көміртегі 53,5%, азот 31,2%, сутегі 15,5% болатын аминнің молекулалық формуласы C2H5NH2 389 Анилинді аңықтауда қолданылатын реактив бромды су 390 Триброманилиннің түсі ақ 391 Фениламмоний хлоридінің формуласы  392 Анилин осы затпен әрекеттескенде негіздік қасиет көрсетеді. хлорсутек 393 Нәтижесінде 2 – аминпропан түзілетін болса, тотықсызданатын нитроқосылыстың формуласы CH3 – CH – CH3 │ NO2 394 Аминвалериан қышқылының формуласы H2N – (CH2)4 – COOH 395 Төмендегі келтірілген формулалардағы аминқышқылдар саны     2 396Аминкапрон қышқылының амин тобының орны бойынша изомерлерінің саны 5 397 Аминмай қышқылының изомерлерінің саны 5 398 β – аминкапрон қышқылының формуласы  399 Аминқышқылдары спирттермен әрекеттескенде түзілетін заттар күрделі эфирлер 400 Этерификация реакциясына түсетін зат глицин 401 Амфотерлі қасиет көрсететін зат аминсірке қышқылы 402 Аммиакпен әрекеттескенде аминқышқылын түзеді. 2–хлорпропион қышқылы 403 150г 30%-тті аминсірке қышқылының ерітіндісі 30г натрий гидроксиді бар ерітіндімен әрекеттескенде түзілген тұздың массасы (г) 58,2 404 Құрамында 32%-көміртегі, 6,66% сутегі, 42,67% оттегі және 18,67% азоты бар аминқышқылының молекулалық формуласы C2H5O2N 405 44,5г α – аминпропион қышқылы натрий гидроксидімен әрекеттескенде 50г тұз түзілген болса, өнімнің шығымы (%) 90% 406 10,3 г аминмайқышқылы 5,6г калий гидроксидімен әрекеттескенде түзілген тұздың массасы (г) 14,1 407 8,9г β – аминпропион қышқылы 3,2г метанолмен әрекеттескенде түзілген күрделі эфирдің зат мөлшері (моль) 0,1 408 15г аминсірке қышқылы 7,3 тұз қышқылымен әрекеттескенде түзілген тұздың массасы (г) 22,3 409 7,5г аминсірке қышқылы натрий металымен әрекеттескенде түзілген сутегінің (қ.ж) көлемі (л) 1,12 410 5,2 моль аминвалериан қышқылының молекула саны A) 1,6 ∙ 1022 B) 2,5 ∙1023 C) 3,1 ∙1024 D) 4,5∙1025 E) 5,2 ∙ 1026 {Правильный ответ}= {Сложность}= В {Учебник}= химия,11,Н.Нурахметов и др.,2007 ж. {Класс}=11 {Четверть}=4 $$$018 411 ά – аминкапрон қышқылының 7,6 ∙1024 молекуласына сәйкес зат мөлшері (моль) 12,6 412 Аминмай қышқылы құрамындағы азоттың массалық үлесі (%) 13,5 413 Аминсірке қышқылы құрамындағы оттегінің массалық үлесі (%) 42,7 414 Аминмай қышқылы құрамындағы сутегінің массалық үлесі (%) 8,74 415 206 г аминмай қышқылының зат мөлшері (моль) 2 416 2 моль аминкапрон қышқылының массасы (г) 151 417 2 моль аминсірке қышқылы натриймен әрекеттескенде түзілген сутегінің зат мөлшері (моль) 1 418 Құрамында 7,7 % сутегі бар, 13г алкин (қ.ж) 11,2л көлем алады. Алкиннің молекулалық формуласы C2H2 419 Белоктың мономерлері аминқышқылдары 420 Белоктың құрамында бола алатын аминқышқылдар саны 20 421 Барлық аминқышқылдар молекуласының бірдей бөлігі аминтоп және карбоксил тобы 422 Белоктың екінші реттік құрылымындағы байланыс сутекті 423 Пептидтік байланыс  424Тетрапептид молекуласы құрамына кіретіy пептидтік байланыс саны 3 425 Нуклеин қышқылдары ДНК және РНК 426 ДНК құрамындағы моносахарид дезоксирибоза 427 РНК макромолекуласының құрамына кіртін моносахарид рибоза 428 РНК макромолекуласының құрамына кірмейтін азоттық негіз тимин 429 ДНК макромолекуласының құрамына кірмейтін азоттық негіз урацил 430 Глицин – аланин дипептидінің формуласы  431 Глицин және фенилаланинді қолдану арқылы алынған дипептид саны 2 432 Белоктың құрамына кіретін мына аминқышқылының аталуы H2N ─ CH ─COOH │ H2C ─ SH цистеин 433 Сілтілік ортада белокқа мыс тұздарымен әсер еткенде, күлгін түске ауысады. Бұл – биурет реакциясы 434 Нуклеин қышқылының құрамына ..... кіреді H3PO4 435 Белокқа концентрлі азот қышқылының әсер еткенде, оның түсі ...... ауысады сарыға 436 Белок молекуласы конфигурациясының бұзылуы денатурация 437 Тірі ағзаларда оттекті өкпеден ұлпаларға тасымалдайтын күрделі белок гемоглобин 438 Өнеркәсіпте хлорды алу реакциясының схемасы: NaCl балқымасын электролиз 439 Өзгерістер сызба-нұсқасына Сl0→Cl5+→Cl-→Cl0 сәйкес келетіні Cl2→KClO3→KCl→Cl2 440 Галогендер қатары: F,Cl,Br,IAc 441 Фтор атомы электрондарының энергетикалық денгейлерге орналасуын көрсетеді : 2е 7е 442 Реакциялардың типтері: 1)2Fe+3Cl3→2FeCl3 2) 2Аl(OH)3→Al2O3+3H2 O 1 қосылу,2 айырылу 443 Диссоциация кезінде хлорит-ион түзетін зат: KC1O2 444 Хлордың массалық үлесі ең көп заттың формуласы: Ca Cl2 445 СаF2 молекуласындағы химиялық байланыстың түрі: иондық 446 Тотықсыздану үрдісінің сызбанұсқасы BrO2-→Br- 447 Хлор барлық металдармен әрекеттесіп.... тұздар түзеді 448 234 г ас тұзына күкірт қышқылымен әсер еткенде 131,4г хлорсутек алынса, хлорсутектің шығымы: 90% 449 Галогендердің жоғарғы тотығу дәрежесі +7 450 Табиғатта кездесетін хлордың қосылысы: NaCl 451 Хлор осы затпен әрекеттесуі мүмкін H2 452 Зертханада хлорсутекті алу NaCl(қатты)+ H2SO4(конц) → 453 5,85 г натрий хлоридін концентрлі күкірт қышқылымен әрекеттестірген кезде түзілген хлорсутектің көлемі 4,48 л 454 Галогендер тобының периодтық жүйедегі орны VII, негізгі топша 455 Электрондық формуласы 1s22s22p63s23p5 сәйкес келетін элемент Cl 456 Крахмалмен көк түс беретін зат иод 457 Тұз қышқылымен әрекеттеспейтін металл Hg 458 Өзгерістер сызба нұсқасында сілті қатысатын сатылар: 1 2 3 4 Br2 →KBrO3→Br2→NaBrO3→NaBr 1,3 459 Темір (ІІІ) хлориді гидролизінің екінші сатысындағы толық иондық теңдеуіндегі коэффиценттер қосындысы: 8 460 Cl2+H2O→ HClO+HCl үрдісіндегі химиялық тепе теңдік өнім түзілу жағына ығысу үшін қосатын зат дистилденген су 461 Сілтілік-жер металдарға жататын элемент Ca 462 Ең белсенді элемент Cs 463 Қалыпты жағдайда сумен әрекеттеседі Ca 464 Cілтілік металл Na 465Тұз ерітіндісінде лакмус көк түске боялады CuCl2 466 Калий атомының электрондық конфигурациясы 1s22s22p63s23p64s1 467 Натрий мен су арасындағы реакцияның өнімі және алдарына қойылатын коэффициенттері мына реакция теңдеуіне сәйкес келеді 2NaOH+H2 468 Натрий атомының электрондық конфигурациясы 1s22s22p63s1 469 Реакция теңдеуіндегі К+О2  К2О, калийдің алдында қойылатын коэфициент: К2О, калийдің алдында қойылатын коэфициент:4 470 К2СО3 ерітіндісінде лакмус түсінің өзгеруі көгереді 471 Сілтілік металдарға жатады K, Na, Li 472 Калийдің сумен әрекеттесу теңдеуіндегі барлық коэффициенттердің қосындысы: 7 473 4 моль натрий сульфидінің массасы: 128 г 474 Натрий оксидін халықаралық номенклатурасы бойынша аталуы динатрий монооксиді 475 Натрий атом ядросында протон және нейтрон саны 11 және 12 476 0,7 моль глицерин артық мөлшерде алынған, натриймен әрекеттескенде түзілетін сутектің (қ.ж) көлемі 23,5л 477 4,6 г натрий металы этил спиртімен әрекеттескенде түзілетін сутектің (қ.ж) көлемі 2,24 л 478 34 г натрий нитратындағы молекула саны: 2,408∙1023 479 0,5 моль натрий мен 100г аминопропион қышқылы әрекеттескенде түзілетін тұздың массасы: 55,5г 480 Сілтілік металл 3,42г сумен әрекеттескенде 448 мл сутегі бөлініп шығады. (қ.ж) Осы сілтілік металл: Rb 481 Калий фториді ертіндісі электролиздегенде берілген электрон саны: 2 482 0,1моль натрий гидроксидін бейтараптау үшін 20% -ті құмырсқа қышқылының қажетті массасы: 23 483 Бірінші топтың негізгі топшасында орналасқан: Сілтілік металдар 484 Алюминийдің валенттілігі 3 485 Алюминий гидроксидінің формуласы: Al(OH)3 486 Қосылыстарда алюминийдің тотығу дәрежесі: +3 487 Al+O2→ Al 2O3 реакциясы теңдеуінде алюминийдің алдына қойылатын коэффициент : 4 488 5,4г алюминий мен 5,76г күкіртті қыздырғанда түзілетін алюминий сульфидінің массасы: 9г 489 Al3+ +3OHˉ→Al(OH)3↓ қысқартылған иондық теңдеуі мына заттардың әрекеттесуіне сәйкес келеді: алюминий хлориді, сілті 490 Алюминий нитраты ерітіндісінде лакмустың түсі: қызыл 491 Алюминийдің темір оксидімен (II) реакциясы теңдеуінде тотықсыздандырғыштың алдына қойылатын коэффициент: 2 492 Al 2O3,KCI және FeCl2 қосылыстарындағы металдардың валенттілігі төмендегі қатарға сәйкес келеді: 3,1,2 493 Алюминийдің оттекте реакциясы теңдеуіндегі тотықсыздандырғыш формуласының алдына қойылатын коэффициент: 4 494 Мына сызбанұсқаға Э→ Э2O5→ Н3ЭО4 сәйкес келетін генетикалық қатар: фосфор→фосфор оксиді→фосфор қышқылы 495 Алюминийді таза күйінде алғаш рет алған ғалым Велер, 1827ж 496 65г алюминий гидроксидінің зат мөлшері 0,83 моль 497 Төмендегі өзгерістер тізбегіндегі X4 заты Al   X1 X1 X2 X2 X3 X3 X4 X4 Na[Al(OH)4] 498 Егер шығымы 100% болса, 10г алюминийді оттекте жаққанда алынған алюминий оксидінің массасы: 18,9г 499 Алюминий атомында электрондардың энергетикалық деңгейлерге орналасуы 2  8 8 3 3 500 Алюминотермия әдісімен алуға болатын металдар тобы: Ni, Cr, Zn 501 Өзгерістер тізбегіндегі айырылу реакциялары Al(OH)3  Al 2O3 Al 2O3 AlCI3 AlCI3 Al(NO3)3 Al(NO3)3 Al 2O3 Al 2O3 AlCl3 AlCl31,4 502 Алюминий карбидінің құрамына кіретін көміртектің тотығу дәрежесі -4 503 Al  Al(OH) 3 Al(OH) 3 AlCI3 AlCI3 Al(OH)3 Al(OH)3 Na[Al (OH)4] өзгерістер тізбегіндегі алюминийдің амфотерлік қасиетін көрсететін реакциялар Na[Al (OH)4] өзгерістер тізбегіндегі алюминийдің амфотерлік қасиетін көрсететін реакциялар2,4 504 Сутекпен мыс оксиді (II) әрекеттескенде түзілетін өнімдер CuH2+ H2O 505 Темір атомының ядросындағы протондар саны 26 506 Темір (III) оксидінің формуласы Fe2O3 507 10г мырыш пен 10г күкірт әрекеттескенде түзілген мырыш сульфидінің массасы: 14,9г 508 325 г мырыш тұз қышқылымен әрекеттескенде бөлінетін сутектің зат мөлшері: 5 моль 509 FeO→Х→FeCl2 өзгерісінде Х заты Fe 510 Темірдің қағының формуласы: FeO· Fe 2O3 511 Fe+2НCI= FeCl2+ H2↑ реакция теңдеуіндегі тотықсыздандырғыштың алдына қойылатын коэффициент 2 512 Мырыш атомындағы электрондар саны: 30 513 Мыстың периодтық жүйедегі орны: 4 период, 1топ, қосымша топша 514 Zn  Zn(NO3)2 Zn(NO3)2 ZnCO3 өзгерісіндегі «Х» және «У» заттарының формуласы: ZnCO3 өзгерісіндегі «Х» және «У» заттарының формуласы:Х- НNO3; У- К 2СО3 515 Мыс концентрлі күкірт қышқылымен әрекеттескенде түзілетін заттар CuSO4+ H2О+ SO2 516 Темір хлормен әрекеттескенде мына қасиетті көрсетеді тотықсыздандырғыш 517 2 моль темірдің зат мөлшеріндегі атом саны 12,04·1024 518 Темір ... периодта орналасқан 3 519 Fe3+- ионының электрондық конфигурациясы ... 3d5 520 1,6 г мыс (II) сульфаты бар ерітіндімен әрекеттескен темір тақташадан ерітіндіге өткен темір атомдарының саны 6,02·10²¹ 521 Mn (II) оксидінің формуласы: MnО 522 Мыстың негіздік карбонаты (CuОН)2СО3 ыдырағанда түзілетін заттар: 2CuО+ H2О+ СО2 523 32г мыс ұнтағы 11,2л оттек (қ.ж) бар ыдыста қатты қыздырылды. Түзілген оксидтің массасы: 40г 524 Өзгерістер тізбегіндегі тұнба түзілетін реакциялар СuО  СuCl2 СuCl2 Cu (ОН)2 Cu (ОН)2 СuSO4 СuSO4 Cu3(PO4)2 Cu3(PO4)22,4 525 Мыстың массалық үлесі көп қосылыс Cu2O 526 Аg- химиялық таңбасының оқылуы аргентум 527 0,1моль темір 75г 20%-тті мыс(II) сульфаты ерітіндісімен әрекетескенде түзілетін мыстың массасы 6 528 Массасы 16г мыс (ІІ)оксидінің ұнтағы сутекпен толық тотықсыздандырылды.Түзілген мыстың массасы 12,8 529 Тек қосымша топша металдары орналасқан қатар Mn , Tc , Re,V, Mo 530 Табиғатта бос күйінде кездесетін металл алтын 531 Тізбектегі «А» заты Cu→ CuSO4→ Cu (ОН)2→А→Сu Тізбегіндегі А заты CuO 532 Органикалық химия-... Көмірсутектер мен олардың туындылары 533 «Органикалық химия» деген атауды ұсынған ғалым... И.Берцелиус 534 Органикалық қосылыстардың химиялық құрылыс теориясының негізін қалаған ғалым... А.Бутлеров 535 Изомерия дегеніміз- ... заттар Молекулаларының құрамы бірдей, бірақ химиялық құрылыстары әр түрлі 536 Органикалық қосылыстар... үлкен топқа бөлінеді 2 537 Көмірсутектер – құрамына тек қана ... элемент кіретін органикалық қосылыстар 2 538 Құрамында 14 сутегі атомы бар қаныққан көмірсутегінің изомерінің саны 5 539 Химиялық өзгерістер нәтижесінде түзілетін Х заты: CH4→X→C2H6→CO2 хлорметан 540Қосылыстардың жалпы формуласы СпН2п+2 алкандар 541 Органикалық қосылыстардағы көміртек атомының арасындағы химиялық байланысының түрі... ковалентті полюссіз 542 Қалыпты жағдайда 6л оттегінің массасы 6л метанның массасынан ауыр 2 есе 543 Сутекті байланыс көмірқышқыл газының молекулалары арасында пайда болады 544 Радикал: C2H5 545 Глюкоза құрамы бойынша әрі көп атомды спирт, әрі альдегид 546 Метандағы көміртектің массалық үлесі: 75% 547 «Батпақ газы» деп аталатын алкан метан 548 Көмірсутектердің табиғи көздері қатарына жатпайды гранит 549 Алкандар қатарына жататын көмірсутек С10Н22 550 Құрамында 20 сутек атомы бар қаныққан көмірсутектің молярлық массасы: 128 г/моль 551 Молярлық массасы 100 г/моль қаныққан көмірсутегінің формуласы: С7Н16 552 Массасы 352г пропанның зат мөлшері: 8моль 553 Қалыпты жағдайда 1л бутанның массасы (г) 2,59 554 Егер жағуға 134,4л оттек жұмсалған болса, жанған пропанның (қ.ж) көлемі: 26,88 л 555 Метанның жану реакциясының термохимиялық теңдеуі СН4+2О2→ СО2+2Н2O+880кДж 10г метан жанған кезде бөлінетін жылу мөлшері (кДж) 550 556 Күшті электролит күкірт қышқылы 557 Іс жүзінде аяғына дейін жүретін реакция H2SO4+BaCl2→ 558 100 молекула тұздың 40 молекуласы иондарға диссоциацияланса, оның диссоциациялану дәрежесі 40% 559 Әлсіз электролит H2CO3 560 Ерітіндісінде фенолфталеин индикаторының түсі таңқурай түсті болатын қосылыс K2CO3 561 Күшті қышқыл HNO3 562 200 молекула тұздың 40 молекуласы иондарға диссоциацияланса, оның диссоциациялану дәрежесі 20 % 563 Бір моль натрий фосфатын суда еріткенде, тұз толық диссоциацияланса, түзілген натрий ионының молі 4 564 Химиялық реакцияға түсетін жұп CuCl2 және NaOH 565 Гидролизденетін тұз Na2CO3 566 Әлсіз электролиттің диссоциациялану дәрежесін көтеру үшін Ерітіндіні араластыру керек 567 SO42- анионына сапалық реакция BaCl2+Na2SO4=BaSO4+2NaCl 568 Fe2+ катионына сапалық реакция FeSO4+2NaOH=Fe(OH)2+Na2SO4 569 220 грамм 7% –тік күкірт қышқылы ерітіндісімен құрамында 2 моль барий хлориді бар ерітінді әрекеттескенде түзілген тұнбаның массасы 36,6г 570 Натрий атомының натрий ионынан айырмашылығы Тотығады 571 Ток өткізетін зат Қант 572 Күшті қышқыл HClO4 573 Cl- анионына реактив болатын зат Күміс нитраты 574 Ерітіндіде сілтілік ортаны көрсететін тұз Na2SO3 575 200г 20%-тік калий гидроксидінің ерітіндісі мен 200г 10%-ті тұз қышқылының ерітіндісімен әрекеттескенде, түзілген тұздың массасы 40,8г 576 50г 26,5% - тік натрий карбонатының ерітіндісіне 24,5г күкірт қышқылын құйғанда, бөлінген газдың (қ.ж) көлемі 2,8л 577 Массасы 200г, массалық үлесі 0,15 натрий гидроксидімен массасы 500г массалық үлесі 0,25 натрий гидроксидінің ерітіндісін араластырған. Алынған ерітіндідегі натрий гидроксидінің массалық үлесі 22,1 % 578 Зарядталған бөлшек ион 579 Ион алмасу реакциясы CaCl2 +Na2CO3→CaCO3↓+2NaCl 580 Бір мезгілде сулы ерітіндіде бола алатын ион жұптары Ca2+ және NO3- 581 10,6г натрий карбонаты тұз қышқылымен әрекеттескенде түзілген газдың көлемі 2,24л 582 Сулы ерітіндіде тек анион бойынша гидролизденетін натрий тұзы силикат 583 Алюминий сульфаты ерітіндісінде лакмус индикаторының түсі қызыл 584 Күшті электролиттер диссоциацияланады Іс жүзінде толығымен 585 Су молекуласымен қоршалған иондар- Гидратталған иондар 586 Әлсіз қышқыл CH3COOH 587 Формуласы қате жазылған тұз AlOHCl 588 H++OH- →H2O сәйкес келетін толық молекулалық теңдеу HCl+NaOH→ H2O +NaCl 589 2 моль натрий гидроксидінің ерітіндісі мен 1 моль күкірт қышқылының ерітіндісін араластырғанда, лакмус түсі Күлгін 590 Диссоциациялану дәрежесіне әсер етпейтін фактор Қысым 591 Дұрыс жазылған қысқартылған иондық теңдеуі A) Ca2++Cl-→CaCl2↓ B) Ba2++OH-→Ba(OH)2↓ C) Ag++Cl-→AgCl↓ D) 2H++OH-→H2O↑ E) Na++OH-→NaOH {Правильный ответ}= {Сложность}=B {Учебник}=химия,9,Н.Нурахметов и др., 2005 ж. {Класс}=9 {Четверть}=1 $$$016 592 Қысты күні тайғақ болғанда, мұз қатқан жолға NaCl немесе CaCl2 себеді, сонда мұз ериді, себебі Еріткіштен қату температурасы төмен ерітінді түзіледі; 593 Иондардың тотықсыздану қасиеттерінің арту қатары J-→Br-→Cl- 594 PO43- анионына сапалық реакция H3PO4+AgNO3→ 595 Темір (ІІІ) хлоридімен барий гидроксиді әрекеттескенде түзілген тұнбаның мольдік массасы 107 г/моль 596 pH>7 болады, егер C(H+)< C(OH-) 597 Ерітіндіде pH>7 болады, егер Na2CO3 598 Көлемі 200 мл, тығыздығы 1,075г/мл 20% - тік тұз қышқылы ерітіндісімен массасы 20г мәрмәр әрекеттескенде, түзілген көмір қышқыл газының (қ.ж) көлемі 4,48л 599 Негіздік оксид K2O 600 Қышылдық оксид CO2 601 Амфотерлі оксид PbO 602 100г мәрмәрді қыздырғанда бөлінген көмірқышқыл газының (қ.ж) көлемі 22,4л 603 10,2г Al2O3 зат мөлшері 0,1 моль 604 Азоттың жоғары оксиді N2O5 605 0,1моль көмірқышқыл газының (қ.ж) көлемі 2,24л 606 SO3 оксидтегі күкірттің тотығу дәрежесі +6 607 Қышқылдық оксид + су = қышқыл, осы сызбанұсқаға сәйкес келетін реакция SO3+H2O=H2SO4 608 H2S→SO2→A→H2SO4→SO2 А заты SO3 609 Бір бірімен әрекеттесетін заттар жұбы Na2O мен SiO2 610 Электрондық конфигурациялары ...3s2 3р4 мен ... 2s2 2р4 әрекеттескенде, түзілген жоғарғы оксидтің мольдік массасы 80г/моль 611 Теңдеудің оң жағындағы түзілетін заттың формуласы 3Fe + 2O2 = Fe3O4 612 Шынының формуласы Na2O∙CaO∙6SiO2 613 4г күкіртті жаққанда 37,1кДж жылу бөлінді, 1 моль күкірт жанғанда бөлінген жылу мөлшері 297 кДж 614 4FeS2 + 11O2 = Fe2O3 + 8SO2 теңдеуі бойынша 64 грамм SO2 алу үшін жұмсалатын FeS2 зат мөлшері 0,5моль 615 Pb(NO3)2 айрылғанда түзілетін оксид NO2 616 Көмірқышқыл газы көмір (ІІ) оксидінен ... ауыр 1,57 есе 617 Массасы 2 т глиноземнен 1 т алюминий алынса, өнімнің шығымы 94 % 618 PbS + HNO3 = PbSO4 + H2O + NO түзілген газдың алдындағы коэффициент 8 619 Құрғақ мұздың формуласы Қатты СО2 СО2 620 Суда еритін негіз Литий гидроксиді 621 Екідайлы гидроксид Pb(OH)2 622 Реакция өнімдері Cu(OH)2→ CuO+H2O 623 Натрий гидроксидімен әрекеттеспейтін зат Cu(OH)2 624 Сөндірілген ізбестің формуласы Ca(OH)2 625 Массасы 37 г сөндірілген ізбестің зат мөлшері 0,5 моль 626 Сілті ерітіндісіндегі фенолфталеин түсі таңқурай түсті 627 5,6 г калий гидроксидінің молекула саны 0,602 ∙1023 628 Күшті негіз KOH 629 Мына қатарда Mg(OH)2→Ca(OH)2→Sr(OH)2→Ba(OH)2 негіздік қасиет Күшейеді 630 40 г 10%-тті мыс сульфаты натрий гидроксидімен әрекеттескенде түзілген мыс (ІІ) гидроксидінің массасы 2,45 г 631 20г 49%-тті күкірт қышқылын бейтараптауға жұмсалған 10%-тті натрий гидроксидінің массасы 80г 632 Термиялық айрылғанда оксид түзетін негіз Fe(OH)3 633 Cr2(SO4)3→X→Cr2O3→Cr Х заты хром (ІІІ) гидроксиді 634 Екідайлы негіз+қышқыл=тұз+су теңдеуге сәйкес келеді: Pb(OH)2+2HCl=PbCl2 +2H2O 635 19,6 г мыс (ІІ) гидроксидін термиялық жолмен айырғанда түзілген мыс (ІІ) оксидін тотықсыздандыруға жұмсалған сутектің көлемі 4,48л 636 Натрий тетрагидроксоцинкатының формуласы Na2[Zn(OH)4] 637 Cr2(SO4)3+KMnO4+H2O=K2Cr2O7+Mn(OH)4+H2SO4 барлық коэффициенттер қосындысы 16 638 Көлемі 160 мл массалық үлесі 20%, (ρ=1,25г/мл) натрий гидроксиді ерітіндісіне қорғасын нитраты ерітіндісінің жеткілікті мөлшерімен әсер еткенде түзілген қорғасын (ІІ) гидроксидінің массасы 120,5г 639 Еріген заттың массалық үлесі 20% , (ρ=1,25г/мл) көлемі 500 мл натрий гидроксиді ерітіндісінен көлемі 200 мл суды буландырғаннан кейінгі ерітіндідегі негіздің массалық үлесі 29 % 640 Массасы 53,5 г темір (ІІІ) гидроксидін еріту үшін қажетті тығыздығы 1,039 г/мл 8%–тті тұз қышқылы ерітіндісінің көлемі 659 мл 641 KMnO4+Na2SO3+H2O=MnO2+KOH+Na2SO4 калий гидроксидінің алдындағы коэффициент 2 642 Көлемі 1 л суға массасы 200 г кальций қосқанда түзілген кальций гидроксидінің массалық үлесі 31,1% 643 Қышқыл HCl 644 Бір негізді қышқыл HI 645 HNO3 осы қосылыстағы азоттың тотығу дәрежесі +5 646 Өте әлсіз қышқыл көмір қышқылы 647 3,4 г күкіртсутек қышқылының зат мөлшері 0,1моль 648 H2Cr2O7 осы қосылыстағы хромның тотығу дәрежесі және валенттілігі +6, VI 649 Молекулалық массасы жоғары қышқыл H3PO4 650 үшті қышқыл HCl 651 Н3ВО3 осы қышқылға сәйкес келетін оксидтің формуласы B2O3 652 Зертханада 5,85 г натрий хлориді концентрлі күкірт қышқылының артық мөлшерімен әрекеттескенде түзілген хлорсутектің (қ.ж) көлемі 2,24л 653 Сұйытылған азот қышқылымен әрекеттескенде аммоний нитратын түзетін металл Zn 654 Күшті тотықтырғыш азот қышқылы 655 Массасы 30 г мыс пен алюминий қоспасына концентрлі азот қышқылымен әсер еткенде 13,44 л газ (қ.ж) бөлінді. Қоспаның құрамы 19,2 гCu, 10,8 гAl 656 Қышқыл ерітіндісінен сутек бөліп шығармайды Cu 657 H2O→H2S→H2Se→H2Te осы қатарда қышқылдық қасиет артады 658 Қатты күйінде кездесетін қышқыл бор қышқылы 659 Тізбектегі Х заты X→S→SO2→SO3 →MgSO4 H2S 660 Тотықтырғыш қасиеті ең жоғары қышқыл HClO 661 Массасы 140 г концентрациялы азот қышқылына 32 г мыс ұнтақтарын салғанда түзілген мыс нитратының массасы 94г 662 Массасы 316 г 25%-тті KMnO4 ерітіндісі тұз қышқылымен әрекеттескенде түзілген хлордың (қ.ж) көлемі 28 л 663 Құрамында 71 % фосфор ангидриді бар 50 г фосфориттен алуға болатын тығыздығы 1,526 г/мл, 70% фосфор қышқылының көлемі 45,87 л 664 Массасы 200 г 15%–тті күкірт қышқылына 300 г су қосқанда түзілген күкірт қышқылы ерітіндісінің концентрациясы 6 % 665 Көлемі 2 л хлор сутекпен әрекеттескенде 16,385 кДж жылу бөлінеді. Хлор сутектің түзілу жылуы 91,756 кДж 666 Еріген заттың массалық үлесі 0,35 H2SO4 ерітіндісін дайындау үшін массасы 600 г массалық үлесі 0,55 H2SO4 ерітіндісіне қосатын массалық үлесі 0,25 H2SO4 ерітіндісінің массасы 1200г 667 Еріген заттың массалық үлесі 50%–дық 200 г H2SO4 ерітіндісін әзірлеу үшін 60%–дық және 20%–дық ерітінділердің массасы 150г; 50г 668 Орта тұз CaCO3 669 Қышқылдық тұз NaHSO4 670 Негіздік тұз MgOHCl 671 Al(OH)2Cl қосылыстын аталуы, алюминий дигидроксохлориді 672 13,6 г кальций гидрофосфатының зат мөлшері 0,1моль 673 Бертолле тұзының формуласы KClO3 674 Салыстырмалы молекулалық массасы жоғары тұз NaI 675 Қазақша «алмас» деп аталатын тұз сынап (II) хлориді 676 Ерімейтін тұз барий сульфаты 677 Уақытша кермектілік судың құрамында болады. кальций және магний гидрокарбонаты 678 Құрамына 43,4%Na, 13,3%C, 45,4%O кіретін қосылыстың формуласы Na2CO3 679 CuSO4∙10H2O құрамындағы судың массалық үлесі 53% 680 KMnO4+KNO2+H2O=KNO3+MnO2+KOH тотықсыздандырғыштың алдындағы коэффициент 3 681 KNO2 +KI+H2SO4=NO+I2+K2SO4+H2O тотықтырғыштың алдындағы коэффициент 2 682 112 г темір сұйылтылған күкірт қышқылының артық мөлшерінде ерітілген. Алынған тұздың зат мөлшері 2 моль 683 Кальций карбонатының ерітіндісінен артық мөлшерде көмірқышқыл газын өткізгенде түзілетін зат кальций гидрокарбонаты 684 Оттегін алуға болатын тұз Hg(NO3)2 685 Иондық байланысы бар заттар CaCl2 686 12 кг пириттен 14,7 кг күкірт қышқылы алынған.Өнімнің шығымы 75% 687 Массасы 50 г 20%–тті Na2SO4 ерітіндісін дайындау үшін қажет кристаллогидраттың (Na2SO4 ∙10H2O) массасы және судың көлемі 22,6г, 27,4мл 688 Көлемі 4,48 л (қ.ж) оттек алу үшін қажетті KClО3, KMnO4 қажет массалары 16,3г, 63,2гг 689 Аммоний гидрокарбонаты кондитер тағамдарын пісіруге қолданылады. Егер қамырға 39,5 г NH4HCO3 қосылған болса, термиялық айырылу кезінде түзілген газдардың (қ.ж) көлемі 22,4л 690 Алкендерге жатады этилен 691 Көлемі 6,72 л пропеннің зат мөлшері 0,3моль 692 Этиленнің бір валентті қалдығын винил 693 Изопреннің құрылымдық формуласы СН2=С(СН3)-СН=СН2 694 Алкендердің өндірістік алу жолы Крекинг 695 Алкендердегі көміртегі атомының гибридтелген күйі sp2 696 Алкендердің жалпы формуласы CnH2n 697 50г пентен-2 толық жану үшін (қ.ж) жұмсалатын оттектің көлемі 120л 698 Ауа бойынша салыстырмалы тығыздығы 1,93 болатын алкеннің формуласы С4Н8 699 Пропеннің гомологі болатын зат СН3-СН2-СН=СН2 700 Алкендерге реагент болатын жұп KMnO4, Br2 суы  701 Н3С-С(СН3)=СН-СН2-СН3 жүйелі номенклатура бойынша атауы 701 Н3С-С(СН3)=СН-СН2-СН3 жүйелі номенклатура бойынша атауы2-метилпентен-2 702 Өзгеріс тізбегіндегі Z заты: H2SO4(конц), 180-2000С HBr Na    Этил спирті Х У Z Этил спирті Х У Z703 Этиленді катализатор қатысында гидратациялағанда түзілетін өнім этанол 704 Егер жану реакциясы өнімдерінің мольдік қатынасы 4:4 болса, көмірсутектің аталуы бутен 705 Бутен молекуласының құрылымдық изомерлер саны 3 706 Көлемі 11,2л алканнан (қ.ж) алуға болатын алкеннің зат мөлшері 0,5моль 707 Зат мөлшері 1,5моль этиленді сумен әрекеттестіргенде, шығымы 80% болса алынған этанолдың массасы 55,2г 708 Көлемі 35% этаннан және 65% этиленнен тұратын 20л газ қоспасы (қ.ж) бром суымен әрекеттескенде түзілетін бромэтанның зат мөлшері 0,58моль 709 Бром суындағы бромның массалық үлесі 1,6 % болса, көлемі 1,12л (қ.ж) пропиленді түссіздендіре алатын бром суының массасы 500г 710 Белгісіз көмірсутектің ауамен салыстырғандағы тығыздығы 1,931г/мл.Егер оның 5,6г жаққанда 15,6г СО2 , 7,2гН2О түзілсе, көмірсутектің формуласы С4Н8 711 Көлемі 400мл (қ.ж) метан мен этилен қоспасы массасы 40г 3,2%-тті бром суын түссіздендірді. Қоспадағы этиленнің көлемдік үлесі 44,8% 712 Көлемі 200мл этанды дегидрлегенде (шығымы 85% ) этилен түзілді. Осы этиленнен алынатын 1,2-дихлорэтанның (тығыздығы 1,24г/мл) көлемі 0,606мл 713 Алкиндердің жалпы формуласы CnH2n-2 714 Массасы 80г пропиннің (қ.ж) көлемі 44,8мл 715 Мына қосылыстың халықаралық номенклатура бойынша атауы: СН3-С≡СН пропил 716 Алкиндердің радикалы Н-С≡С-этинил 717 Массасы 50г табиғи метан газынан алынатын ацетиленнің массасы 40,6г 718 Құрамында 22 сутек атомы бар көмірсутек алкин қатарына жатса, оның құрамындағы көміртек атомы 12 719 Ацетиленнің гомологы НС≡С-СН3 720 Ацетиленнің сутек бщйынша салыстырмалы тығыздығы 13 721 Hg+2 тұздары қатысында ацетиленнің сумен қосылу реакциясының аталуы Кучеров реакциясы 722 Бутен-1-ин-3 формуласы СН≡С-СН=СН2 723 52 г ацетиленмен толық әрекеттесетін бромның массасы 640г 724 Пентиннің мүмкін болатын құрылымдық изомер саны 3 725 Өзгерістер тізбегінде «Х» және «У» заттары: CaCO3→CaO→X→C2H2→У→C2H5Cl кальций карбиді, этилен 726 Көлемі 11,2л (қ.ж) ацетиленді толық жағу үшін жұмсалатын ауаның көлемі (оттектің ауадағы үлесі 20 %) 140л 727 Ацетиленге сапалық реакция KMnO4 тотығуы 728 Теңдеудегі KMnO4+H2SO4+C2H2→K2SO4+MnSO4+CO2+H2O жалпы коэффициенттер саны 15 729 Массасы 400г құрамында 15% қоспасы бар кальций карбидінен 80%–ттік шығыммен ацетилен алынса, ацетиленнің көлемі 95,2л 730 С2Н2+3О2→2СО2+Н2О2; ΔН=-1400кДж/моль. Егер осы реакцияға 336л оттегі түссе бөлінген жылудың мөлшері 7000кДж 731 Массасы 9,9г дихлорэтан алу үшін хлорсутекпен әрекеттесетін ацетиленнің (қ.ж) көлемі 2,24л 732 132г СН3СОН ацетальдегид (шығымы 75%) алу үшін жұмсалатын құрамында 28 % қоспасы бар кальций карбидінің массасы 265,5 733 Аталуы –диен жалғауымен аяқталатын көмірсутектің формуласы СН2=СН-СН=СН2 734 Бутадиен-1,3 молекуласында көміртегі атомдарының гибридтелген күйі sp2, sp3 735 2-метилбутадиен -1,3 формуласы Н2С=С(СН3)-СН=СН2 736 Винилацетиленнің молярлық массасы 52 г/моль 737 0,1моль хлоропреннің массасы 8,85г 738 Каучуктың жалпы формуласы (С5Н8)п 739 Алкадиен Н2С=С(СН3)-СН=СН2 740 Көлемі 1,12л (қ.ж) бутадиенмен бірінші әрекеттесетін бромның массасы 8 г 741 Изопреннің полимерлену реакциясы пН2С=С(СН3)-СН=СН2→(-Н2С-(СН3)С=СН-СН2-)п 742 Синтездік каучуктың мономері изопрен 743 Бутадиен–1,3 сутек бойынша салыстырмалы тығыздығы 27 744 Этил спиртінен бутадиенді алғаш алған ғалым С.В.Лебедев 745 Лебедев реакциясы 2С2Н5ОН→Н2С=СН-СН=СН2+2Н2О+Н2 746 Бутадиен-1,2 гомологы СН2=С=СН-СН2-СН3 747 Газ тәрізді көмірсутекті 11,2л (қ.ж) жаққанда, 33,6л СО2 мен 18г су түзілді. Көмірсутектің молекулалық формуласы С3Н4 748 Каучук жұмсарады температура жоғарлағанда 749 Ауа бойынша тығыздығы 1,86-ға тең, құрамындағы көміртектің массалық үлесі 88,9% болатын көмірсутектің молекулалық формуласы С4Н6 750 Өзгерістер тізбегіндегі «Х» заты этан→хлорэтан→этил спирті→Х→дивинил каучугы дивинил 751 Алкадиендерге сапалық реакция СН2=СН-СН=СН2+2Br2 →СН2Br-СНBr–СНBr-СН2Br 752 Каучук еритін зат бензин 753 136 г изопренді толық гидрлеу үшін (қ.ж) қажетті сутектің көлемі 89,6 л 754 Өзгерістер тізбегіндегі C2H4→C2H6→ C2H5Cl→ C2H5OH→H2C=CH – CH=CH2 бойынша 0,5 моль хлорэтаннан алуға болатын бутадиеннің массасы 27,5 г 755 Массасы 10,8 бутадиенді (СH2=CH-CH=CH2) катализатор қатысында гидрленгенде түзілген бутен-2 мен бутан қоспасы 160г 4% бром суын түссіздендірген. Қоспадағы бутанның массасы 9,28 г 756 Бутадиенді гидрлегенде массасы 12,81г бутан мен бутен-2 қоспасы түзілді. Қоспаны бромдағанда массасы 34 г 2,3-дибромбутан түзілсе, қоспадағы бутен-2 массалық үлесі (%) 68,7 757 Арендердің жалпы формуласы CnH2n-6 758 Арендердің алғашқы өкілі: бензол 759 Бензол молекуласында көміртегі атомдарының гибридтелген күйі sp2 760 Бензол радикалының аталуы: фенил 761 0,5моль бензолдың массасы 39г 762 Бензол формуласы: С6Н6 763 Толуолдың ең жақын гомологы этилбензол 764 Стиролдың салыстырмалы молекулалық массасы 104 765 Ацетиленнен бензолды алу реакциясы тримерлену 766 Бензолдың құрылымдық формуласын ұсынған ғалым А. Кекуле 767 Изомерлері болмайтын зат бензол 768 Бензол әрекеттеспейтін зат H2CO3 769 Шығымы 75% болса, 3,2кг CaC2 ден алынған бензол массасы 975г 770 Массасы 170 г гексахлоран (C6H6Cl6) алу үшін қолданылатын циклогексан массасы 49,07г 771 Массасы 156 г бензол массасы 193,5 г хлорэтанмен әрекеттескенде шығымы 80 % болады, түзілген этилбензол массасы 169,6 г 772 Гексахлоранды бензолдан алу реакциясы hν С6H6+3Cl2 → С6H6Cl6 AlCl3 773 Көлемі 266мл тығыздығы 0,88г/мл бензолды нитрлеу үшін 75%–тті, тығыздығы 1,445г/мл азот қышқылының көлем 174,4мл 774 Бензолды катализатор қатысында хлорлағанда бөлінген хлорлы сутекті толығынан сіңіру үшін көлемі 250мл, тығыздығы 1,225г/мл 20%-дық натрий гидроксидінің ерітіндісі қажет болды.Тығыздығы 0,88г/мл бензолдың көлемі 135,72мл 775 Бензол алудың негізгі көзі тас көмірді кокстеу 776 Бензолдан хлорбензол мен гексахлоран алу үшін жүргізілетін жағдай Cl2 (AlCl3),Cl2 (hv) 777 Судың қатты күйіндегі тығыздығы: 0,92 г/см3 778 Қалыпты жағдайда 1 см3 судың массасы: 1 г 779 Суда ерімейтін негіз: Cu(OH)2 780 Күрделі зат: су 781 Судың химиялық формуласы: Н2О 782 Судың 45 г сәйкес келетін зат мөлшері: 2,5 моль 783 Судың салыстырмалы молекулалық массасы: 18 784 Судың молярлық массасы: 18 г/моль 785 +40 С температурада судың тығыздығы: 1 г/мл 786 Металл және бейметалл оксидтері сумен химиялық әрекеттескенде түзіледі: негіз және қышқыл 787 Осы заттың ерітіндісі электртоғын өткізбейді: C12H22O11 788 Берілген заттардың арасында иондық қосылыс: NaCl 789 Электролиттерге жатады: тұздардың судағы ерітінділері 790 Суда еритін екі тұздың арасындағы ион алмасу реакциясының сызбанұсқасы: NaCl+AgNO3 →AgCl↓ +NaNO3 791 Салыстырмалы молекулалық массасы 58,5-ке тең болатын электролит: NaCl 792 Сумен әрекеттескенде негіз түзетін оксидтің формуласы: Na2O 793 Суда еритін (сілтілер) қатары: LiOH, NaOH 794 Суда ерімейтін негіздер қатары: Cu(OH)2, Fe(OH)3 795 12,8 г метан жанғанда түзілетін судың массасы: 28,8 г 796 Массалық үлесі 18%, 500 г ерітінді даярлау үшін тұз бен су массалары: 90 г тұз және 410 г су 797 Ортафосфор қышқылы ... сатыда диссоцияланады үш 798 Сумен әрекеттесіп қышқыл түзетін оксидтер: Р2О5, СО2 799 Әк суының формуласы Ca(OH)2 800 Кальций гидроксидін түзетін заттар жұбы: CaO және H2O 801 HCl диссоциацияланғанда түзілетін иондар: Н+ және Cl- 802 Салыстырмалы молекулалық массасы 74-ке тең болатын негіз формуласы: Ca(OH)2 803 Лакмус қышқылда - ... түске боялады: қызыл 804 Фосфор қышқылын түзетін заттар жұбы: P2O5 және H2O 805 Суда еріткенде металл катиондары мен қышқыл қалдығы аниондарын түзе ыдырайтын тұз: KNO3 806 Cуда ерімейтін зат: бензин 807 Газдардың суда ерігіштігі ... артады. температура төмендегенде және қысым жоғарылағанда 808 Ерітіндідегі еріген заттың концентрациясын арттыру үшін оны ... керек. буландыру 809 35 %- тік 100 г ерітіндіде еріген заттың массасы 35 г 810 Табиғатта кең таралған еріткіш: су 811 170 г суда 30 г В заты ерітілді. Заттың ерітіндідегі массалық үлесі: 15 % 812 50 г 4 %-тті ерітіндідегі сдың массасы: 48 г 813 20 %-тті 250 г ерітіндідегі заттың массасы: 50 г 814 15 г тұз 135 г суда ерітілді. Алынған ерітіндідегі тұздың массалық үлесі: 10 % 815 500 г 18 %-тті ерітінді даярлау үшін қажет тұз және судың массалары: 410 г су, 90 г тұз 816 Қышқыл ерітінділері мен металдардың өзара әрекеттесуі реакциясының типі: орын басу 817 Массасы 14,2 г Р2О5 суда ерігенде түзілетін Н3РО4-ның массасы мен зат мөлшері: 0,2 моль, 19,6 г 818 Электртерістік дегеніміз- атомдардыѕ ґзіне электрон тарту ќасиеті 819 Бір периодтаєы элементтердіѕ электртерістігі солдан оѕєа ќарай ґседі 820 Ковалентті байланыс дегеніміз - ортаќ электрон жўбы тїзетін екі атом ядроларыныѕ арасындаєы электрон химиялыќ байланыс 821 Иондыќ байланыс дегеніміз - иондардыѕ электростатикалыќ тартылуы нјтижесінде тїзілген химиялыќ байланыс 822 Металдыќ байланыс дегеніміз - металл иондары мен бос электрондар арасында тїзілетін байланыс. 823 Сутектік байланыс дегеніміз - бўл бір молекуладаєы оѕ полюстенген сутек атомы мен екінші бір молекуладаєы электртерістігі жоєары атом (фтор, оттек, азот, т.б.) арасында тїзілетін байланыс 824 Ковалентті полюссіз байланысы бар ќосылыс Cl2 825 Ковалентті полюсті байланысы бар ќосылыс HCl 826 Иондыќ байланысы бар ќосылыс NaF 827 Оттек молекуласындаєы химиялыќ байланыстыѕ тїрі ковалентті полюссіз 828 Хлор молекуласындаєы химиялыќ байланыстыѕ тїрі ковалентті полюссіз 829 Натрий галогенидтердіѕ NaF, NaCl, NaBr, NaI молекуласындаєы химиялыќ байланыстыѕ тїрі иондыќ 830 Азоттыѕ молекуласында ... бар. їш байланыс 831 Калий хлориді тїзетін кристалдыќ тордыѕ тїрі иондыќ 832 О2 тїзетін кристалдыќ тордыѕ тїрі молекулалыќ 833 Графиттіѕ кристалдыќ торыныѕ тїрі атомдыќ 834 Темірдіѕ кристалдыќ торыныѕ тїрі металдыќ 835 Алмаздыѕ кристалдыќ торы атомдыќ 836 Тек p-p электрондыќ бўлттарыныѕ бїркесуі есебінен тїзілген σ-байланыс (сигма) бар молекула N2 837 Байланыс полюстілігі кґбірек ќосылыс NaF 838 Cутектік байланыс тїзуге бейім ќосылыс H2O 839 s жјне p электрон бўлттарыныѕ бїркесуі нјтижесінде тїзілген молекула NH3 840 Полюсті байланыс кїштірек молекула HF 841 Їш байланыс бар молекула N2 842 Хлорсутек молекуласында химиялыќ байланыс тїзуге ќатысатын электрон саны 2 843 BeCl2 молекуласында бериллий атомыныѕ электрон орбитальдарыныѕ гибридтену тїрі sp 844 Ковалентті байланысы бар заттар орналасќан ќатар H2O, CS2, HI, PH3 845 Ќўрамында sp3 гибридтену кїйіндегі элементтері бар заттар єана орналасќан ќатар CH4, H2O, NH3 846 Молекуласындаєы байланыстыѕ полюстілігініѕ арту ретімен орналасќан заттар ќатары HBr – HCl – HF 847 Молекуласындаєы байланыстыѕ полюстілігініѕ кему ретімен орналасќан заттар ќатары H2O – H2S – H2Se 848 Донор - акцепторлы механизммен тїзілген байланысы бар бґлшек Н3О+ 849 Байланыс ўзындыєы еѕ їлкен зат молекуласы: HBr 850 Молекуласындаєы бір еселі байланыстар саны бірдей заттар ќатары С2H6, IF7 851 Молекуласындаєы «кґміртек – кґміртек» байланысыныѕ ўзындыєы еѕ кіші зат С2Н2 852 Тек ќана иондыќ байланысы бар заттар ќатары NaF, CsCl, KF 853 Тек ќана ковалентті байланыстары бар заттар ќатары CH4, I2, N2O 854 Тек ќана ковалентті полюсті байланысы бар заттар ќатары SF6, H2S, NH3 855 Молекуласындаєы екі еселенген байланыстар саны бірдей заттар ќатары B2O3, NO2 856 Пирамида пішінді молекула: NH3 857 Белгісіз заттыѕ балќымасы электролизденгенде бром жјне I топтыѕ негізгі топшасыныѕ металы тїзілді. Бастапќы заттыѕ ќўрамындаєы металдыѕ массалыќ їлесі 0,223 болса, осы заттыѕ формуласын жазып, химиялыќ байланыстыѕ тїрін аныќтаѕыз. иондыќ байланыс, NaBr 858 Қысымды жоғарылату осы тепе-теңдікті ығыстыруға әсер етпейді CO + H2Oбу ↔ СО2 + Н2 859 Берілген реакцияның CO + H2O ↔ CO2 + H2 + Q тепе-теңдігін оңға қарай ығыстыратын жағдай СО2 концентрациясын азайту 860 Қысымды жоғарылатқанда газ молекулаларынан тұратын тепе-теңдік күйдегі жүйенің тепе-теңдігі газ молекулалары санының азаю реакциясы жағына ығысады. 861 Қысымды азайтқанда газ молекулаларынан тұратын тепе-теңдік күйдегі жүйенің тепе-теңдігі газ молекулалары санының көбею реакциясы жағына ығысады. 862 Температураны жоғарылатқанда тепе-теңдік күйдегі жүйенің тепе-теңдігі ... жылу сіңіре жүретін реакция жағына ығысады 863 Реакция өнімінің концентрациясын көбейткенде тепе-теңдік күйдегі жүйенің тепе-теңдігі... реагенттер түзілетін бағытқа қарай ығысады. 864 Реакцияға түскен заттардың біреуінің концентрациясын азайтқанда тепе-теңдік күйдегі жүйенің тепе-теңдігі... осы заттың түзілу реакциясы жағына ығысады. 865 Әрекеттесуші заттардың біреуінің концентрациясын көбейткенде тепе-теңдік күйдегі жүйенің тепе-теңдігі ... осы заттың жұмсалу реакциясы жағына ығысады. 866 Температураны төмендеткенде тепе-теңдік күйдегі жүйенің тепе-теңдігі ... жылу бөле жүретін реакция жағына ығысады. 867 N2 + 3H2 ↔ 2NH3 + Q реакциясы бойынша аммиак шығымын көбейтуге әсер ететін жағдай жүйеде қысымды арттыру 868 Егер температура мен қысымды бір мезгілде арттырса, онда қай реакцияның тепе-теңдігі оң жаққа қарай ығысатын реакция теңдеуі 2N2 + O2 ↔ 2N2O - Q 869 Берілген жүйеде 2СО + О2 ↔ 2СО2 + Q қысымды көбейту, температураны төмендету, оттектің концентрациясын арттыру тепе-теңдікті оңға ығыстырады 870 Реакцияда сутек концентрациясын арттыру тепе-теңдікті солға ығыстырады аммиакты жай заттарға айыру 871 Қысымды арттырғанда тепе-теңдік оңға қарай ығысатын гомогенді реакция: 2H2 + O2 ↔ 2H2O(бу) 872 Қысымның өзгеруі тепе-теңдікке әсер етпейтін гомогенді реакцияның теңдеуі H2 + Br2 ↔ 2HBr 873 Гомогенді реакцияның 2СО + О2 ↔ 2СО2 + Q тепе-теңдігі солға қарай ығысады, егер температураны арттырса 874 Қысымды төмендеткенде тепе-теңдік өзгермейтін реакция, бұл - FeO + H2 ↔ Fe +H2O (бу) 875 Гетерогендік жүйедегі СаО(қ) + СО2(г) ↔ СаСО3(қ) + Q тепе-теңдік сол жаққа қарай ығысады, егер температураны жоғарылатса 876 Химиялық реакцияның жылу эффектісі дегеніміз - химиялық реакциялар кезінде бөлінетін немесе сіңірілетін жылу мөлшері. 877 Экзотермиялық реакция дегеніміз - жылу бөле жүретін реакция 878 Эндотермиялық реакция дегеніміз - жылу сіңіре жүретін реакция 879 Термохимиялық теңдеулер дегеніміз - реакцияның жылу эффектісі көрсетілген химиялық теңдеулер 880 Реакция кезінде бөлінетін немесе сіңірілетін жылу мөлшерінің белгіленуі: Q 881 Жылу мөлшерінің өлшем бірлігі Дж, кДж 882 Берілген реакциялардың ішіндегі экзотермиялық реакция - NaOH + HCl = NaCl + H2O + Q 883 Берілген реакциялардың ішіндегі эндотермиялық реакция - 2KNO3 = 2KNO2 + O2 - Q 884 Термохимиялық теңдеуді көрсетіңіз 4P + 5O2 = 2P2O5 + 3010 кДж 885 Термохимиялық теңдеу бойынша: 2Н2О = 2Н2 + О2 – 572 кДж, егер 286 кДж энергия жұмсалса, айырылған судың зат мөлшері 1 886 Термохимиялық теңдеу бойынша: 4Р + 5О2 = 2Р2О5 + 3010 кДж 62 г фосфорды жанғанда бөлінетін жылу мөлшері 1505 кДж 887 0,1 моль ацетилен жанғанда 130 кДж жылу бөлінді. Химиялық реакцияның жылу эффектісі 2600 кДж 888 Этиленнің жану реакциясының термохимиялық теңдеуі: С2Н4 + 3О2 = 2СО2 + 2Н2О + 1400 кДж, егер реакцияға 336 л оттегі кірісетін болса, бөлінген жылудың мөлшері 7000 кДж 889 1,2 г магний оттегінде жанғанда 30 кДж жылу бөлінді. Реакцияның жылу эффектісі 1200 кДж 890 Оттектен 2,24 л озон алу үшін 14,23 кДж жылу жұмсалды. Химиялық реакцияның жылу эффектісі 284,6 кДж 891 Мыс (II) оксидінің тұз қышқылымен реакциясының термохимиялық теңдеуі: CuO + 2HCl = CuCl2 + H2O + 63,3 кДж, 200 г мыс оксидін тұз қышқылында еріткенде бөлінетін жылудың мөлшері 160 кДж 892 5,6 г темір күкіртпен әрекеттескенде 9,53 кДж жылу бөлінді. Осы реакцияның жылу эффектісі 95,3 кДж 893 6,5 г мырышты жаққанда 34,8 кДж жылу бөлінсе, бұл реакцияның жылу эффектісі 696 кДж 894 Күкіртті жаққанда 32 г күкірт (IV) оксиді түзілді және 146,3 кДж жылу бөлінді. Реакцияның жылу эффектісін есептеңіз. 292,6 кДж 895 Химиялыќ реакцияныѕ жылдамдыєы деп уаќыт бірлігінде реагенттердіѕ немесе реакция ґнімініѕ біреуініѕ концентрацияларыныѕ ґзгеруін айтады. 896 Гетерогенді реакцияєа жатады 2Al + 3Cl2 ↔ 2AlCl3 897 Гетерогенді реакцияєа жатады: 4H2O + 3Fe = 4H2 + Fe3O4 898 Реакция жылдамдыєыныѕ јрекеттесуші заттардыѕ концентрациясына тјуелділігін кґрсететін заѕ Јрекеттесуші массалар заѕы. 899 Јрекеттесуші масса заѕы бойынша реакция жылдамдыєын ґрнектейді: 2SO2 + O2 ↔ 2SO3 υ = k[SO2]2[O2] 900 Јрекеттесуші заттарды майдалау осы реакцияныѕ жылдамдыєына јсер етеді CaCO3 + 2HCl = CaCl2 + CO2 + H2O 901 Гомогенді реакция жатады: 2CO + O2 =2CO2 902 Катализаторлар (ґршіткі) дегеніміз - реакция жылдамдыєын тездететін, біраќ реакция ґнімдерініѕ ќўрамына кірмейтін заттар 903 Ингибиторлар (тежегіштер) дегеніміз - реакция жылдамдыєын баяулататын заттар. 904 Егер реакцияныѕ температуралыќ коэффициенті 3-ке теѕ болса, температураны 1500С-дан 2000С-єа кґтергенде, реакцияныѕ жылдамдыєы ... артады 243 есе 905 C2H4 + 3O2 = 2CO2 + 2H2O реакциядаєы оттегініѕ концентрациясын 2 есе кґбейткенде реакция жылдамдыєы ... 8 есе артады 906 Јрекеттесуші масса заѕыныѕ математикалыќ ґрнектеуі: υ = kCACB 907 Егер реакцияныѕ температуралыќ коэффициенті 3-ке теѕ болса, температураны 300-ќа кґтергенде реакция жылдамдыєы ...артады. 27 есе 908 4Al + 3O2 = 2Al2O3 реакциядаєы оттегініѕ концентрациясын 3 есе кґбейткенде реакция жылдамдыєы... 27 есе артады 909 Егер температуралыќ коэффициент 2-ге теѕ болса, температураны 200-ќа кґтергенде реакция жылдамдыєы ... артады 4 есе 910 Температураны 200-ќа тґмендеткенде, реакция жылдамдыєы 16 есе кемісе, реакцияныѕ температуралыќ коэффициенті 4 911 Температураны 300-ќа кґтергенде, реакция жылдамдыєы 27 есе артты. Егер температураны 500-ќа кґтерсек, реакция жылдамдыєы ... артады 243 есе 912SO2 + O2 = 2SO3 реакциясындаєы кїкірт (IV) оксидініѕ концентрациясын 2 есе кґбейткенде реакция жылдамдыєы ... 4 есе артады 913 2NO + O2 = 2NO2 реакциясындаєы азот (II) оксидініѕ концентрациясын 4 есе кґбейткенде реакция жылдамдыєы ... 16 есе артады 914 500С температурада реакция 3 минут 20 секундта жїреді. Реакцияныѕ температуралыќ коэффициенті 3-ке теѕ. 300С-да бўл реакция ќанша уаќытта аяќталады? 30 минуттан соѕ 915 Егер А затыныѕ бастапќы концентрациясы 0,22 моль/л, ал 10 секундтан кейін 0,215 моль/л болса, А+В═2С реакциясыныѕ орташа жылдамдыєы (моль/л ·сек). 0,0005 916 Егер азоттыѕ концентрациясы 0,4-тен 0,1 моль/л-ге дейін ґзгерсе, 50 секундтан кейін N2 + O2 → 2NO гомогенді реакцияныѕ жылдамдыєы ќандай болатынын есептеѕіз (моль/л · сек). 0,006 917 Температураны 100С-єа арттырєанда химиялыќ реакцияныѕ жылдамдыєы 2 есе артады. Реакция жылдамдыєы 200С кезінде 0,04 моль/л·сає. мґлшеріне теѕ. Осы реакцияныѕ жылдамдыєы 400С кезінде болады 0,16 918 300С кезінде химиялыќ реакцияныѕ жылдамдыєы 0,01 моль/л·мин-ќа теѕ. Егер температураны 100С-єа кґтергенде, ол 3 есе артатын болса, осы реакцияныѕ жылдамдыєы 600С кезінде болады (моль/л·мин) 0,27 919 Температураны 400С-єа кґтергенде реакция жылдамдыєы 81 есе артты. Реакцияныѕ температуралыќ коэффициентін табыѕыз. 3 920 P2O5 + BaO → Ba3(PO4)2 теѕдеуіндегі коэффициенттер ќосындысы теѕ 5 921 Кальций гидроксиді јрекеттесетін зат: SO3 922 Натрий гидроксиді јрекеттесетін зат: HCl 923 Mn2O7 + Na2O → NaMnO4 теѕдеуіндегі коэффициенттердіѕ ќосындысы теѕ: 4 924 Натрийдіѕ генетикалыќ ќатарын ќўрайтын заттардыѕ реттік нґмірлерініѕ орналасуы: 1.H2SO3, 2.Na3PO4, 3.Ca, 4.P2O5, 5.Na, 6.Ca(OH)2, 7.NaOH, 8.CaO, 9.Na2O, 10.H3PO4. 5, 9, 7, 2 925 Фосфордыѕ генетикалыќ ќатарын ќўрайтын заттардыѕ реттік нґмірлерініѕ орналасуы: 1.H2SO4, 2.Na3PO4, 3.Ca, 4.P2O5, 5.Ca3(PO4)2, 6.H3PO4, 7.P, 8.NaOH, 9.CuO, 10.K2O 7, 4, 6, 2 926 Кальцийдіѕ генетикалыќ ќатарын ќўрайтын заттардыѕ реттік нґмірлерініѕ орналасуы: 1.H2SO4, 2.Na3PO4, 3.Ca, 4.P2O5, 5.Ca(OH)2, 6.NaOH, 7.CaO, 8.Na2O, 9.H3PO4, 10.Ca3(PO4)2. 3, 7, 5, 10 927 Берілген сызбанўсќадаєы А → А2О → АОН → А2SO4 А элементі , бўл - Na 928 Берілген сызбанўсќадаєы В → ВО2 → Н2ВО3 → К2ВО3 В элементі, бўл - S 929 CrCl3 → X → Cr2O3 тізбегіндегі Х затыныѕ молекулалыќ массасы: 103 930 Іс жїзінде жїретін реакцияныѕ сызбанўсќасы: Fe2O3 + HNO3 → 931 Ґзгерістер тізбегіндегі Х затыныѕ молекулалыќ массасы Zn → ZnSO4 → X → Na2[Zn(OH)4] 99 932 10 г натрий гидроксидін бейтараптау їшін ќажет кїкірт ќышќылыныѕ массасы (г): 12,25 933 40 г калий карбонатына тўз ќышќылыныѕ артыќ мґлшерімен јсер еткенде тїзілетін газдыѕ (ќ.ж.) кґлемі 6,49 л 934 168 г калий гидроксиді 63 г азот ќышќылымен јрекеттескенде тїзілетін тўздыѕ мґлшері (моль) 1 935 Берілген генетикалыќ ќатарда тўз тїзбейтін оксид ќатысатын сатысы 1 2 3 4 N2 → NO → NO2 → HNO3 → Mg(NO3)2 2 936 Ґзгерістер тізбегіндегі Э элементін аныќтаѕыз: Э → Э2О5 → Н3ЭО4 → Са3(ЭО4)2 Фосфор 937 Cu → A → CuSO4 → Б → CuO тізбегіндегі А жјне Б заттарыныѕ молекулалыќ массалары 80 жјне 98 |
