|
|
биохимия. биохимия кр. Кафедра Биохимии Дисциплина Биохимия человека Контрольная работа Факультет образовательных технологий адаптивной физической культуры Института афк курс 1 группа 113 Заочная форма обучения
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«НАЦИОНАЛЬНЫЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФИЗИЧЕСКОЙ КУЛЬТУРЫ, СПОРТА И ЗДОРОВЬЯ
ИМЕНИ П.Ф. ЛЕСГАФТА, САНКТ-ПЕТЕРБУРГ»
Кафедра: Биохимии
Дисциплина: Биохимия человека
Контрольная работа
Факультет образовательных технологий
адаптивной физической культуры
Института АФК
Курс 1 группа 113
Заочная форма обучения
Работу выполнила: Шташкявичус
Эльвира Алексеевна
Проверил:
Дата:
Количество баллов _____________
Санкт-Петербург
2022 г.
ВАРИАНТЫ КОНТРОЛЬНОЙ РАБОТЫ № 1
Содержание стр.
Вариант Ш, Щ.
1 Охарактеризовать амфотерность белков. Использование значения
изоэлектрической точки белка для оценки его строения и свойств…….. 3-4
2 Дать характеристику строению ферментов. Описать активный и
аллостерический центры…………………………………………………… 5-7
3 Описать распад гликогена в печени до глюкозы и указать гормоны,
ускоряющие этот процесс…………………………………………………... 8
4 Составить схему образования и использования АТФ…………………... 9-10
5 Описать строение и биологическую роль гормонов мозгового слоя
надпочечников……………………………………………………………..... 11
Список используемой литературы………………………………………..... 12
1 Охарактеризовать амфотерность белков. Использование значения
изоэлектрической точки белка для оценки его строения и свойств.
Амфотерность – способность некоторых химических веществ и соединений проявлять как кислотные, так и основные свойства.
Амфотерность белков обусловлена присутствием в их молекулах свободных карбоксильных групп (кислотные группы) и аминогрупп (основные группы). Эти группы входят в состав радикалов аминокислот. Проявление белками кислотных или основных свойств зависит от кислотности среды.
В кислой среде (рН < 7) вследствие избытка ионов водорода (протонов) диссоциация карбоксильных групп подавлена. Свободные аминогруппы легко присоединяют к себе избыточные протоны:
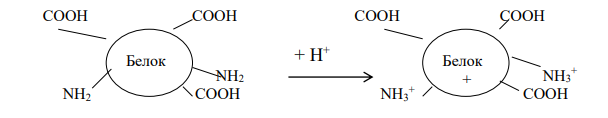
Таким образом, белки в кислой среде проявляют основные (щелочные) и находятся в катионной форме.
В щелочной среде (рН 7) преобладают ионы гидроксила (ОН- ), ионов водорода мало. В этих условиях легко протекает диссоциация карбоксильных групп:
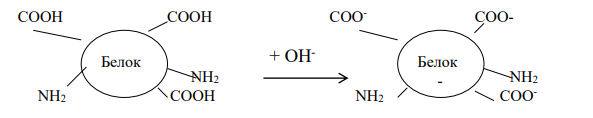
Поэтому в щелочной среде белки обладают кислотными свойствами и находятся в анионной форме.
Изоэлектрическая точка - значение рН, при котором молекулы белка нейтральны, и обозначается рI или рНиэт.
При определенной кислотности в молекуле белка может быть одинаковое количество диссоциированных карбоксильных групп (-СОО- ) и аминогрупп (-NH3 + ). Такая белковая молекула не имеет заряда.
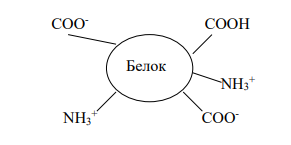
Значение рI зависит от соотношения в молекуле белка между аминокислотами, содержащими в радикале карбоксильную группу, и аминокислотами, содержащими в радикале аминогруппу. Если в белке преобладают аминокислоты с дополнительной карбоксильной группой, то значение изоэлектрической точки находится в кислой среде (рI 7). В случае преобладания аминокислот со свободными аминогруппами изоэлектрическая точка имеет величину больше 7, т.е. находится в щелочной среде.
По значению рI можно установить заряд белка, находящегося в растворе с известным рН. Если рН раствора больше величины изоэлектрической точки, молекулы белка имеют отрицательный заряд. В растворах, у которых рН меньше изоэлектрической точки растворенного белка, белковые молекулы заряжены положительно.
2 Дать характеристику строению ферментов. Описать активный и
аллостерический центры.
Ферменты (энзимы) – особые белки, которые выполняют функцию катализаторов.
  Ферменты Ферменты
Простые Сложные
(состоят только из белка) (Состоят из двух компонентов)
  Все центры образованны Все центры образованны
функциональными группами. Белковая часть Небелковая часть
(-NH2, -COOH, -OH, -SH.) (Апофермент) (Кофермент)
Катионы металлов.
Витамины (В1, В2, В3) [3. Стр 5]
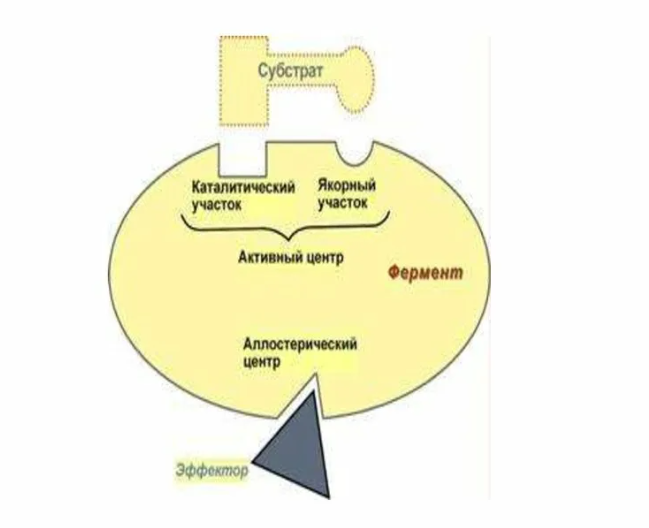
Активный центр - участок молекулы фермента, на котором происходит катализ. Если фермент по строению является простым белком, то его активный центр формируется только остатками аминокислот. Активный центр образуется на уровне третичной структуры белка-фермента, позволяет ферменту обеспечивать необходимое соответствие между активным центром и молекулами реагирующих веществ (их обычно называют субстратами).
В активном центре обычно выделяют два участка:
  Активный центр. Активный центр.
адсорбционный участок каталитический участок
(центр связывания) (ферментативная реакция)
Аллостерический центр – регулирует активность фермента. Отвечает за присоединение активаторов и ингибиторов.
Ингибиторы - это химические соединения (обычно низкомолекулярные), которые, находясь в низких концентрациях, избирательно тормозят определенные ферментативные реакции. Фермент, связанный с ингибитором, теряет свою каталитическую активность.
Если связи между ферментом и ингибитором прочные, то действие ингибитора носит необратимый характер, и торможение нарастает во времени вплоть до полного прекращения ферментативной реакции:
 E + I EI E + I EI
Фермент Ингибитор
Такие ингибиторы называются необратимыми.
Если ингибитор присоединяется к ферменту за счет непрочных связей, то торможение фермента является обратимым и не зависит от времени:
  E + I EI E + I EI
Ингибиторы такого типа называются обратимыми. В свою очередь, обратимые ингибиторы делятся на две разновидности: конкурентные и неконкурентные.
Конкурентные ингибиторы присоединяются к активному центру фермента, т.е. к тому же участку поверхности фермента, что и субстрат. Поэтому между ингибитором и субстратом идет конкуренция за присоединение к активному центру.
Неконкурентные ингибиторы присоединяются к ферменту вне активного центра (присоединяются в аллостерический центр).
Активаторы - вещества, избирательно повышающие скорость определенных ферментативных реакций. Активаторы, подобно неконкурентным ингибиторам, присоединяются обратимо к аллостерическому центру фермента. Но в этом случае изменение конформации фермента будет благоприятным для функционирования активного центра, что приводит в итоге к повышению скорости ферментативной реакции.
Активаторы и неконкурентные ингибиторы можно назвать эффекторами.
Строение фермента.
3 Описать распад гликогена в печени до глюкозы и указать гормоны,
ускоряющие этот процесс.
Распад гликогена в печени до глюкозы обозначается термином –глюкогенез.
Между приемами пищи гликоген печени расщепляется и превращается в глюкозу, которая выходит в кровь. Этот распад идет с участием фосфорной кислоты и называется фосфоролизом. Под действием фосфорной кислоты от наружных цепей гликогена поочередно отщепляются остатки глюкозы в форме глюкозо-1-фосфата. Полностью гликоген не расщепляется. Оставшиеся небольшие молекулы гликогена служат в дальнейшем «затравкой» при его синтезе.
 (С6Н10О5)n + m Н3РО4 (С6Н10О5)n-m + m Гл-1-ф (С6Н10О5)n + m Н3РО4 (С6Н10О5)n-m + m Гл-1-ф
Исходный гликоген Гликоген-«затравка»
Превращение глюкозо-1-фосфата в свободную глюкозу осуществляется в две стадии:
1.Стадия: глюкозо-1-фосфат переходит в глюкозо-6-фосфат.
2.Стадия: происходит гидролиз глюкозо6-фосфата и образуется свободная глюкоза и фосфорная кислота:
+Н2О
  Гл-1-ф Гл-6-ф Глюкоза + Н3РО4 Гл-1-ф Гл-6-ф Глюкоза + Н3РО4
Распад гликогена в печени ускоряется гормонами глюкагоном и адреналином.
В печени протекают два противоположных процесса: синтеза гликогена из глюкозы и его распад снова на глюкозу, её концентрация в крови изменяется только в небольшом диапазоне, и поэтому кровь постоянно снабжает все органы глюкозой.
4 Составить схему образования и использования АТФ.
АТФ - Аденозинтрифосфат или Аденозинтрифосфорная кислота. Является нуклеотидом.Универсальный источник энергии для всех биохимических процессов, протекающих в живых системах, в частности для образования ферментов.
Состав: аденин (азотистое основание), углевод – рибоза (моносахарид), три остатка фосфорной кислоты.
Аденин + рибоза = аденозин.
Второй и третий остатки фосфорной кислоты присоединяются связью, богатой энергией. Такая связь называется высокоэнергетической или макроэргической и обозначается знаком .
Аденозин – Ф.К.
Ф.К.
Ф.К.
Тканевое дыхание - это основной способ получения АТФ, используемый всеми клетками организма (кроме красных клеток крови - эритроцитов). Образование АТФ в процессе тканевого дыхания часто обозначается терминами: окислительное фосфорилирование, дыхательное фосфорилирование, аэробный синтез АТФ.
В процессе тканевого дыхания от окисляемого вещества отнимаются два атома водорода (два протона и два электрона) и по дыхательной цепи, состоящей из ферментов и коферментов, передаются на молекулярный кислород - О2, доставляемый кровью из воздуха во все ткани организма. В результате присоединения атомов водорода к кислороду образуется вода. За счет энергии, выделяющейся при движении электронов по дыхательной цепи, в митохондриях осуществляется синтез АТФ из АДФ и фосфорной кислоты. Обычно образование одной молекулы воды сопровождается синтезом трех молекул АТФ.
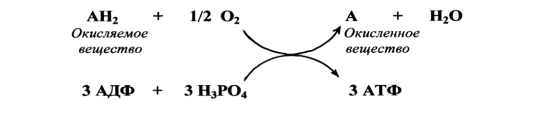
Упрощенный вид тканевого дыхания.
В качестве субстратов окисления (т.е. веществ, от которых отнимается водород) в тканевом дыхании используются разнообразные промежуточные продукты распада белков, углеводов и жиров. Однако, наиболее часто окислению подвергаются промежуточные продукты цикла трикарбоновых кислот (ЦТК) - цикла Кребса (изолимонная, -кетоглутаровая, янтарная и яблочная кислоты).
При использовании АТФ в качестве источника энергии обычно происходит отщепление путем гидролиза последнего остатка фосфорной кислоты:
АТФ + Н2О АДФ + Н3РО4 + Q (энергия)
5 Описать строение и биологическую роль гормонов мозгового слоя
надпочечников.
Надпочечник относятся к железам внутренней секреции (гормоны поступают прямо в кровь, выводящих протоков нет). По химическому строению гормоны мозгового слоя надпочечников можно отнести к производным аминокислот тирозина. Надпочечники продуцируют катехоламины (главный гормон адреналин).
В клетках органов, в которых реализуется действие гормонов («органы-мишени»), имеются особые белки, называемые рецепторами гормонов. Эти белки обладают способностью специфически связываться только с определенными гормонами, и поэтому органы-мишени избирательно извлекают из протекающей крови лишь те гормоны, которые необходимы данному органу для регуляции в нем обмена веществ.
Рецепторные белки находятся либо внутри клеток, либо встроены в клеточную мембрану.
Аденилатциклаза - встроенный в клеточную мембрану мембраносвязанный фермент (для гормона адреналина и глюкагона).
Строение надпочечников.
Расположены они в забрюшинном пространстве в области поясницы, и представляют собой небольшие «шапочки» над почками. Снаружи железы покрыты капсулой из соединительной ткани. Взглянув на железу в разрезе, можно обнаружить в ней два слоя. Первый располагается на периферии органа и называется корковым веществом. В центральной области железы находится мозговое вещество.
Мозговой слой, расположенный в центре надпочечников, состоит из хромаффинных клеток. Несмотря на малую долю в общем объёме желёз, именно клетками мозгового слоя продуцируются катехоламины (производные аминокислот тирозина) – адреналин и норадреналин – которые управляют работой организма в условиях стресса.
Биологическая роль мозгового слоя надпочечников заключается в: ускорении распада гликогена в печени и в мышцах (под влиянием симпатической нервной системы стимулируется выработка альфа-клетками поджелудочной железы глюкагона, который активирует распад гликогена печени, и приводит к повышению уровня глюкозы в крови);
мобилизации жира;
повышение частоты дыхания и сердечных сокращений (артериальное давление и пульс).
Список используемой литературы.
Лекции по Биохимии человека 1 курс
http://do.lesgaft.spb.ru/course/view.php?id=30
Михайлов С.С. «Спортивная Биохимия» Москва 2004 г.
https://uchi-fitness.ru/upload/iblock/2e2/2e2b3a3aff219e1f223f260fece37bca.pdf
Артемук Елена Георгиевна, Королько Александр Владимирович.
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ «БРЕСТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ А.С. ПУШКИНА». Кафедра химии. «ФЕРМЕНТЫ» Брест 2010 г.
https://www.brsu.by/sites/default/files/e_editions/fer.pdf |
|
|
 Скачать 251.33 Kb.
Скачать 251.33 Kb.
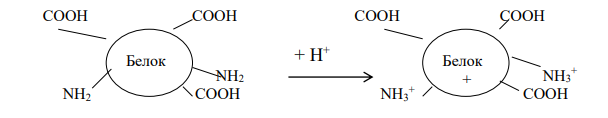
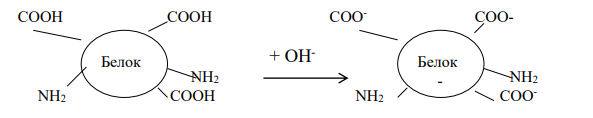

 Ферменты
Ферменты
 Все центры образованны
Все центры образованны 
 Активный центр.
Активный центр. E + I EI
E + I EI E + I EI
E + I EI
 (С6Н10О5)n + m Н3РО4 (С6Н10О5)n-m + m Гл-1-ф
(С6Н10О5)n + m Н3РО4 (С6Н10О5)n-m + m Гл-1-ф 

