энтеробактерии. Кафедра генетики, микробиологии и биотехнологии курсовая работа 1 устойчивость к антибиотикам энтеробактерий
 Скачать 112.18 Kb. Скачать 112.18 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» (ФГБОУ ВПО «КубГУ») Кафедра генетики, микробиологии и биотехнологии КУРСОВАЯ РАБОТА № 1 УСТОЙЧИВОСТЬ К АНТИБИОТИКАМ ЭНТЕРОБАКТЕРИЙ Работу выполнила _____________________________________В. В. Касьяненко Факультет биологический курс 3 Специальность 020400.62 Биология Научный руководитель, канд.биол.наук,доц.__________________Э. В. Карасева Нормоконтролёр, канд. биол.наук, доц._______________________Г.Г. Вяткина Краснодар 2014 СОДЕРЖАНИЕ Определения, обозначения и сокращения……………………………………….....3 Введение.......................................................................................................................4 1 Определения и терминология..................................................................................5 2 Причины развития антибиотикорезистентности...................................................6 3 Механизмы устойчивости к антибиотикам............................................................7 3.1 Основные биохимические механизмы антибиотикорезистентности......................................................................................8 4 Природа и идентификация плазмид резистентности.........................................10 5 Способы передачи антибиотикорезистентности................................................11 6 Бета-лактамазы.......................................................................................................12 6.1 Особенности бета-лактамаз.........................................................................13 6.2 Классификация и происхождение бета-лактамаз......................................14 6.3 Механизм действия бета-лактамаз..............................................................15 6.4 Ингибиторы бета-лактамаз..........................................................................16 7 Решение проблемы бета-лактамазной резистентности......................................17 8 Методы определения чувствительности к антибиотикам..................18 8.1 Диско-диффузионный метод........................................................................18 8.2 Метод серийных разведений антибиотиков...............................................19 9 Последствия антибиотикорезистентности микроорганизмов............................21 10 Пути решения проблемы устойчивости к антибиотикам.................................23 Заключение.................................................................................................................25 Библиографический список......................................................................................26 ОПРЕДЕЛЕНИЯ, ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ АБП – антибактериальные препараты МПК – минимальная подавляющая концентрация АБР – антибактериальная резистентность АМР – антимикробная резистентность БЛРС – бета-лактамазы расширенного спектра БЛА – бета-лактамные антибиотики ВВЕДЕНИЕ Повышение антибиотикорезистентности микроорганизмов является одной из актуальных и нерешенных проблем борьбы с патогенными микроорганизмами. Рост резистентности микроорганизмов к антибиотикам впервые был обнаружен в медицине, позже – в ветеринарии, а затем это явление было установлено и для других антимикробных веществ. В начале проблему пытались решить путем поиска и синтеза новых антимикробных препаратов, однако в настоящее время стало ясно, что микроорганизмы адаптируются к ним быстрее, чем открываются новые антимикробные вещества: в лабораторных условиях им достаточно несколько недель для адаптации к новому антимикробному препарату. В реальных условиях полная адаптация к новым антибиотикам наблюдается в течение 5 лет, частичная – в течение года и ранее. В этой связи человечество проигрывает в борьбе с микроорганизмами [Сидоренко, 2003]. Вспышки инфекций, связанные с заражением устойчивыми к лекарственным препаратам микроорганизмами, становятся все более важной проблемой как в развивающихся, так и в промышленно развитых странах. Эта проблема стала еще более рельефной из-за недавности распространения вспышек энтеритов, вызванных устойчивыми к лекарственным препаратам микробами. Запоздалое выявление резистентности у возбудителей привело в ряде случаев к ненужным страданиям и даже гибели больных. Не менее серьезную проблему представляют собой внутрибольничные инфекции, вызываемые устойчивыми к лекарственным препаратам микробами-оппортунистами кишечного происхождения, которые попадают в кровяное русло, обсеменяют хирургические раны, мочеполовой тракт и другие ткани, особенно у ослабленных больных. Эта проблема носит глобальный характер и является результатом распространения и неупорядоченного использования антимикробных препаратов при лечении животных и человека [Эпидемиологический надзор…, 1980] 1 Определения и терминология Резистентность у микроорганизмов — полная или частичная невосприимчивость к противомикробным препаратам, в частности, к бета-лактамным антибиотикам, фторхинолонам и т. д. Может достигаться биосинтезом в бактериях ферментов, инактивирующих лекарственный препарат, либо изменением структуры соединений, атакуемых антибиотиком, таким, чтобы бактерия могла продолжать жизнедеятельность в присутствии антимикробного препарата. Примером первого способа является синтез бета-лактамаз, разлагающих антибиотики семейства пенициллинов и других бета-лактамных антибиотиков. Вторым способом защищается от лекарств метициллинрезистентный золотистый стафилококк. У такого стафилококка изменяется структура белка PBP2a, с которым связываются антибиотики пенициллинового ряда. Стафилококк с измененной структурой белка становится β-лактам-резистентным, то есть устойчивым к воздействию бета-лактамных антибиотиков [Tenover, 1996]. Резистентность микроорганизмов к антибиотикам может быть истинной и приобретенной. Истинная (природная) устойчивость характеризуется отсутствием у микроорганизмов мишени действия антибиотика или недоступностью мишени вследствие первично низкой проницаемости или ферментативной инактивации. При наличии у бактерий природной устойчивости антибиотики клинически не эффективны. Под приобретенной устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции. Появление у бактерий приобретенной резистентности не обязательно сопровождается снижением клинической эффективности антибиотика. Формирование резистентности во всех случаях обусловлено генетически – приобретением новой генетической информации или изменением уровня экспрессии собственных генов [Волосовец, Кривопустов, Юлиш, 2007]. 2 Причины развития антибиотикорезистентности Наиболее частой причиной приобретенной резистентности является широкое применение того или иного антибиотика, а следствием этого становится то, что ранее чувствительные штаммы становятся резистентными. Бета-лактамные антибиотики – пенициллины, цефалоспорины дольше всех применяются в клинической практике, поэтому проблема резистентности к ним наиболее серьезна [Василевский, 2008]. Долгое время считалось, что широкое распространение устойчивости бактерий к антибиотикам характерно, в основном, для возбудителей внутрибольничных инфекций. Однако в настоящее время и среди возбудителей внебольничных инфекций устойчивость к антибиотикам приобретает все большее практическое значение. Применение десятилетиями у амбулаторных больных одних и тех же противомикробных средств привело в последние годы к нарастанию числа микробных штаммов, устойчивых к пенициллину, ампициллину, эритромицину, линкомицину, ко-тримоксазолу [Страчунский, Бойко, Блохин, 1997]. Причины развития устойчивости микроорганизмов к антибиотикам многообразны, среди них значительное место занимают нерациональность и ошибочность применения препаратов. Рассмотрим наиболее встречающиеся причины: – необоснованное назначение АБП; – ошибки в выборе АБП; – ошибки в выборе режима дозирования АБП; – ошибки комбинированного назначения антибиотиков; – ошибки, связанные с длительностью антибактериальной терапии [Волосовец, Кривопустов, Юлиш, 2007]. 3 Механизмы устойчивости к антибиотикам Генетический аппарат бактерий весьма прост — одна-единственная хромосома, содержащая около 3 тыс. генов, и плазмиды, включающие не более 200 генов, чрезвычайно мобильные ДНК-молекулы. Именно эти гены, присутствующие в них, и позволяют бактериям выживать в экстремальных условиях. Многие из них, включая гены атибиотикорезистентности, являясь транспозонами, легко перемещаются из плазмиды в плазмиду или в хромосому, что обеспечивает их быстрое распространение внутри популяций, видов и даже между различными видами бактерий. За время своего существования бактерии выработали природную и приобретенную устойчивость к антибиотикам. Природная, или первичная, резистентность закодирована в хромосомных генах и имеет место изначально, еще до «встречи» с антибиотиком. Пример тому — природная устойчивость Mycoplasmа spp. к лактамам. Приобретенная, или вторичная, резистентность обусловлена либо спонтанными мутациями, либо «приобретением» генов устойчивости, переносимых транспозонами или плазмидами [Резистентность микроорганизмов…, 2007]. Основные механизмы резистентности представлены на рис.1, из которого следует, что развитие устойчивости к антибиотикам протекает различными путями в зависимости от типа антибиотика. 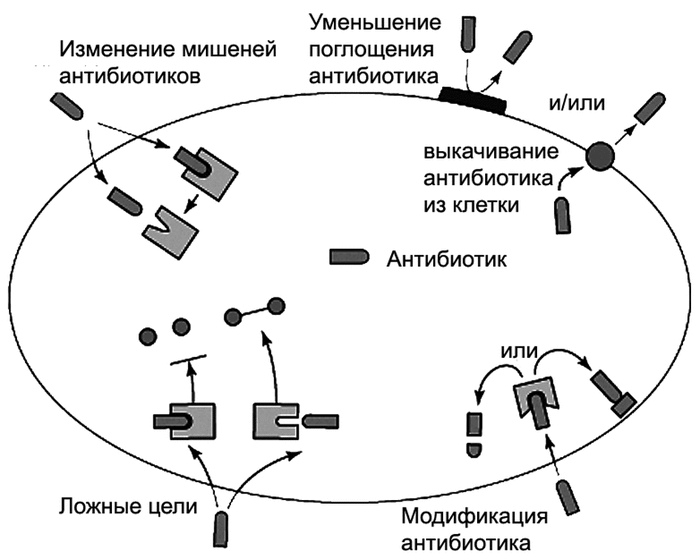 Рисунок 1 – Основные механизмы резистентности к антибактериальным препаратам у бактерий [Супотницкий, 2011]. 3.1 Основные биохимические механизмы антибактериальной резистентности (АБР) – Модификация мишени действия АБП (точки приложения антибиотика). – Ферментативное расщепление (инактивация) АБП. – Активное выведение АБП из микробной клетки (эффлюкс). – Нарушение проницаемости внешних структур микробной клетки. – Ауксотрофия (формирование метаболического шунта) [Сидоренко, Тишков, 2004]. Самым распространенным механизмом антибиотикорезистентности — около 80% всех случаев — является ферментативное расщепление антибиотика. Ферменты, разрушающие бета-лактамные антибиотики, получили название бета-лактамаз. Некоторые микроорганизмы выделяют бета-лактамазы во внеклеточное пространство, другие - только в периплазматическое пространство между клеточной стенкой и внутренней мембраной. Следует подчеркнуть, что в настоящее время штаммы, продуцирующие бета-лактамазы, обнаружены как среди грамположительных, так и среди грамотрицательных микроорганизмов, в том числе и анаэробных [Вильямс, 1997]. Эти ферменты разрушают амидную связь в β-лактамном кольце β-лактамных антибиотиков, что в клинике проявляется как отсутствие результата действия антибиотиков, т.е. результата лечения. β-лактамазы переносятся на хромосомах и плазмидах, они могут значительно различаться между собой и классифицируются в зависимости от своего влияния на специфические пенициллины или цефалоспорины [Ключарева, Голобородько, Оскирко, 2003]. 4 Природа и идентификация плазмид резистентности Подобно бактериальной хромосоме плазмиды резистентности состоят из кольцевых молекул ДНК, размер которых составляет около 1-5% размера хромосомной ДНК. Передаваемые плазмиды резистентности (R- факторы) состоят их двух различных частей, одна из которых кодирует лекарственную устойчивость, а другая – ее передачу. Эти части могут быть связаны, образуя единую молекулу, которая передается интактной бактерии-реципиенту. Передача устойчивости среди грамотрицательных бактерий осуществляется путем конъюгации. Энтеробактерии обладают многочисленными плазмидами передачи устойчивости, которые могут быть классифицированы в соответствии с их способностью стабильно существовать в бактериальной клетке. Плазмиды резистентности были обнаружены у всех родов энтеробактерий:Escherichia, Salmonella, Shigella, Klebsiella, Enterobacter, Citrobacter, Serratia, Proteus, Providencia, Yersinia. Передача устойчивости происходит in vivo в кишечнике, а также вне организма человека животного, вероятно в сточных и других сильно загрязненных поверхностных водах [Эпидемиологический надзор…, 1980]. Бактериальные плазмиды, связанные с переносом маркеров лекарственной устойчивости в процессе конъюгации клеток, получили название R-факторов. Плазмиды резистентности R (конъюгирующие) состоят из двух компонентов — фактора переноса устойчивости RTF, обеспечивающего передачу генетической информации, и r-фактора, отвечающего за резистентность к антибиотикам. В отдельных случаях r-факторы (неконъюгирующие плазмиды) существуют в бактериальных клетках самостоятельно. Межбактериальный перенос таких r-факторов может осуществляться посредством их мобилизации и коинтеграции с конъюгирующими плазмидами. R-фактор одновременно может содержать 1-10 и более детерминант устойчивости к различным антибактериальным соединениям [Сидоренко, 2003]. 5 Способы передачи антибиотикорезистентности В основе формирования и передачи антибиотикорезистентности лежат сложные механизмы. Антибиотикорезистентность может передаваться плазмидами (дополнительные молекулы ДНК микроорганизма), хромосомами тремя путями: – Трансформация: ДНК погибшей антибиотикорезистентной бактерии захватывается из окружающей среды антибиотикочувствительной клеткой. – Трансдукция: случайный захват бактериальной ДНК частичкой бактериофага, при этом ДНК может быть как хромосомной, так и плазмидной. Далее частичка фага переносит бактериальную ДНК в следующую клетку, которую она инфицирует. – Конъюгация, представляющая собой физический контакт двух бактерий, во время которого происходит передача ДНК от клетки-донора к клетке-реципиенту [Голубовская, 2011]. Резистентными к антибиотикам могут стать также непатогенные микроорганизмы, контактирующие с ними, которые далее, попадая из организма человека в окружающую среду, могут становиться переносчиками генов резистентности. Так, грамотрицательные неферментирующие бактерии Acinetobacter spp., Stenotrophomonas maltophilia, Burkholderia cepacia (ранее благодаря ряду общих свойств входящие в род Pseudomonas spp.) долгое время являлись комменсалами или патогенами растений (Burkholderia cepacia) и могли существовать в любой экологической нише — в почве, воде, организме животных и растений. Однако в настоящее время они являются одними из ведущих возбудителей нозокомиальных инфекций, оказывающих влияние на летальность и потребление ресурсов [Скибина, Конь, 2012]. 6 Бета-лактамазы Бета-лактамные антибиотики (β-лактамные антибиотики, β-лактамы) - группа антибиотиков, которые объединяет наличие в структуре β-лактамного кольца. К бета-лактамам относятся подгруппы пенициллинов, цефалоспоринов, карбапенемов и монобактамов. Сходство химической структуры предопределяет одинаковый механизм действия всех β-лактамов (нарушение синтеза клеточной стенки бактерий), а также перекрёстную аллергию к ним у некоторых пациентов. Пенициллины, цефалоспорины и монобактамы чувствительны к гидролизующему действию особых ферментов - β-лактамаз, вырабатываемых рядом бактерий. Карбапенемы характеризуются значительно более высокой устойчивостью к β-лактамазам. С учётом высокой клинической эффективности и низкой токсичности β-лактамные антибиотики составляют основу антимикробной химиотерапии на современном этапе, занимая ведущее место при лечении большинства инфекций [Егоров, 1986]. Вырабатывать бета-лактамазы способны многие виды микроорганизмов, но клинически это наиболее актуально для стафилококков и ряда грамотрицательных бактерий, в частности, Escherichia coli и Klebsiella spp., которые продуцируют БЛРС, способные инактивировать цефалоспорины всех поколений и легко передающиеся другим штаммам [Ингибиторозащищенные бета-лактамы…, 2005]. Бета-лактамные антибиотики (БЛА) являются основой современной химиотерапии, так как занимают ведущее или важное место в лечении большинства инфекционных болезней. По количеству применяемых в клинике препаратов - это наиболее многочисленная группа среди всех антибактериальных средств. Их многообразие объясняется стремлением получить новые соединения с более широким спектром антибактериальной активности, улучшенными фармакокинетическими характеристиками и устойчивостью к постоянно возникающим новым механизмам резистентности микроорганизмов [Гаузе, 1975]. 6.1 Особенности бета-лактамаз Тема бета-лактамаз, продуцируемых многими часто встречающимися возбудителями распространенных инфекций, заслуживает особого внимания по ряду причин. – Эти ферменты являются основным фактором устойчивости ко многим, а в некоторых случаях ко всем бета-лактамным антибиотикам, т. е. к пенициллинам, цефалоспоринам, монобактамам, карбапенемам, большинства грамотрицательных бактерий. – Продуцентами бета-лактамаз, способных инактивировать бета-лактамные антибиотики, являются эшерихии, протеи, клебсиеллы и другие представители семейства Enterobacteriaceae. – Образование бактериями бета-лактамаз значительно ограничивает или, что более правильно и более часто, исключает возможность использования этих антибиотиков для лечения инфекций. При этом круг перспективных лечебных препаратов, эффективных и безопасных, резко, порой катастрофически сужается. – Способность грамотрицательных бактерий «приспосабливаться» к селективному давлению антибиотиков оказалась значительной, в том числе путем синтеза ими бета-лактамаз новой структуры и иного спектра действия. – Синтез бета-лактамаз грамотрицательными бактериями и возникшая в этой связи их устойчивость к бета-лактамным антибиотикам очень часто не может быть определена традиционными, привычными для лабораторной службы клинических учреждений т. н. фенотипическими методами, а, попросту говоря, методом дисков и методом серийных разведений. Нужны специальные методы. Они есть, но далеко не все из них достаточно стандартизованы и в большинстве случаев не получили формального признания, не «узаконены». – Наконец, есть еще одна проблема, которая, казалось бы, не связана напрямую с продукцией бета-лактамаз, но имеющая прямое отношение к логике антибиотикотерапии больных, возбудитель которых является продуцентом этих ферментов. Синтез грамотрицательными бактериями бета- лактамаз достаточно часто, в силу особенностей генетического кодирования ферментообразования, является отражением полирезистентности микроба к широкому кругу антимикробных препаратов, в том числе не бета-лактамной структуры [Поляк, 2012]. 6.2 Классификация и происхождение β-лактамаз Все известные в настоящее время бета-лактамазы делят на 4 молекулярных класса, в пределах которых ферменты характеризуются общностью свойств и определенной аминокислотной гомологией. Бета-лактамазы классов А, С и D относятся к ферментам «серинового» типа (по аминокислоте, находящейся в активном центре фермента). Ферменты класса В относятся к металлоэнзимам, поскольку в качестве ко-фермента в них присутствует атом цинка. В соответствии с современными представлениями считается, что бета-лактамазы и пенициллинсвязывающие белки (ПСБ),являющиеся мишенями действия беталактамных антибиотиков, имеют общего предшественника. В процессе эволюции ферменты, осуществляющие синтез пептидогликана и разрушающие беталактамные антибиотики, выделились в самостоятельные группы [Характеристика и клиническое значение…, 2003]. Важнейшими свойствами β-лактамаз, определяющими их разнообразие, являются:
Перечисленные функциональные особенности послужили основой создания различных систем классификации β-лактамаз. Актуальность дифференциации ферментов, предпочтительно гидролизующих пенициллины (пенициллиназ) или цефалоспорины (цефалоспориназ), впервые отметили P.С. Fleming и соавт. в 1963 г. Система классификации, предложенная T. Sawai и соавт. в 1968 г., предусматривала использование иммунных сывороток в качестве дополнительного критерия дифференциации пенициллиназ, цефалоспориназ и ферментов с широким субстратным спектром [Эйдельштейн, 2001]. 6.3 Механизм действия бета-лактамаз Обязательным компонентом наружной мембраны прокариотических микроорганизмов (кроме микоплазм) является пептидогликан, представляющий собой биологический полимер, состоящий из параллельных полисахаридных цепей. Пептидогликановый каркас приобретает жесткость при образовании между полисахаридными цепями поперечных сшивок. Поперечные сшивки образуются через аминокислотные мостики, замыкание сшивок осуществляют ферменты карбокси- и транспептидазы (ПСБ). Бета-лактамные антибиотики способны связываться с активным центром фермента и подавлять его функцию. Специфическая активность антибиотиков определяется наличием бета-лактамного кольца. Боковые радикалы определяют фармакокинетические особенности, устойчивость к действию бета-лактамаз и другие второстепенные свойства [Сидоренко, Яковлев, 1997]. Бета-лактамазные ферменты разрушают бета-лактамное кольцо двумя основными механизмами. Первый механизм, присущий лактамазам классов А, С и D (деление на классы проводится в зависимости от последовательности аминокислот в структуре фермента), заключается в связывании с субстратом благодаря наличию специального гибкого активного участка. Происходит необратимое связывание с углеродом карбонильной группы бета-лактамного кольца и нарушение его целостности, что переводит антибиотик в неактивное состояние и попутно обеспечивает регенерацию бета-лактамазы. Эти классы бета-лактамаз активны в отношении многих пенициллинов, цефалоспоринов и монобактамов. Второй механизм присущ менее распространенной группе бета-лактамаз, которые относятся к классу В. Ферменты этого класса называются также металло-бета-лактамазами, поскольку содержат подвижный двухвалентный ион металла, чаще всего ион цинка, который способен связываться с карбонильной группой большинства пенициллинов, цефалоспоринов и карбапенемов, но не монобактамов [Богун, 2007]. 6.4. Ингибиторы бета-лактамаз Широко используемыми ингибиторами β-лактамаз являются: – клавулановая кислота – пенициллановые кислоты – сульбактам (сульфон пенициллановой кислоты) – 6 - хлорпенициллановая кислота – 6 - бромпенициллановая кислота – 6 - ацетилпенициллановая кислота Различают два типа ингибиторов бета-лактамаз. К первой группе относят антибиотики, стабильные к действию ферментов. Такие антибиотики помимо антибактериальной активности обладают ингибиторными свойствами на бета-лактамазы, проявляющиеся при высокой концентрации антибиотиков. К ним относят метициллин, изоксазолилпенициллины, моноциклические бета-лактамы типа карбапенема. Вторую группу составляют ингибиторы бета-лактамаз, проявляющие в низких концентрациях ингибиторную активность, а в высоких обладающие антибактериальными свойствами. Примером может служить клавулановая кислота, сульбактам [Белоусов, Моисеев, Лепахин, 2006]. 7 Решение проблемы бета-лактамазной резистентности Большинство штаммов бактерий способно продуцировать β-лактамазы нескольких типов. Имеется несколько вариантов решения проблемы β-лактамазной резистентности: – Поиск новых β-лактамных антибиотиков, которые не подвержены гидролизу под действием β-лактамаз (новые цефалоспорины, монобактамы, тиенамицины) [Козлов, Веселов, 2006]. – Синтез бета–лактамазоустойчивых антибиотиков. Примерами являются оксациллин, цефазолин (устойчивы к эффекту стафилококковых “пенициллиназ”), цефалоспорины III–IV поколений (устойчивы к бета–лактамазам широкого спектра грамотрицательных бактерий) и, конечно, карбапенемы, активные в отношении бета–лактамазопродуцирующих штаммов большинства актуальных патогенов; – Использование комбинаций антибиотиков с ингибиторами бета–лактамаз, которые призваны повысить (восстановить) активность антибиотиков в отношении бактерий, вырабатывающих гидролизующие энзимы [Карпов, 2005]. Многообразие β-лактамаз, их широкое распространение среди грамотрицательных бактериальных возбудителей инфекций и одновременно ведущая роль в формировании устойчивости к β-лактамным антибиотикам диктуют необходимость всестороннего изучения и внедрения в широкую практику надежных и максимально стандартизованных методов их диагностики. В частности, важное практическое значение имеет использование клинико-диагностическими лабораториями чувствительных хромогенных тестов для выявления продукции β-лактамаз у госпитальных штаммов энтеробактерий. Успех в решении этой задачи в значительной степени определяется возможностью комплексного использования современных фенотипических и молекулярно-генетических методов исследования [Эйдельштейн, 2001]. 8 Методы определения чувствительности к антибиотикам Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы: диффузионные и методы разведения. 8.1 Диско-диффузионный метод Определение чувствительности микроорганизмов к антибиотикам с помощью дисков является наиболее простым, удобным и широко используемым методом при рутинном микробиологическом исследовании чувствительности обычных быстрорастущих и некоторых "привередливых" микроорганизмов. Однако необходимо помнить, что на результаты определения чувствительности могут влиять многие факторы, такие, как состав, pH, толщина и равномерность слоя питательной среды, содержание в ней ионов Сa2+ и Mg2+, плотность инокулюма, возраст культуры, скорость роста микроорганизма, условия инкубации (температура, атмосфера), скорость диффузии антибиотика в агар и т.д. Поэтому эта методика требует использования определенного агара, неукоснительного соблюдения правил его приготовления, обязательной стандартизации инокулюма, строгого соблюдения условий инокуляции и инкубации чашек, правильного и регулярного проведения процедур по контролю качества [Стецюк, Решедько, Рябкова, 1999]. При определении чувствительности диско-диффузионным методом на поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности (обычно эквивалентную стандарту мутности 0,5 по McFarland) и затем помещают диски, содержащие определенное количество антибиотика. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков. После инкубации чашек в термостате при температуре 35о-37оС в течение ночи учитывают результат путем измерения диаметра зоны вокруг диска в миллиметрах. Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной. В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК) [Решедько, 1999]. На основании полученных диаметров зон подавления роста микроорганизма вокруг дисков с антибиотиками тестируемые штаммы подразделяют на чувствительные, умеренно резистентные и резистентные. Для разграничения этих трех категорий чувствительности (или резистентности) между собой используют так называемые пограничные значения (breakpoints) диаметров зон подавления роста микроорганизмов. Пограничные значения не являются неизменными величинами. Они могут пересматриваться с течением времени в зависимости от получения новых данных о механизмах антибиотикорезистентности. Следует отметить, что диаметры зон подавления роста микроорганизмов вокруг дисков с антибиотиками в определенных пределах обратно пропорциональны концентрации антибиотиков, подавляющей рост бактерий. Таким образом, размер зоны подавления роста позволяет косвенно судить о концентрации антибиотика, подавляющей рост данного штамма микроорганизма [Решедько, Стецюк, 2001]. Однако диско-диффузионный метод позволяет лишь косвенно судить о величине МПК, а результатом исследования является отнесение микроорганизма к одной из категорий чувствительности (чувствительный, промежуточный или резистентный) [Определение чувствительности…, 2004]. 8.2 Метод серийных разведений антибиотиков Методы серийных разведений основаны на прямом определении основного количественного показателя, характеризующего микробиологическую активность АБП - величины его минимальной подавляющей концентрации (МПК). В зависимости от характера используемой питательной среды различают методы серийных разведений в агаре или в бульоне. В зависимости от объема используемой жидкой питательной среды выделяют методы серийных макро- и микроразведений. Разновидностью метода серийных разведений является также метод, основанный на использовании только двух концентраций АБП, соответствующих пограничным значениям МПК. Этот принцип исследования широко используется в автоматизированных системах для определения чувствительности микроорганизмов. Диффузионные методы определения чувствительности основаны на диффузии АБП из носителя в плотную питательную среду и подавлении роста исследуемой культуры в той зоне, где концентрация АБП превосходит МПК [Определение чувствительности…, 2004]. Точность всех измерений и манипуляций является критическим моментом, влияющим на качество и достоверность полученных данных. Поэтому необходимо использовать только химически чистые субстанции антибиотиков с известной активностью, для их взвешивания использовать электронные лабораторные весы с точностью до 4-ого знака, для измерения объема – калиброванные дозаторы и пипетки [Определение чувствительности…, 2003]. 9 Последствия антибиотикорезистентности микроорганизмов К сожалению, вслед за оптимистическими результатами антибиотикотерапии, широкой разработкой и внедрением новых классов антибактериальных средств все отчетливее и значимо давал о себе знать феномен антибиотикорезистентности. По образному выражению профессора Страчунского Л.С. антибиотикорезистентность на современном этапе является «угрозой национальной безопасности». Да, в действительности приходится признавать, что антибиотикам во многих случаях нет альтернативы и даже внедрение в практику новых вакцин, генной инженерии будет недостаточно для преодоления столь масштабной проблемы. Потеря антибиотиков по ряду причин явилась бы катастрофой для современной цивилизации в связи с тем, что: – резко выросла бы смертность от пока управляемых инфекций (менингит, пневмония, перитонит и пр.). – вновь возникли бы эпидемии ревматизма, холеры, малярии и других инфекций. – стало бы практически невозможным проведение трансплантаций и других высокотехнологичных оперативных вмешательств. – резко возросли бы прямые и косвенные экономические потери, обусловленные затратами на лечение и нетрудоспособностью. – гораздо более опасными стали бы биотеррористические атаки [Василевский, 2008]. Клинические последствия антибиотикорезистентности могут быть весьма серьезными. Давно известно, что при бактериемии летальность намного выше у пациентов, получающих неадекватную антимикробную терапию, то есть препараты, к которым нечувствительны возбудители. Так, недавно было обнаружено, что высокий уровень резистентности к пенициллину представляет объективный предиктор летальности от пневмококковой бактериемии у ВИЧ-инфицированных больных [Penicillin resistance…, 1999]. Пожалуй, решающее значение имеет наличие в микробиологических лабораториях современного оборудования для выделения и идентификации возбудителей и определения их чувствительности к антибиотикам, а также всего необходимого для проведения лекарственного мониторинга. Профилактика антибиотикорезистентности – один из показателей качества лечения, который требует повышенного внимания [Гиссенс, 2001]. Что же касается представителей семейства Enterobacteriaceae, то данные микроорганизмы обладают резистентностью к тетрациклинам, ампициллину, ингибиторозащищенным пенициллинам, цефалоспоринам I–III поколений вследствие продукции БЛРС при сохранении чувствительности к карбапенемам. Последствия антибиотикорезистентности для системы здравоохранения и экономики носят весьма негативный характер, приводя к значительным затратам, которые трудно выразить в количественном значении ввиду отсутствия исчерпывающих статистических данных по целому ряду стран. Помимо этого, резистентность означает существенную дополнительную нагрузку для самих пациентов (боль, нарушение жизнедеятельности, психологические травмы), которая еще менее поддается расчету [Козлов, 2014]. 10 Пути решения проблемы устойчивости к антибиотикам Всемирная организация здравоохранения настоятельно рекомендует сосредоточить усилия по борьбе с резистентностью и ее профилактике на четырех основных направлениях: — эпиднадзор за устойчивостью к противомикробным препаратам; — рациональное использование антибиотиков, в том числе образование работников здравоохранения и населения в области надлежащего использования антибиотиков; — принятие или усиление законодательства в отношении прекращения продажи антибиотиков без рецептов; — строгое соблюдение мер по профилактике инфекций и инфекционному контролю, в том числе принятие мер по соблюдению чистоты рук, особенно в медицинских учреждениях. Успешная борьба против микроорганизмов с множественной лекарственной устойчивостью документально регистрируется во многих странах, а существующие и хорошо известные меры по профилактике инфекций и инфекционному контролю при их строгом и систематическом соблюдении могут способствовать эффективному уменьшению масштабов передачи микроорганизмов с множественной лекарственной устойчивостью [Вертегел, Овчаренко, 2010]. Устойчивость к антибиотикам – это растущая нерешенная медицинская проблема. Для предотвращения кризиса здравоохранения новые семейства антибиотиков должны регулярно появляться на рынке лекарственных средств. Использование в практике аналогов существующих антибиотиков, активных против устойчивых бактерий, пролонгируют жизнь данного семейства препаратов на несколько десятилетий, однако новые классы антимикробных агентов насущно необходимы. В течение ближайших 10 лет скрининг библиотек природных и синтетических соединений может привести к созданию новых антибиотических агентов. Геномика, некультивируемые бактерии и бактериофанги могут также быть источником новых активных соединений. Антисептики и неантибиотические антимикробные агенты должны быть использованы везде, где это возможно для местного применения с тем, чтобы к антибиотикам прибегали лишь при лечении серьезных системных инфекций. Новые правительственные и частные инициативы необходимы для стимулирования исследований в сфере новых антимикробных агентов, активных против антибиотикоустойчивых патогенов. Наконец, следует ввести ограничения для применения антибиотиков в сельском хозяйстве [Дебабов, 2012]. ЗАКЛЮЧЕНИЕ Антибиотикорезистентность – естественный биологический процесс. Сейчас мы живем в мире, где антибиотикорезистентность быстро распространяется и растет число жизненнонеобходимых препаратов, которые становятся неэффективными. В настоящее время резистентность микроорганизмов зарегистрирована к антибиотикам, применяемым для лечения менингита, заболеваний, передающихся половым путем, госпитальных инфекций и даже к новому классу антиретровирусных препаратов, применяемых для лечения ВИЧ-инфекции. Эта проблема в одинаковой степени касается как высокоразвитых и индустриальных, так и развивающихся стран. Избыточное применение антибиотиков во многих развитых странах, недостаточная продолжительность курса лечения у бедных – в конечном счете создается одинаковая угроза для человечества в целом. Антибиотикорезистентность – глобальная проблема. Нет страны, которая могла бы позволить себе игнорировать ее, и нет страны, которая могла бы не отвечать на нее. Только одновременно проводимые действия по сдерживанию роста антибиотикорезистентности в каждой отдельной стране смогут дать положительные результаты во всем мире. Таким образом, рассматриваемая проблема антибиотикорезистентности является чрезвычайно актуальной в современной медицине. Каждый медицинский работник, назначая антибиотики, должен отчетливо сознавать всю меру ответственности и стремиться к оптимальному решению указанных задач, максимально используя возможные пути решения проблемы устойчивости микроорганизмов к антибиотикам. БИБЛИОГРАФИЧЕСКИЙ СПИСОК Белоусов Ю.Б., Моисеев В.С., Лепахин В.К. Клиническая фармакология и фармакотерапия. М., 2006. 255с. Богун Л.В Резистентность микроорганизмов, обусловленная бета-лактамазами, и способы ее преодоления // Новости медицины и фармации. 2007. № 19(227). С.15-18. Василевский И.В. Некоторые пути решения проблемы антибиотикорезистентности на современном этапе // Медицина. 2008. № 1. С.92-97. Вертегел А.А., Овчаренко Л.С. Подходы к антибактериальной терапии детей в эпоху антибиотикорезистентности // Здоровье ребенка. 2010. № 5(26). 5с. Вильямс Д. Резистентность к бета-лактамным препаратам // Антибиотики и химиотерапия. 1997. № 4. С.4-6. Волосовец А.П., Кривопустов С.В., Юлиш Е.И. Современные взгляды на проблему антибиотикорезистентности и ее преодоление в клинической педиатрии // Здоровье ребенка. 2007. № 6(9). С.62-70. Гаузе Г.Ф. Молекулярные основы действия антибиотиков. М., 1975. 156с. Гиссенс И.К. Оценка качества антимикробной химиотерапии // Клиническая микробиология и антимикробная химиотерапия. 2001. Т.3 № 2. С.17-19. Голубовская О.А. Резистентность лекарственным средствам – проблема 21 века // Новости медицины и фармации. 2011. № 355. С.65-74. Дебабов Д.В. Устойчивость к антибиотикам: происхождение, механизмы, подходы к преодолению // Биотехнология. 2012. № 4. С.7-17. Егоров Н.С. Основы учения об антибиотиках. М., 1986. 284с. Ингибиторозащищенные бета-лактамы: место в современных схемах антибактериальной терапии / Ортенберг Э.А. [и др.] // Клиническая микробиология и антимикробная химиотерапия. 2005. Т.7. № 4. С.393-402. Карпов О.И. Клинико-фармакологическая характеристика амоксициллина/сульбактама // Фарматека. 2005. № 19. С.2-16. Ключарева А.А., Голобородько Н.В., Оскирко А.Н. Совершенствование перинатальной профилактики ВИЧ/СПИД // Медицина. 2003. № 5. 12с. Козлов Р.С. Проблема антибиотикорезистентности в акушерстве и гинекологии // Русский медицинский журнал. 2014. № 5. 4с. Козлов Р.С., Веселов А.В. Азитромицин: современные аспекты клинического применения // Клиническая микробиология и антимикробная химиотерапия. 2006. Т.8. № 1. С. 18-32. Определение чувствительности гонококков к антибактериальным препаратам / Сехин С.В. [и др.] // Клиническая микробиология и антимикробная химиотерапия. 2003. Т.5. № 2. С.175-182. Определение чувствительности микроорганизмов к антибактериальным препаратам / Семина Н.А. [и др.] // Клиническая микробиология и антимикробная химиотерапия. 2004. Т.6. № 4. С.306-359. Поляк М.С. Лабораторное обеспечение антибиотикотерапии. Спб, 2012. 257с. Резистентность микроорганизмов и антибактериальная терапия / Ершова И.Б. [и др.] // Украинский журнал экстремальной медицины им.Т.О. Можаева. 2008. Т.9. № 1. С. 28-32. Решедько Г.К. Фармакодинамическое обоснование повышения эффективности аминогликозидов при лечении грам(-) госпитальных инфекций // Автореферат диссертации на соискание ученой степени кандидата медицинских наук. Смоленск, 1997. 21с. Решедько Г.К., Стецюк О.У. Особенности определения чувствительности микроорганизмов диско-диффузионным методом // Клиническая микробиология и антимикробная химиотерапия. 2001. Т.3. № 4. 6с. Сидоренко С.В. Роль хинолонов в антибактериальной терапии. Механизм действия, устойчивость микроорганизмов, фармакокинетика и переносимость // Русский медицинский журнал. 2003. № 4. С.21-27. Сидоренко С.В., Тишков В.И. Молекулярные основы резистентности к антибиотикам // Успехи биологической химии. 2004. Т.44. С.263-306. Сидоренко С.В., Яковлев С.В. Бета-лактамные антибиотики // Русский медицинский журнал. 1997. № 21. С.30-34. Скибина К.П., Конь Е.В. Антибактериальная активность тимьянового эфирного масла в комбинации с эфирными маслами из растений семейства Lamiaceae и Pinaceae в отношении Staphylococcus. URL: http://repo.knmu.edu.ua/handle/123456789/963. (Дата обращения 13.12.2013). Стецюк О.У., Решедько Г.К., Рябкова Е.Л. Ципрофлоксацин и норфлоксацин: определение чувствительности диско-диффузионным методом. // Клиническая микробиология и антимикробная химиотерапия. 1999. Т.1. № 1. С.17-23. Страчунский Л.С., Бойко Л.М., Блохин Б.М. Фармакоэпидемиологическая оценка применения антибиотиков при респираторных инфекциях у детей в поликлинике // Антибиотики и химиотерапия.1997. № 3. С.23-26. Супотницкий М.В. Механизмы развития резистентности к антибиотикам у бактерий // Биопрепараты. 2011. № 2(42). С.4-13. Характеристика и клиническое значение бета-лактамаз расширенного спектра / Березин А.Г. [и др.] // Антибиотики и химиотерпия. 2003. Т.48. № 7. С.32-38. Эйдельштейн М.В. β-лактамазы аэробных грамотрицательных бактерий: характеристика, основные принципы классификации, современные методы выявления и типирования // Клиническая микробиология и антимикробная химиотерапия. 2001. Т.3. № 3. С.34-41. Эпидемиологический надзор в профилактике и контроле распространения антибиотикоустойчивых энтеробактерий // Доклады ВОЗ. Женева, 1980. 60с. Penicillin resistance and other predictors of mortality in pneumococcal bacteriemia in a population with high human immunodeficiency virus seroprevalence / Turett G.S. [et.al.] // Clin Infect Dis. 1999. №29. P.7-13. Tenover F.C. The best of times, the worst of times// Pharmacy world and science. 1995. № 17(5). P.149-51. |
