Кр неорганическая химия. КР моя КК Неорганика_вариант_2. Кальция бромид (хим формула) CaBr2 М. м. 199,886 гмоль
 Скачать 123 Kb. Скачать 123 Kb.
|
|
| Кальция бромид (хим.формула) CaBr2 М.м. = 199,886 г/моль. |
| Качественный анализ 1. На катион кальция. 1.1. Пирохимическая проба. При внесении в бесцветную часть пламени графитовую палочку, смоченную 1 каплей раствора вещества, пламя окрашивается в кирпично-красный цвет. 1.2. Реакция осаждения ионов кальция оксалатом аммония. С оксалатом аммония образуется белый осадок. Реакцию необходимо вести в нейтральной среде или в присутствии уксусной кислоты: Ca2+ + (NH4)2C2O4 CaC2O4↓ + 2HCl → CaCl2 + H2C2O4 2. На бромид ион. 2.1 Окислительно-восстановительная реакция на бромиды с хлорамином Б, в присутствии хлористоводородной кислоты (для выделения активного хлора – окислитель для бромид ионов), и хлороформа – экстрагент для молекулярного брома (слой хлороформа окрашивается в желто-бурый цвет (в отличии от йода – фиолетовый). 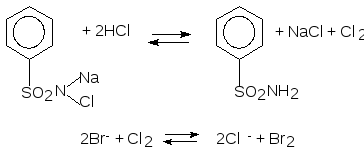 2.2. Реакция осаждения бромидов раствором нитрата серебра в азотнокислой среде. Образуется светло-желтый творожистый осадок. Мало растворим в растворе аммиака. СаBr2 + 2AgNO3 → 2AgBr↓ + Са(NO3)2 AgBr + 2NH4OH → [Ag(NH3)2]Br + 2H2O |
| Количественный анализ Точную навеску препарата, отвешенную в закрытом бюксе, растворяют в воде, тщательно перемешивают, прибавляют аммиачного буферного раствора, индикаторной смеси или несколько капель раствора кислотного хрома темно-синего. Титруют 0,1 М раствором натрия эдетата (трилон Б) до сине-фиолетового окрашивания. - название метода – Комплесонометрия (трилонометрия) - титрант – Трилон Б (этилендиаминтетрауксусной кислоты динатриевая соль; натрия эдетат) - индикатор – кислотный хром темно-синий - записать основное (-ые) уравнение (-я) реакции (-й) между определяемым веществом и титрантом. 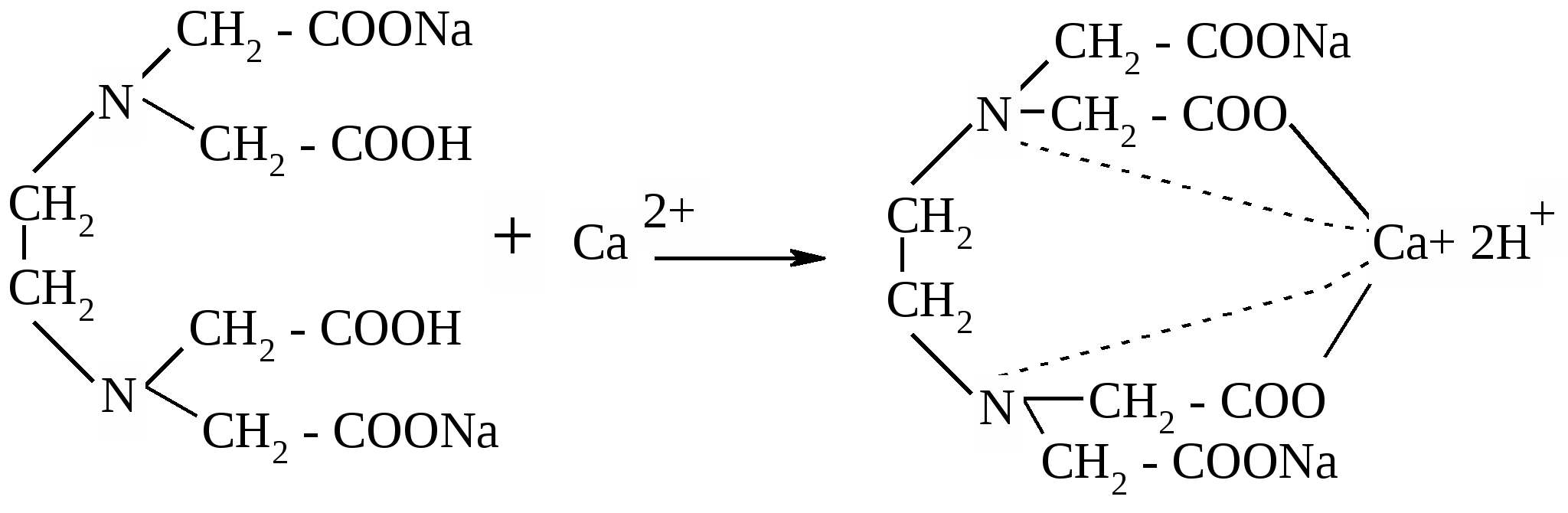 - рассчитать и записать титр соответствия титранта по определяемому веществу, согласно методике, представленной в задании. Реакция между титрантом и определяемым веществом идет 1:1, поэтому, несмотря на то, что фактор эквивалентности трилона Б и кальция бромида равен 1/2 (в ходе реакции образуется два иона водорода, что означает фактор эквивалентности для обоих веществ 1/2, - по определению «фактора химического эквивалента»), в расчетах можно исходить из молярной концентрации титранта (0,1М) (а не из молярной концентрации эквивалента) и из молярной массы определяемого вещества (а не из молярной массы эквивалента определяемого вещества). Т(тр.Б/ СаBr2) = С(тр.Б) * М.м.( СаBr2) / 1000 Т(тр.Б/ СаBr2) = 0,1 * 199,886 / 1000 = 0,0199886 г/мл |
| Натрия гидрокарбонат (хим.формула) NaHCO3 М.м. 84,01 |
| Качественный анализ 1.Катион натрия. Пирохимическая фармакопейная проба. Соли натрия внесенные в бесцветную часть пламени, окрашивают ее в желтый цвет. Реакция осаждения. Катион натрия обнаруживают по окрашиванию бесцветного пламени горелки в желтый цвет и по образованию зеленовато-желтого кристаллического осадка с цинкуранилацетатом в уксуснокислой среде. NaCI + Zn[(UO2)3(CH3COO)8] + СH3COOH + 9H2O → NaZn[(UO2)3(CH3COO)8] *9H2O↓ + HCI Гидрокарбонат ион. 2.1. При действии разведенных минеральных кислот появляются пузырьки диоксида углерода, вследствие разложения нестойкой угольной кислоты: NaHCO3 + HCl → NaCl + CO2↑ + H2O При пропускании выделяющегося диоксида углерода через известковую воду образуется белый осадок кальция карбоната: CO2 + Ca(OH)2 → CaCO3↓ + H2O 2.2. Отличие от карбонатов щелочных металлов. Гидрокарбонаты щелочных металлов (натрий) в растворе подвергаются гидролизу: HCO3- + H2O→ CO2 + H2O + OH- Реакция среды гидрокарбонатов слабощелочная в отличие от карбонатов - имеют сильнощелочную реакцию среды. Поэтому растворы гидрокарбонатов, в отличие от карбонатов не окрашиваются от фенолфталеина в розовый цвет. |
| Количественный анализ Около 0,2 г (точная навеска) субстанции растворяют в 20 мл воды, свободной от углерода диоксида, и титруют 0,1 М раствором хлористоводородной кислоты (индикатор – 0,1 мл 0,1 % спиртового раствора метилового оранжевого). Параллельно проводят контрольный опыт. - название метода – нейтрализация (вариант – ацидиметрия) - титрант – 0,1 М раствором хлористоводородной кислоты - индикатор – 0,1 % спиртовый раствор метилового оранжевого - записать основное (-ые) уравнение (-я) реакции (-й) между определяемым веществом и титрантом. NaHCO3 + HCl → NaCl + H2O + СО2↑ Фактор эквивалентности ЛВ – fэкв.(NaHCO3) = 1; М.м.экв(NaHCO3) = М.м. * fэкв. = 84,01 * 1 = 84,01 г/моль - рассчитать и записать титр соответствия титранта по определяемому веществу, согласно методике, представленной в задании. Т(HCl/ NaHCO3) = С(HCl) * М.мэкв.( NaHCO3) / 1000 Т(HCl/ NaHCO3) = 0,1 * 84,01 / 1000 = 0,008401 г/мл. |
| Колларгол Содержит не менее 70% серебра и до 30% белка |
| 1.Качественный анализ 1.1. На белок. При нагревании сухого препарата происходит обугливание и появляется запах жженого рога. 1.2 Полученный после озоления (реакция на белок) серовато-белый остаток растворяют в разбавленной азотной кислоте и фильтруют к фильтрату соляной кислоты, образуется белый творожистый осадок, растворимый в растворе аммиака. 3Ag + 4HNO3 = 3AgNO3 + NO↑ + 2H2O AgNO3 + HCl = AgCl↓ + HNO3 AgCl + 2NH4OH = Ag(NH3)2Cl + 2H2O Ag(NH3)2Cl + 2HNO3 = AgCl + 2NH4NO3 1.3. Препарат растворяют в воде, прибавляют раствор HCI и нагревают до кипения. Смесь фильтруют к фильтрату прибавляют раствор NaOH и раствор меди сульфата, перемешивают - появляется фиолетовое окрашивание (реакция на белок- остаток аминокислоты). 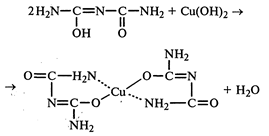 1.4. По ФС, отличие колларгола от протаргола - реакция образования серебролизальбиновой кислоты - образуется при добавлении разведенной хлороводородной кислоты к раствору золя колларгола (1:50), выпадает темно-бурый осадок, при подщелачивании осадок растворяется. Протаргол этой не дает. |
| Количественный анализ Точную навеску препарата помещают в колбу Кьельдаля, прибавляют концентрированной серной кислоты и нагревают в течение 5 минут. Затем по каплям прибавляют концентрированную азотную кислоту и кипятят. По охлаждении бесцветный раствор переносят в колбу, добавляют воды и титруют 0,1М раствором NH4CNS до желтовато-розового окрашивания (индикатор – железоаммонийные квасцы). • название метода – тиоционатометрия (роданометрия) • титрант – 0,1М раствором NH4CNS • индикатор – железоаммонийные квасцы (FeNH4(SO4)2) • записать основное (-ые) уравнение (-я) реакции (-й) между определяемым веществом и титрантом. 3Ag + 4HNO3 = 3AgNO3 + NO↑ + 2H2O AgNO3 + NH4CNS = AgCNS↓ + NH4NO3 В точке эквивалентности FeNH4(SO4)2 + 3NH4CNS = Fe(CNS)3 +2(NH4)2SO4 • рассчитать и записать титр соответствия титранта по определяемому веществу, согласно методике, представленной в задании. fэкв. = 1. М.м.(1/z). М.м.(1/z, Ag) = М(Ag)=107,9 г/моль * fэкв. = 1 =107,9 г/моль Колларгол содержит 70 % серебра, поэтому вводится условный титр. Т (NH4CNS/ Ag) = С(NH4CNS) * М.м.(Ag) / 1000 Т (NH4CNS/ Ag) = 0,1 * 107,9 / 1000 = 0,01079 г/мл. Т (NH4CNS/ Ag) = 0,01079 г/мл -------- 70% Тусловн. -------------------------------------- 100%; Тусловн. = 0,01079 * 100 / 70 = 0,1541428 г/мл. 1 мл 0,1 моль/л раствора роданида аммония соответствует 0,1541428 г/мл г колларгола. |
Количественное определение
Кальция бромид
Точную навеску препарата, отвешенную в закрытом бюксе, растворяют в воде, тщательно перемешивают, прибавляют аммиачного буферного раствора, индикаторной смеси или несколько капель раствора кислотного хрома темно-синего. Титруют 0,1 М раствором натрия эдетата (трилон Б) до сине-фиолетового окрашивания.
Натрия гидрокарбонат
Около 0,2 г (точная навеска) субстанции растворяют в 20 мл воды, свободной от углерода диоксида, и титруют 0,1 М раствором хлористоводородной кислоты (индикатор – 0,1 мл 0,1 % спиртового раствора метилового оранжевого). Параллельно проводят контрольный опыт.
Колларгол
Точную навеску препарата помещают в колбу Кьельдаля, прибавляют концентрированной серной кислоты и нагревают в течение 5 минут. Затем по каплям прибавляют концентрированную азотную кислоту и кипятят. По охлаждении бесцветный раствор переносят в колбу, добавляют воды и титруют 0,1М раствором NH4CNS до желтовато-розового окрашивания (индикатор – железоаммонийные квасцы).
2 задание
Задача
Рассчитайте количественное содержание активного компонента в исследуемой лекарственной форме (ЛФ). Назовите метод количественного определения, титрант, индикатор. Запишите заключение.
ЛФ состава:
Натрия бромида 2,0
Воды очищенной до 200 мл.
_____________________________________________________________
К 1 мл исследуемой лекарственной формы прибавляют 1-2 капли раствора бромфенолового синего, по каплям разведенную уксусную кислоту до зеленовато-желтого окрашивания и титруют 0,1 М раствором серебра нитрата до фиолетового окрашивания. Расход титранта составил 0,95 мл.
Метод – осаждение - Аргентометрия - вариант по Фаянсу.
Титрант – 0,1М раствор серебра нитрата
Индикатор – бромфеноловый синий (адсобционный индикатор)
Дано:
а = 1 мл
С(AgNO3) = 0,1М
V(AgNO3) = 95мл
_______________________
(Хг, NaBr)=?
Решение.
Уравнение реакции титрования
NaBr + AgNO3 → AgBr↓ + NaNO3
fэкв. (NaBr) =1; М.м.экв(NaBr) = М.м. (NaBr) = 102,90 г/мл.
2. Расчет проводится по формуле:
Х(г) = С(AgNO3) * М.м.экв.(NaBr) * V(AgNO3) * V(Л.Ф.)/1000 * а
Х(г) = 0,1 * 102,9 * 0,95 * 200 / 1000 * 1 = 1,9551
3.Заключение
Для массы ЛВ = 2,0, допустимое отклонение не более +/-5% (Приказ МЗРФ № 751н, приложение № 3, таблица № 4).
∆(%)=(mф-m)*100 / m = 1,9551 – 2,0 = −2,245
−2,245 входит в допустимый интервал (+/-5%).
Лекарственный препарат соответствует требованиям Приказа МЗРФ № 751н по показателю «Допустимые отклонения в массе навески отдельных лекарственных средств в жидких лекарственных формах при изготовлении массо-объемным методом» (таблица № 4, не более +/-5%).
Контрольная работа
по МДК 01.02.2. Контроль качества лекарственных средств
(неорганические лекарственные средства)
Выполнил студент
Балашова Е.М.
(ФИО)
Группа № 17/19
по специальности "Фармация"
Вариант № _II_
Проверил______________________
(заполняется преподавателем)
Оценка:
2020
