Каталитическая конверсия метана. Каталитическая конверсия метана водяным паром
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
СН4 С+2Н2 – 18,1 ккал (1) либо каталитическим окислением метана водяным паром, кислородом и двуокисью углерода: СН4 + 0,5О2 CO + 2H2 + 8,5 ккал (2) СН4 + H2O CO + 3H2 – 49,3 ккал(3) СН4 + CO2 2CO + 2H2 – 59,1 ккал(4) СО + H2O CO2 + H2 + 9,8 ккал(5) Выбор окислителей и их возможные сочетания определяются назначением процесса и технологической схемой дальнейшей переработки полученного газа. Реакции (1) — (2) практически необратимы. Реакции (3) — (5) являются обратимыми, т. е. в зависимости от условий, в которых они осуществляются, могут проходить как слева направо, так и справа налево. Вследствие обратимости реакции прямой процесс невозможно осуществить до конца. В самом деле, в обратимых реакциях, например в реакции (3), оба процесса—прямой (взаимодействие метана с водяным паром) и обратный (взаимодействие окиси углерода с водородом) — протекают одновременно. При достаточно высоких температурах и концентрациях метана в газовой смеси скорость прямой реакции гораздо больше, чем скорость обратного процесса. Постепенно скорости прямого и обратного процессов выравниваются и наступает химическое равновесие, при котором в смеси присутствуют как исходные вещества, так и продукты реакции. Равновесный состав газа для обычно применяемых в промышленности исходных газовых смесей и интервале температур 827—1027°С приведен в табл.1). С изменением температуры, давления и состава исходной смеси равновесный состав газа также изменяется. При повышении температуры увеличиваются скорости обеих реакций (прямой и обратной), но увеличиваются они в разной степени. В случае реакций, протекающих с поглощением тепла (эндотермических реакций), например реакции (3), скорость прямой реакции возрастает гораздо больше, чем скорость обратной реакции. В результате этого равновесие сдвигается вправо, т. е. в сторону уменьшения содержания метана в конвертированном газе. В случае же реакций, протекающих с выделением тепла (экзотермических реакций), например реакции (5), равновесие сдвигается влево, т. е. степень конверсии окиси углерода снижается. Таблица 1. Равновесный состав газа в процессе конверсии метана для обычно применяемых в промышленности исходных газовых смесей при абсолютном давлении 1 ат
Изменение давления влияет на равновесный состав газа только тогда, когда в результате реакции изменяется объем газа (при постоянном давлении), т. е. когда общее число молей (объемов) исходных веществ отличается от числа молей (объемов) продуктов реакции. Равновесный состав газа для реакций, протекающий без изменения объема, например, реакции (5), не зависит от давления. Реакция (3) протекает с увеличением объема: из двух объемов исходной смеси получается четыре объема конвертированного газа, поэтому при повышении давления равновесие смещается влево, т. е. степень конверсии метана снижается. Например, для исходной смеси состава СН4 : H2O = 1 : 2 при 827°С и давлениях 10, 20 и 40 атм содержание метана в конвертированном газе составляет соответственно 5, 10 и 16% (рис. 5). Для того чтобы остаточное содержание метана в конвертированном газе не увеличивалось при повышении давления, необходимо одновременно повысить температуру. Так, например, чтобы получить при указанном составе исходной смеси газ с остаточным содержанием метана 0.5% при абсолютном давлении 10 атм, нужно повысить температуру до 960°С, а при 20 атм — до 1060°С. Несмотря на это, проведение процесса конверсии при умеренном давлении (20 — 30 атм) экономически целесообразно, так как в данном случае уменьшается расход энергии на сжатие конвертированного газа, а также снижаются капитальные затраты на сооружение конверсионной установки. При увеличении концентрации реагирующих веществ происходит также увеличение концентрации образующихся веществ. Для рассматриваемой реакции (3) повышение содержания водяных паров в исходной смеси приведет к смещению равновесия вправо, т. е. к увеличению содержания СО и водорода и уменьшению содержания метана в конвертированном газе. Увеличение количества добавляемого водяного пара особенно важно, когда конверсия метана осуществляется при повышенном давлении. Например, применяя исходную смесь СН4 : H2O = 1 : 4 при давлении 10 атм, можно получить конвертированный газ, содержащий 0,5% метана, при 850°С, т.е. на 110°С ниже, чем при составе исходной смеси 1 : 2. Скорость реакции взаимодействия метана с водяным паром, т. е. количество метана, прореагировавшего в единицу времени, в отсутствие катализатора очень мала. Так, при нагревании смеси метана с водяным паром до 700°С и соотношении СН4: H2O = 1 : 2 в течение 3 ч только 3% метана превращается в водород. 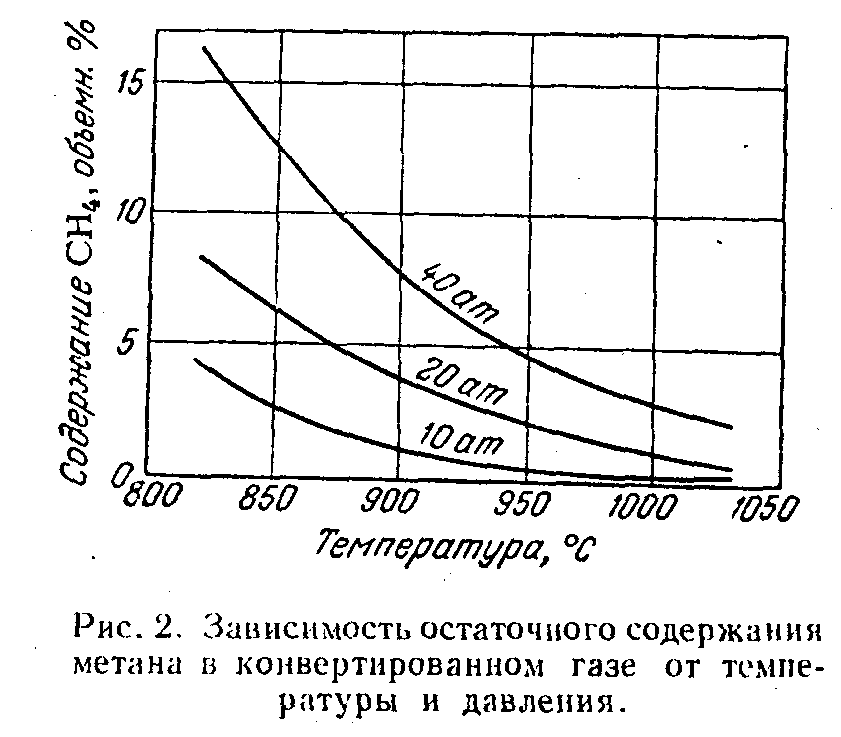 Рис.5. Зависимость остаточного содержания метана в конвертированном газе от температуры. Для получения газа, содержащего 0,5% метана, требуется повысить температуру до 1400°С. В производственных условиях конверсия метана должна протекать в течение долей секунды, что достигается путем применения катализаторов. 3.5 Термодинамика И кинетика процесса конверсии метана водяным паром.[5] Равновесие реакции конверсии метана водяным паром, как реакции эндотермической, с ростом температуры смещается в сторону образования СО и Н2, а с ростом давления в обратную сторону, т. е. в сторону образования метана. 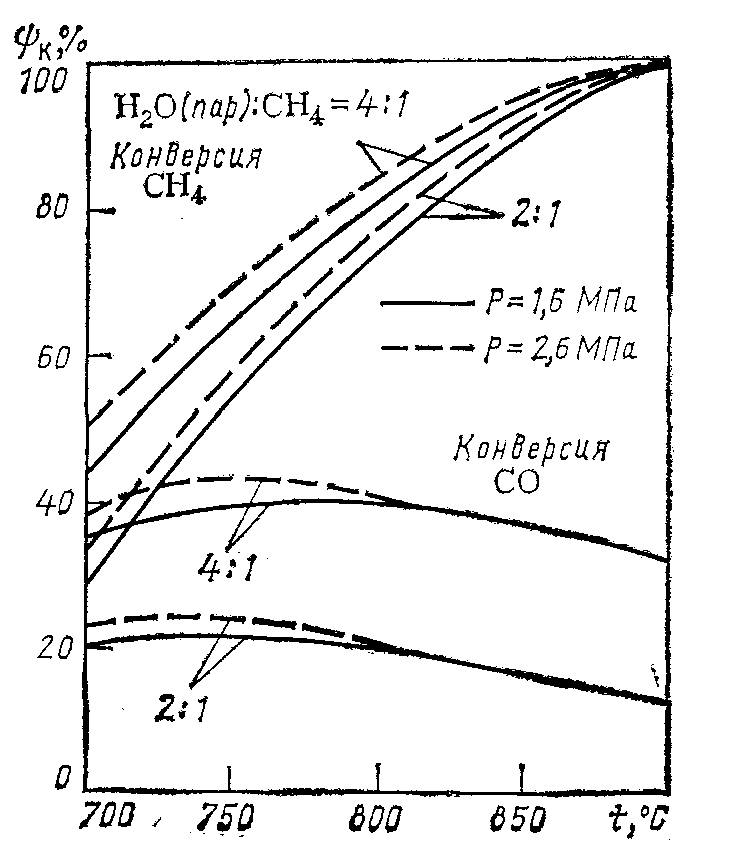 Рис.6. Зависимость полноты конверсии СН4 и СО к от температуры Однако для заданного давления и температуры превращение метана возрастает с ростом содержания пара в исходной газовой смеси (рис. 6). На этом рисунке одновременно видно, как с ростом температуры падает полнота конверсии СО водяным паром – реакции экзотермической. И хотя давление оказывает отрицательное воздействие на превращение метана, наблюдается постоянный рост используемого давления в промышленных процессах паровой конверсии метана (рис. 7). 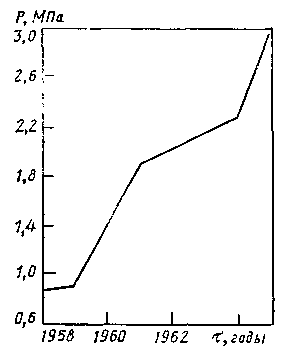 Рис 7. Применяемое давление газа Р на выходе из трубчатого реактора конверсии природного газа в различные периоды времени . Проведение процесса при повышенных давлениях снижает расходы на компрессию полученного синтез-газа, затраты на изготовление аппаратуры, улучшает условия теплопередачи. Развитие этого процесса ограничивается в основном прочностью металла реакционных труб, работающих в жестких условиях высоких температур. 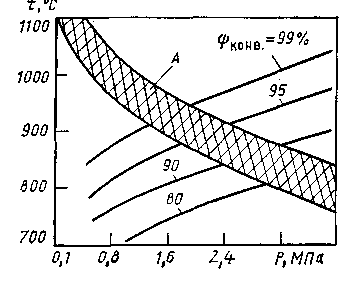 Рис 8. Ограничения по температуре t и давлению Р процесса паровой конверсии углеводорода, обусловленные материалом труб (отношение пар : углерод = 3,5; А – расчетные границы для работ труб; конв – полнота конверсии). Равновесные соотношения при конверсии метана показывают, как это видно на рис. 8, что для заданного превращения метана при постоянном соотношении водяной пар : углерод повышение давления в процессе означает повышение температуры риформинга, повышение температуры газов, выходящих из трубчатых печей, и повышение температуры стенок реакционных труб. Принципиальное влияние качества труб (срок жизни 10 лет для хромоникелевой стали) на условия проведения паровой конверсии под давлением иллюстрируется данными, приведенными на рис.8. Наиболее обоснованное и практически оправданное уравнение скорости реакции конверсии метана для атмосферного давления дал Темкин и его ученики. Энергия активации процесса паровой конверсии составляет 129,79 кДж/моль для температурной области 800 — 900°С на никелевой фольге и 100,48 кДж/моль для этой же области температур на никелевом катализаторе, нанесенном на пористом носителе. Кинетические данные используют для расчета аппаратов конверсии, в частности для расчета температур на входе в реактор и выходе из него. В качестве катализаторов конверсии используют никель, нанесенный на пористый носитель. Содержание никеля в катализаторе может колебаться в широких пределах — от 4 до 35% (масс.). Наиболее стабильными катализаторами для широкого диапазона температур конверсии и работы в экстремальных условиях являются катализаторы, носители для которых не содержат SiО2, главной их основой является -Аl2О3 (корунд). В качестве активаторов в них могут содержаться оксиды кальция, титана, магния, хрома. Внутренняя поверхность таких катализаторов колеблется от 5 до 50 м2/г. Восстановление нанесенного NiO до металлического никеля происходит в загруженном конверторе водородом или метаном. Для конверсии легких фракций нефти (нафты) используют щелочные калийсодержащие катализаторы. Использование таких катализаторов дает возможность проводить конверсию нафты при низких соотношениях пар : углерод (3: 1) без выделения сажи. 4.1 Катализаторы конверсии метана Катализаторами называются такие вещества, которые увеличивают скорость химических реакций. Применение катализатора не вызывает сдвига химического равновесия в ту или иную сторону. Как установлено многочисленными исследованиями лучшим для процесса конверсии метана является никелевый катализатор. В свежем катализаторе никель находится в виде окислов. Катализатором же ускоряющим реакции конверсии метана, является металлический никель. Поэтом, перед началом процесса конверсии катализатор необходимо восстановить газом, содержащим водород NiO + H2 = Ni + H2O. Катализатор восстанавливается водородом полностью при температуре 300 — 400°С в течение 2—4 ч. При отсутствии водорода катализатор можно также восстановить рабочей смесью (метан и водяной пар или метан, водяной пар и кислород) при 750 — 850°С. Если никель находится не в виде окислов, а в виде их соединении с окисью алюминия (шпинели), то для его восстановления требуется более высокая температура (800 — 900°С). В этом случае процесс восстановления протекает медленнее. Никель-алюминиевая шпинель (голубовато-зеленоватого цвета) образуется при нагревании катализатора до температуры выше 600°С в среде, не содержащей восстановителей (Н2 и СО). Эффективность работы катализатора определяется остаточным содержанием метана в конвертированном газе при определенном количестве подаваемого исходного газа. Нагрузка на катализатор характеризуется объемной скоростью.Объемной скоростью называется количество кубометров исходного газа (сухого), проходящего через 1 м3 катализатора в час. Объемная скорость выражается в ч-1. В промышленных условиях катализатор конверсии метана работает в интервале объемных скоростей 250 — 400 ч-1 при 600—1000°С. Активность никелевого катализатора может снижаться вследствие присутствия в газе соединений серы: Н2S, CS2 и COS. Вещества, снижающие активность катализатора, называются каталитическими ядами. Процесс отравления катализатора Н2S протекает по схеме Ni + H2S NiS + H2. Образовавшийся сернистый никель уже не способен ускорять реакцию конверсии метана, в связи с чем активность катализатора снижается. Проведенными исследованиями установлено значительное влияние температуры на отравление катализатора соединениями серы. Показано, что при температуре, равной 600°С, наличие даже небольших количеств соединений серы в газе (5 мг/м3 серы) приводит к необратимому отравлению и полной потере активности катализатора. С повышением температуры отравляемость катализатора этими соединениями уменьшается. Так, при температуре 700 — 800°С отравление катализатора происходит в значительно меньшей степени и активность его может быть восстановлена в процессе конверсии метана, не содержащего соединений серы. При 850°С и содержании в газе 5 — 7 мг/м3 серы заметного отравления катализатора не наблюдается. Конверсия метана может сопровождаться выделением свободного углерода (сажи), что затрудняет проведение процесса. Реакция (1) образования сажи протекает параллельно с основными реакциями в случае недостатка окислителей — водяного пара и кислорода. При этом углерод отлагается не только на поверхности, но и внутри гранул катализатора, что приводит к уменьшению активности и механическому разрушению катализатора и к увеличению гидравлического сопротивления аппарата потоку газа. В отсутствие катализатора образование углерода по реакции (1) начинается при нагревании метана до температуры 800°С, а на восстановленном никелевом катализаторе эта реакция протекает с заметной скоростью уже при 400°С. Воспламенение в объеме (без катализатора) смеси метана с водяным паром и кислородом, применяемой в процессе конверсии природного газа, всегда сопровождается образованием углерода вследствие частичного разложения метана при температуре около 1100°С, развиваемой в пламени. На никелевом катализаторе при достаточном количестве окислителей выделения свободного углерода не происходит. Из сказанного следует, что на нагретый катализатор нельзя подавать природный газ, не смешав его предварительно с водяным паром и кислородом. [3] 4.2 Катализаторы конверсии метана ГИАП-8, ГИАП-25, ГИАП-36Н. Область применения: Катализаторы конверсии метана ГИАП-8, ГИАП-25, ГИАП-36Н применяются для воздушной конверсии газообразных углеводородов в эндотермических генераторах контролируемых атмосфер при температурах 1030-1050 °С. Могут применяться также для воздушной конверсии сжиженных газов (пропан и пропанобутановой фракции) в тех же целях. Используются также в различных отраслях машиностроительной промышленности, где контролируемые атмосферы используются для термообработки металлических изделий и деталей машин. Основные данные: Катализаторы отвечают требованиям ТУ 11303382-86. Нанесенная часть катализаторов содержит оксиды никеля, алюминия и кальция. Внешний вид: кирпичики серого цвета (ГИАП-25), цилиндрические гранулы серого цвета (ГИАП-8 и ГИАП-36Н).  Рис.9. Катализаторы конверсии метана ГИАП-8, ГИАП-25, ГИАП-36Н. Размеры: 32 х32 (ГИАП-25), диаметр 15-18 мм, высота 15-18 мм (ГИАП-8,ГИАП-36Н). Массовая доля никеля в пересчете на оксид никеля: 7.5 + 1.5 % (для ГИАП-8, ГИАП-36Н) и до 12 % (для ГИАП-25). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
