Каталитическая конверсия метана. Каталитическая конверсия метана водяным паром
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
5.1.Найдем количество поступающего метана (в час): по закону эквивалентов 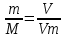 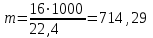 (кг) (кг)Найдем количество конвертируемого метана: V=0, 71000=700 (м3) 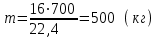 После реакции осталось: m(СН4) = 714,29 – 500 = 214,29 (кг) V(СН4)= 1000 – 700 = 300 (м3) 5.2. Найдем необходимое количество воды для осуществления реакции: 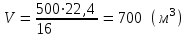 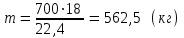 В промышленном производстве для осуществления процесса воду и метан берут в отношении 2:1. Исходя из этого условия рассчитаем количество поступающего водяного пара: V = 2 1000 = 2000 (м3) 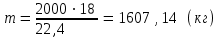 Не прореагировало водяного пара: m(Н2О) = 1607,14 – 500 = 214,29 (кг) V(Н2О) = 2000 – 700 = 300 (м3) 5.3. В реактор поступает 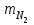 : :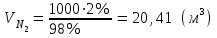 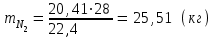 Т.к. азот не участвует в химической реакции, то на выходе: m = 25,51 (кг) V = 20,41 (м3) 5.4. Найдем количество образовавшегося в ходе реакции СО: 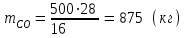 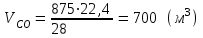 5.5. Найдем количество образовавшегося водорода: 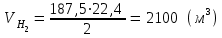 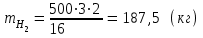 Вывод: 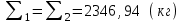 . Материальный баланс сошелся. . Материальный баланс сошелся.6. Составим энергетический баланс:
6.1. Найдем тепло, которое поступает с исходными веществами – физическое тепло: 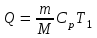 где T1 – температура на входе, (t1=105  C); Ср – теплоемкость, будем считать, что теплоемкость зависит от температуры (п.2). C); Ср – теплоемкость, будем считать, что теплоемкость зависит от температуры (п.2).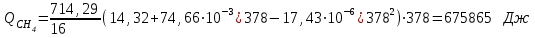 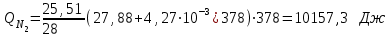 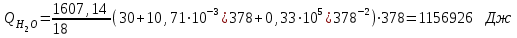 Реакция конверсии водяным паром сильно эндотермична, поэтому необходимо подогревать исходную реакционную смесь. В промышленности для подогрева системы используют природный газ, за счет сжигания которого выделяется необходимое количество тепла Q. 6.2. Найдем тепло веществ на выходе из реактора: 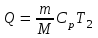 где T2 – температура на выходе из реактора. 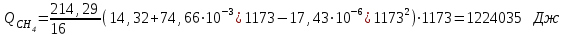 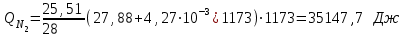 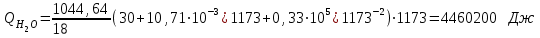 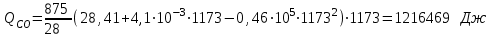 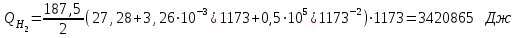 6.3. Найдем теплоту, поглощенную в ходе химической реакции: 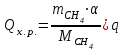 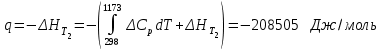 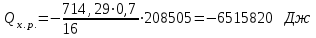 6.4. Найдем количество теплоты, которое необходимо затратить на подогрев исходной смеси: 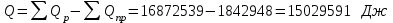 6.5. Найдем количество природного газа, которое необходимо затратить для подогрева исходной смеси, считая, что природный газ на 95% состоит из метана (состав природного газа зависит от месторождения, колеблется от 55-99%): По справочнику: 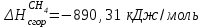 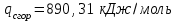 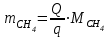 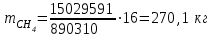 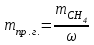 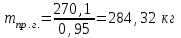 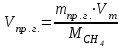 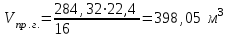 СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ А. Г. Аншиц, Е. Н. Воскресенская. Окислительная конденсация метана – новый процесс переработки природного газа. Сосна М.Х., Энтин Б.М., Лейтес И.Л. Нонограммы для определения состава газа конверсии метана//Химическая промышленность. – 1989. - №7. - с.59 Крейндель Э.М. Конверсия метана природного газа. Л.:-1964. Г.С. Яблонский. Кинетические модели гетерогенно-каталитических реакций. Элементы теории кинетики сложных химических реакций. Глава 1. В сб.: Химическая и биологическая кинетика / Под ред. Н.М. Эмануэля, И.В. Березина, С.Д. Варфоломеева. М.: Изд-во Моск. ун-та, 1983. Водород. Свойства, получение, хранение, транспортирование, применение: Справ. изд./Д.Ю. Гамбург, В.П. Семенов, , Л.Н. Смирнова; Под ред. Д.Ю. Гамбурга, Н.Ф. Дубовкина. – М.: Химия, 1989. |
