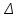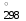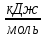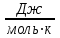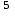Каталитическая конверсия метана. Каталитическая конверсия метана водяным паром
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
4.3 ДКР-1 ДРК – 1 новый вид катализатора, предназначен для паровой и пароуглекислотной конверсии газообразных углеводородов в трубчатых печах крупнотоннажных агрегатов по производству аммиака, метанола, установок получения технического водорода. Катализатор представляет собой промотированный оксид никеля, нанесенный на высокоглиноземистый носитель в виде циллиндрических колец, имеет более высокую активность и стабильность.
5 Расчет процесса конверсии Рассчитать процесс конверсии метана водяным паром по следующим данным:
СН 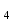 + Н + Н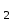 О О  СО + 3Н СО + 3Н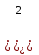  Расчет термодинамических параметров.
1.1. По закону Гесса находим тепловой эффект химической реакции при нормальных условиях: Н 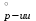 =(niН =(niН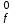 ) )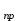 - (niН - (niН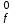 ) )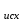 Н 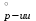 = 03 - 110,53 + 241,81 + 74,85 = 206,13 кДжмоль = 03 - 110,53 + 241,81 + 74,85 = 206,13 кДжмоль1.2. Найдем энтропию реакции: S 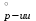 = (niS = (niS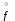 ) )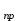 - (niS - (niS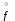 ) )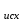 S 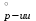 =3130,52 +197,55 -188,72 -186,27= 214,12 ДжмольК =3130,52 +197,55 -188,72 -186,27= 214,12 ДжмольК1.3. Найдем изменение энергии Гиббса в ходе реакции при нормальных условиях: G 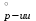 = (niG = (niG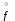 ) )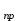 -(niG -(niG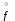 ) )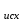 G 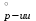 = 30-137,15+288,61+50,85=142,31 кДжмоль = 30-137,15+288,61+50,85=142,31 кДжмоль2. Найдем функцию зависимости теплоемкости от температуры С 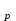 = f(Т) = f(Т)
Ср(СН4) = 14,32 + 74,6610 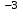 Т - 17,4310 Т - 17,4310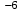 Т Т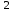 Ср(Н2О) = 30 + 10,7110-3Т + 0,33105Т-2 Ср(СО) = 28,41+ 4,110-3Т - 0,46105Т-2 Ср(Н2) = 27,28 + 3,2610-3Т + 0,5105Т-2 Ср = а + bT + с’Т2+cТ-2 Ср = (327,28+28,41-30-14,32) + (33,26+4,1-10,71-74,66)10-3Т + + (30,5-0,46-0,33)105Т-2 - 17,4310-6Т2 Ср = 65,93 - 71,4910-3Т + 0,71105Т-2 - 17,4310-6Т2 ДжмольК 2.1. Для азота зависимость теплоемкости от температуры выглядит следующим образом: Ср(N2) = 27,88 + 4,2710-3Т 3.1. Найдем изменение энтропии в ходе реакции при нагревании от t1=25  C до t2=900 C до t2=900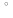 C: C:S= 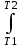 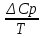 dТ = dТ =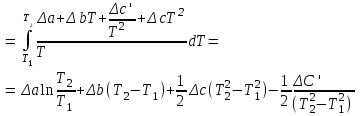 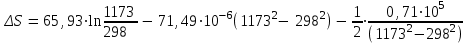 S=16.54 Дж/мольК 3.2. Найдем изменение энтальпии в ходе реакции при нагревании от t1=25C до t2=900C: 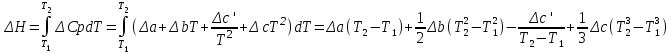 H= 65,93 (1173-298) - 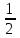 71,4910-3(11732-2982) - 71,4910-3(11732-2982) - 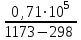 - - 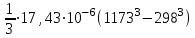 Н= - 2375 Дж/моль 3.3. Рассчитаем энергию Гиббса на выходе t2=900С: 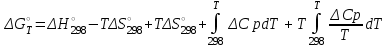 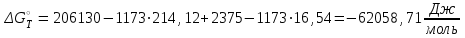 4. Найдем константу равновесия: G=-RTlnKp Kp = exp(-G/RT) Kp=exp(-(-62058,71/8,311173))=582,04 4.1. Рассчитаем равновесную степень превращения метана. При температуре от 827С и составе исходной смеси СН4 Н2О = 1 2 необходимо проводить процесс при абсолютном давлении 10 атм. СН4 + Н2О СО + 3Н2 т.к. водяной пар в избытке, то РН2О = 2РСН4 Робщ = РСН4 + 2РСН4= 3РСН4 РСН4 = Робщ/3 = 10/3 атм. При равновесии: 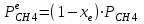 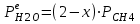 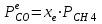 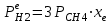 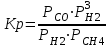 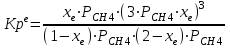 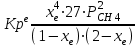 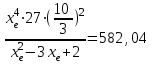 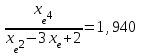 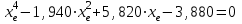 xe = 0,8115 и xe = - 2,29 Равновесная степень превращения равна 0,8115. Вывод: равновесная степень превращения метана xe=0,8115 ,степень конверсии = 0,7 , данный процесс, возможно, провести в указанных условиях. 5. Составим материальный баланс.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||