Контрольная работа по неорганической химии. Вариант 05d. Задача решается по закону эквивалентов
 Скачать 49.46 Kb. Скачать 49.46 Kb.
|
|
Контрольная работа Вариант 05 5. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите молярную массу эквивалентов кислоты. (Ответ: 41 г/моль). Решениt M(KOH) =39+17 = 56 г/моль М(Н3РО3) =3+31+48=82 г/моль Н3РО3 + 2 КОН = К2 НРО3 + H2O Задача решается по закону эквивалентов: Закон эквивалентов: массы реагирующих друг с другом веществ прямо пропорциональны молярным массам их эквивалентов. 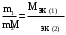 Поделив массу каждого вещества на молярную массу его эквивалентов, получим число молей эквивалентов (n1): 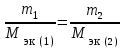 , или n1= n2. , или n1= n2.n1=n2= m2/M(KOH) = 1,291/56 = 0,023 моль Э (Н3РО3) = m1/ n1= 0,943 /0,023 = 41г/моль Ответ: 41 г/моль 25. Какие значения могут принимать квантовые числа n, l, ml иms, характеризующие состояние электрона в атоме? Какие значения они принимают для внешних электронов атома бария? Решение Состояние электрона в атоме характеризуется четырьмя квантовыми числами. Главное квантовое число n определяет энергию электрона в атоме и размер АО, т.е. удаленность электрона от ядра. Главное квантовое число n принимает значения целых чисел 1, 2, 3, 4… Числовое значение n 1 2 3 4 5 6 7 Буквенное обозначение K L M N O P Q Энергию электрона на подуровне и форму атомной орбитали характеризует орбитальное квантовое число l. Значение l зависит от главного квантового числа: l принимает значения от 0 до (n–1), т. е. 0, 1, 2, 3… (n–1). При l=0, 1, 2, 3 электроны находятся соответственно на s-, p-, d-, f-подуровнях. Электроны различных подуровней называют s-, p-, d-, f-электронами. В этом случае говорят также о состояниях s-, p-, d-, f-электронов или s-, p-, d-, f-атомных орбиталях. Магнитное квантовое число ml определяет возможные ориентации орбитали в пространстве. Оно связано с орбитальным квантовым числом и может принимать целочисленные значения от –l до +l, включая ноль. Определенному значению l соответствует (2l+1) возможных значений магнитного квантового числа. Число значений ml указывает на число атомных орбиталей в подуровне и число возможных направлений, по которым они могут ориентироваться в пространстве. Для s-подуровня l=0 и потому ml имеет единственное значение: ml =0. Таким образом, на s-подуровне имеется единственная s-орбиталь и она расположена симметрично относительно ядра атома. Для p-подуровня l=1 и ml приобретает три значения: –1, 0, 1, т. е. р-подуровень имеет три р-орбитали и они ориентированы по трем осям координат. d-подуровень с l=2 имеет пять значений ml: –2, –1, 0, 1, 2 и, следовательно, пять d-орбиталей, которые ориентированы по пяти разным направлениям. f-подуровень с l=3 имеет семь значений ml: –3, –2, –1, 0, 1, 2, 3, т. е. семь f-орбиталей. Число ориентаций f-орбиталей равно семи. Спиновое квантовое число ms характеризует два возможных направления вращения электрона вокруг собственной оси (по часовой стрелке или против). Спиновое квантовое число ms принимает два значения: +½ и –½. Электроны с разными спинами обычно обозначаются противоположно направленными стрелками ↓↑. Барий Электронная формула Ba - ..4d105s25p6 6s2 Квантовые числа валентных электронов: n=6 l=0; m=0; s = + ½    45. Один из элементов III группы образует оксид с массовой долей кислорода 25,6%. Рассчитайте молярную массу элемента и назовите этот элемент. (Ответ: 69,7 г/моль). Решение Оксид элемента 3 группы имеет формулу Me2O3 Эквивалентная масса кислорода: Э(О) = 8 г/моль Зная, что молярная масса эквивалентов кислорода равна 8 г/моль, определим молярную массу эквивалентов элемента в оксиде по закону эквивалентов: 74,4/25,6 =ЭMe/8; Э(Me)=23,25 М(Me) = 3*Э = 3*23,25 = 69,73 г/моль Это галий Ga3169.7 65. Газообразный этиловый спирт С2H5OH можно получить при взаимодействии этилена С2Н4(г) и водяных паров. Вычислите тепловой эффект этой реакции и напишите термохимическое уравнение. Сколько теплоты выделится, если в реакции было израсходовано 100 л этилена (н.у.)? (Ответ: 45,8 кДж; 204,5 кДж). Решение Тепловой эффект реакции, протекающей в условиях р=const, T=const, равен изменению энтальпии системы ∆Н и измеряется в кДж. Уравнения химических реакций, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими C2H4 + H2O =CH3-CH2OH +Q ∆Н0х.р = (с∆fН0С+ d∆fН0D) – (a∆fН0A+ b∆fН0B) = ∆fН0(CH3-CH2OH) - ∆fН0(H2O) –∆fН0 (C2H4) = –235,3 + 241,8 - 52,3 = -45,8 кдж/моль где ∆fН0 – стандартная энтальпия образования соединения. ∆fН0 (C2H4) = 52,3 кдж/моль ∆fН0(CH3-CH2OH)= –235,3 кдж/моль ∆fН0(H2O) = –241,8 кдж/моль Термохимическое уравнение запишется следующим образом: C2H4 + H2O =CH3-CH2OH +45,8 кдж/моль Так как ∆Н0х.р < 0, то понятно, что реакция экзотермическая идет с выделением тепла, тепловой эффект Q =-∆Н0х.р 100 л этилена (н.у.) составляют n(C2H4) = 100 л/22.4л = 4,464 моль, что выделяет Q = 45,8 кдж/моль г*4,464 = 204,5 кДж тепла Ответ: 45,8 кДж; 204,5 кДж). 85. Рассчитайте равновесную концентрацию О3 и константу равновесия в реакции 3О2(г) Решение C(O2)=24/32= 0,75 моль/л Прореагировало О2 0,75-0,6=0,15 моль/л Из этого количества кислорода на момент равновесия по химической реакции образовалось озона: 3моля О2---------------- дают ----2 моля О3, а 0,15 моля О2 -----------– х моля О3 Х= 0,15*2/3 = 0,1 моль/л - равновесная концентрация озона. К =[O3]2/[O2]3 =0,12/0,63 =0,01/0,216 = 0,046 Ответ: 0,1 моль/л; 0,046 105. Какие из солей: K2SO4, Na2SO3, NH4CN, LiCl, Fe2(SO4)3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. Какое значение pH (>7<) имеют растворы этих солей? Решение 1.Катионы сильных оснований и анионы сильных кислот не образуют с ионами воды слабых электролитов, поэтому соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. K2SO4, LiCl 2.Гидролизу подвергаются соли, образованные слабой кислотой и сильным основанием сульфит натрия Na2SO3 Na2SO3, + Н2О = NaНSO3 + NaОН Ионно-молекулярное уравнение: SO3 -2 + HOH = HSO3 -1 + OH- pH>7 Среда щелочная 3.Гидролизу подвергаются соли, образованные слабым основанием и сильной кислотой Fe2(SO4)3 : Fe2(SO4)3 + 2 Н2О = Fe2(OH)2 (SO4)2+ Н2 SO4 Ионно-молекулярное уравнение: Fe+3 +H2O = Fe (OH)+2 + H+ Среда кислая, рН<7 4. Гидролизу подвергаются соли, слабым основанием и слабой кислотой. Цианид аммония NH4CN NH4CN + H2O = NH4OH + HCN Ионно-молекулярное уравнение: NH4 +1 + CN -1+ H2O = NH4OH + HCN pH=7 среда нейтральная. 125. Исходя из степени окисления железа, определите, какое из веществ может быть только восстановителем, только окислителем и какое – и окислителем и восстановителем: FeSO4, Fe2O3, K2FeO4. Почему? На основании электронных уравнений подберите коэффициенты для веществ в уравнении реакции, идущей по схеме: CrCl3 + Br2 + NaOH Na2CrO4 + NaBr + NaCl + H2O Решение +2 +6 -2 FeSO4 – сульфат железа. Железо может иметь следующие степени окисления 0,+2,+3,+6. В этом соединении железо находится в степени окисления +2, , следовательно, сульфат железа ( +2) может быть и окислителем (в реакции с Mg), и восстановителем (в реакции c KMnO4). +3 -2 Fe2O3 - степень окисления железа +3, может быть и окислителем, и восстановителем +1 +6 -2 K2FeO4 - степень окисления железа +6, может быть только окислителем. CrCl3 + Br2 + NaOH Na2CrO4 + NaBr + NaCl + H2O Восстановитель 2|Cr+3 + 8OH-1- 3е CrO4-2 + 4H2O Окислитель 3|Br2 + 2е 2Br -1 2Cr+3 + 16OH-1+ 3Br2 2 CrO4-2 + 8H2O + 6Br-1 16Na+ +6Cl- 16Na+ +6Cl- 2CrCl3 + 3Br2 +16 NaOH = 2Na2CrO4 + 6NaBr + 6NaCl +8 H2O 145. Каково значение ЭДС элемента, состоящего из медного и свинцового электродов, погруженных в растворы солей этих металлов с концентрациями их ионов 1 моль/л? Изменится или нет ЭДС этого элемента и почему, если концентрации ионов металлов будут составлять 0.001 моль/л? Составьте уравнения электродных и токообразующей реакций. Приведите схему гальванического элемента. (Ответ: 0,463 В). Решение –(анод) PbPb2+||Cu2+Cu + (катод) Уравнения электродных реакций имеют вид: на аноде: Pb0 - 2ē Pb+2 на катоде: Cu2++ 2ē Cu 0 Токообразующая реакция: Pb0 + Cu2+ Pb+2 + Cu 0 Рассчитаем ЭДС элемента при концентрации ионов Cu2+ и Pb 2+, равных соответственно 1 и 0,001 моль/л, используя уравнения Нернста и табличные данные: Сu2+/Cu = 0Сu2+/Cu + 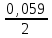 lg1 = 0,337 В lg1 = 0,337 В Pb 2+/ Pb = 0 Pb 2+/ Pb + 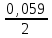 lg1= –0,126 В lg1= –0,126 ВE1 = Сu2+/Cu – Pb 2+/ Pb = 0,337 В – (–0,126 В ) = 0,463В Pb 2+/ Pb = 0 Pb 2+/ Pb + 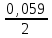 lg10-2 = –0,126 + 0,0295(–3) = –0,2145В lg10-2 = –0,126 + 0,0295(–3) = –0,2145ВСu2+/Cu = 0Сu2+/Cu + 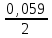 lg10-3 = 0,337 + 0,0295(–3) = 0,2485 В lg10-3 = 0,337 + 0,0295(–3) = 0,2485 ВE2 = Сu2+/Cu – Pb 2+/ Pb = 0,2485В – (–0,2145В ) = 0,463В ЭДС элемента не изменится, если концентрации ионов металлов будут составлять 0.001 моль/л Ответ: ЭДС элемента 0,463 В 165. Приведите по одному примеру катодного и анодного покрытия для кобальта. Составьте уравнения катодных и анодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении целостности покрытия Решение Цинк имеет меньшее значение потенциала (–0,763 В), чем кобальт (–0,277 В), поэтому он является анодом, а кобальт – катодом. Следовательно, цинк растворяется, а на поверхности кобальта идет восстановление деполяризатора: в кислом растворе – с водородной деполяризацией, во влажном воздухе – с кислородной деполяризацией. Анодный процесс: Zn – 2ē = Zn2+ Катодный процесс: в кислом растворе 2Н+ + 2ē Н2 во влажном воздухе О2 + 2Н2О + 4ē 4ОН– Схема образующегося гальванического элемента во влажном воздухе: (–)ZnZn2+| O2,H2O |OH–Cо(+). Схема образующегося гальванического элемента в кислом растворе: (–)ZnZn2+|НС1|H2Cо(+). Во влажном воздухе ионы Zn2+ с гидроксильными группами, выделяющимися на катоде, образуют малорастворимый гидроксид цинка Zn(ОН)2, который и является продуктом коррозии. В кислой среде на поверхности кадмия выделяется газообразный водород. В раствор переходят ионы Zn2+. Пример катодного покрытия – медное покрытие. По положению в ряду напряжений металлов видно, что кобальт более активный металл (0Сr3+/Cr = –0,277 В), чем медь (0Сu2+/Cu = 0,337 В). В образованной гальванической паре Cо – анод, он окисляется, а Cu – катод, на ее поверхности выделяется (восстанавливается) водород из НС1. Анодный процесс: Cо–3ē = Cо3+ Катодный процесс в кислой среде: 2Н+ + 2ē Н2 Схема гальванического элемента: (–)CоCо3+HClН2Cu(+) Появляющиеся ионы Cо3+ образуют с хлорид-анионами (из НС1) растворимое соединение – CоC13, на поверхности меди выделяется Н2. во влажном воздухе О2 + 2Н2О + 4ē 4ОН Схема образующегося гальванического элемента во влажном воздухе: (–)СоСо3+| O2,H2O |OH– Cu (+). Во влажном воздухе ионы Со3+ с гидроксильными группами, выделяющимися на катоде, образуют малорастворимый гидроксид цинка Со(ОН)3, который и является продуктом коррозии 185. Сколько граммов меди выделилось на катоде при электролизе раствора CuSO4 в течение 40 мин при силе тока 1,2 А? Приведите уравнения электродных процессов. (Ответ: 0,948 г). Решение В водном растворе сульфат меди(II) диссоциирует по схеме: CuSO4 = Cu2+ + SO42-. Электродный потенциал меди (+0,337 В) значительно больше потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде происходит процесс восстановления ионов Cu2+. При электролизе водных растворов сульфат-анионы не окисляются на аноде. На нем происходит окисление воды. Катод Cu2+, Н2О Анод SO42–, Н2О На катоде: Cu2+ + 2ē = Сu На аноде: 2Н2О – 4ē = 4Н+ + О2. Продукты электролиза – Сu и О2. У анода: 4Н+ + 2SO42– = 2Н2SO4 Первый и второй законы электролиза (Фарадея) описываются объединенным уравнением: m 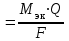 , где Q=It , где Q=Itm – масса вещества, выделившегося на электроде (г), Mэк. – молярная масса эквивалентов вещества, выделившегося на электроде (г/моль); Q – количество электричества, прошедшее через электролит (Кл); I – сила тока (А), t – время электролиза (с). F-число Фарадея =96500кл(а*сек) m 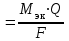 =31,7*40*60*1,2/96500= 0,947 г =31,7*40*60*1,2/96500= 0,947 гОтвет: 0,947 г |
