кислоты. Кислоты, их классификация, химические
 Скачать 58.67 Kb. Скачать 58.67 Kb.
|
|
Тема: Кислоты, их классификация, химические свойства и получение План 1. Классификация кислот. 2. Способы получения кислот. 3. Химические свойства кислот. 4. Окислительно-восстановительные свойства кислот. Кислоты — это соединения, состоящие из кислотных остатков и атомов водорода, способных замещаться атомами металлов с образованием солей. 1. Классификация кислот. По числу атомов водорода, способных замещаться на атомы металла, кислоты подразделяют на одноосновные (один атом водорода) и многоосновные (два атома водорода и более): НС1, HNO3 - одноосновные кислоты, H2SО4, Н2СrО4 — двухосновные и т. д. По составу различают бескислородные (НС1, HBr, H2S и кислородсодержащие (HNО3, Н3РО4 и др.) кислоты. 2. Способы получения кислот  Бескислородные кислоты получают прямым синтезом или действием на соль более сильной или менее летучей кислоты Бескислородные кислоты получают прямым синтезом или действием на соль более сильной или менее летучей кислотыН2 + С12 = 2НС1 FeS + 2НС1 = FeCl2 + H2S Полученные газообразные водородные соединения растворяют в воде. Кислородсодержащие кислоты получают взаимодействием кислотных оксидов с водой (кроме кремниевой кислоты) или действием на соль более сильной кислотой: Мn2О7 + Н2О = 2НМnО4 P2O5 + 3H2O = 2Н3РО4  K2SiО3 + 2НС1 = 2КС1 + H2SiО3 K2SiО3 + 2НС1 = 2КС1 + H2SiО3Получение серной кислоты в промышленности npoтекает в три стадии: первая — получение оксида серы (IV) обжигом серного колчедана (пирита), сульфидов цветных металлов (ZnS, PbS) или сжиганием серы: 4FeS2 + 11О2 = 2Fe2О3 + 8SО2 вторая — окисление оксида серы (IV) до оксида серы (VI): v2o5 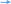 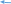 2SО2 + О2 2SО3 2SО2 + О2 2SО3третья — получение серной кислоты. Оксид серы (VI) поглощается концентрированной серной кислотой, и образуется олеум H2SO4, • nSO3). Разбавляя олеум водой, получают кислоту необходимой концентрации. Упрощенно можно записать уравнение: SО3 + Н2О = H2SО4 Получение азотной кислоты в промышленности также протекает в три стадии: первая — каталитическое окисление аммиака: pt 4NH3 + 5О2 = 4NO + 6Н2О вторая — окисление оксида азота (II) до оксида азота(IV): 2NO + О2 = 2NО2 третья — поглощение оксида азота(IV) водой в присутствии избытка кислорода: 4NО2 + 2Н2О + О2 = 4HNО3 3. Химические свойства кислот 1. Растворы кислот изменяют окраску индикаторов. 2. Кислоты, как и кислотные оксиды, взаимодействуют со всеми основаниями (реакция нейтрализации), основными и амфотерными оксидами, образуя соли и воду: НС1 + NaOH = NaCl + Н2О H2S+ 2КОН = K2S + 2Н2О MgO + H2SО4 = MgSО4 + H2О A12О3 + 6HNО3 = 2A1(NО3)3 + 3H2О 3. Кислоты вступают в реакции обмена с солями, если образующаяся соль относится к нерастворимым в воде и кислотах веществам или образующаяся кислота — к нерастворимым, слабым или непрочным кислотам:  AgNО3 + НС1 = AgCl + HNО3 Na2SiО3 + H2SО4 = H2SiО3 + Na2SО4 AgNО3 + НС1 = AgCl + HNО3 Na2SiО3 + H2SО4 = H2SiО3 + Na2SО4 СО2 СО2 Na2CО3 + 2HC1 = 2NaCl + H2CО3 Na2CО3 + 2HC1 = 2NaCl + H2CО3н2о  4. Сильные кислоты вытесняют более слабые или более летучие из их солей. Так, сильная и нелетучая серная кислота вытесняет слабую (Н3РО4) или летучую (HNО3) кислоты из их солей. 4. Сильные кислоты вытесняют более слабые или более летучие из их солей. Так, сильная и нелетучая серная кислота вытесняет слабую (Н3РО4) или летучую (HNО3) кислоты из их солей. Например: 2Na3PО4 + 3H2SО4 = 2Н3РО4 + 3Na2SО4 KNО3 + H2SО4 = HN03 + KHSО4 ТВ. КОНЦ.   5. Некоторые кислоты при нагревании разлагаются: 5. Некоторые кислоты при нагревании разлагаются:4HNО3 = 4NО2 + О2 + 2Н2О H2SiО3 = SiО2 + H2О * 4. Окислительно-восстановительные свойства кислот. Кислоты вступают в окислительно-восстановительные реакции. Бескислородные и кислородсодержащие кислоты в своем составе содержат атомы водорода в максимальной степени окисления, поэтому они проявляют окислительные свойства и взаимодействуют (за исключением азотной и концентрированной серной кислот) с металлами, расположенными в электрохимическом ряду напряжений до водорода, с образованием соли и выделением водорода (исключение азотная кислота): +1 +1 +1 НС1 H2S04 (разб.) СН3СООН окислитель окислитель окислитель  Zn + H2S04 = ZnS04 + Н2  разб. разб.Mg + 2CH3COOH = Mg(CH3COO)2 + H2 * Анионы бескислородных кислот проявляют восстановительные свойства за счет атома элемента, образующего кислоту, в минимальной степени окисления: НС1-1 HBr -1 H2S-2 восстановитель восстановитель восстановитель 16НС1-1 + 2KMn04 = 5С120 Т + 2МпС12 + 2КС1 + 8Н20 H2S -2 + 2FeCl3 = 2FeCl2 + S0 + 2HC1 Из курса химии 9 класса вам известно, что азотная и концентрированная серная кислоты — сильные окислители за счет элемента, образующего кислотный остаток. Анионы данных кислот содержат атомы азота и серы в максимальных степенях окисления: HN+503 – окислитель,H2S+604(конц.) – окислитель. Кислоты, которые проявляют окислительные свойства за счет элемента, образующего кислотный остаток, называют кислотами-окислителями. Эти кислоты окисляют многие сложные и простые вещества. Окисление сложных веществ: +2 -1 +5 +3 +6 +2 FeS2 + 8HN03 = Fe(N03)3 + 2H2S04 + 5NO + 2Н20 +6 -2 8KI + 5H2S04 = 4I2 + H2S + 4K2S04 + 4H20 конц. Вопросы и задания 1. В тексте лекции указаны два признака классификации кислот. Укажите еще три признака, по которым можно классифицировать кислоты. Ответ подтвердите примерами. 2. Напишите уравнения реакций в соответствии со схемами превращений: 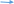   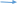 а) FeS2 X1 Х2 H2S04 BaS04 а) FeS2 X1 Х2 H2S04 BaS04    б) NH3 X1 Х2 HNO3 FeO Х3 б) NH3 X1 Х2 HNO3 FeO Х3Определите неизвестные вещества. В уравнениях окислительно-восстановительных реакций расставьте коэффициенты методом электронного баланса. 3. Напишите уравнения реакций взаимодействия между разбавленной серной кислотой и: a) Na2C03 (р-р); б) Ba(N03)2 (р-р); в) Mg; г) КОН (р-р). 4.Азотную кислоту можно получить по схемам:   а) KN03(р-р) + H2S04(p-p) ... в) NaN03(TB.) + HCI ... а) KN03(р-р) + H2S04(p-p) ... в) NaN03(TB.) + HCI ...  б) N02 + Н20 + 02 ... г) KN03 (тв.) + H2S04 (конц.) … б) N02 + Н20 + 02 ... г) KN03 (тв.) + H2S04 (конц.) …Напишите уравнения возможных реакций. 5. Серная кислота реагирует в растворе с каждым веществом расположенным в ряду: а) Cu(OH)2, Si02, ВаС12, МgО; в) Fe, Аg, Zn, Мg; б) Си, ВаС12, МgО, Ва(ОН)2; г) Na2C03, ZnO, Zn, МgО. Напишите уравнения реакций серной кислоты с этими веществами. |
