Белки. Конспект. Лабораторная 1. Кислотноосновные равновесия. Водородный показатель рН расчет, методы определения. Кислотноосновное равновесие
 Скачать 100.01 Kb. Скачать 100.01 Kb.
|
|
Кислотно-основные равновесия. Водородный показатель рН: расчет, методы определения. Кислотно-основное равновесие. Кислотно-основное равновесие – относительное постоянство соотношения кислота-основание внутренней среды живого организма. Является составной частью гомеостаза. Количественно характеризуется либо концентрацией водородных ионов (протонов) в молях на 1 л, либо водородным показателем pH. Кислотно-основное равновесие – соотношение определённой концентрации ионов Н+ и ОН- в органах, тканях, жидкостях организма. Кислотно-основное равновесие имеет первостепенное значение: Ионы Н+ являются катализаторами многих биохимических превращений; Ферменты и гормоны проявляют биологическую активность при строго определённых значениях рН; Наибольшие изменения концентрации ионов Н+ крови и межтканевой жидкости влияют на величину их осмотического давления. Основные показатели: В норме рН крови равно 7,4. Смещение рН в сторону увеличения – алкалоз, в сторону уменьшения - ацидоз. Различают респираторный и метаболический ацидоз и алкалоз. Парциальное давление СО2 в норме составляет 40 мм рт.ст. Снижение этого показателя наблюдается при дыхательном алкалозе и метаболическом ацидозе. Повышение давления СО2 отмечается при дыхательном ацидозе и метаболическом алкалозе. Щелочной резерв крови. Количество мл СО2, находящегося в крови, в расчете на 100 мл сыворотки крови. Норма – 55%. Уменьшение резервной щелочности свидетельствует об уменьшении содержания бикарбонатов в организме, а увеличение её – об их увеличении. Величина рН. Шкала рН и значения рН в организме человека. От величины рН зависит стабильность мембран, функции ферментов, диссоциация электролитов, нервно-мышечная возбудимость и проводимость, комплексообразование и другие процессы. Кислотно-основная система представляет собой соотношение между концентрациями активных масс водородных и гидроксильных (основных) ионов. Сдвиг рН на ± 0,1 по сравнению с физиологической нормой приводит к расстройству дыхания и кровообращения, на ± 0,3 – потере сознания, в диапазоне ± 0,4 – гибели организма.  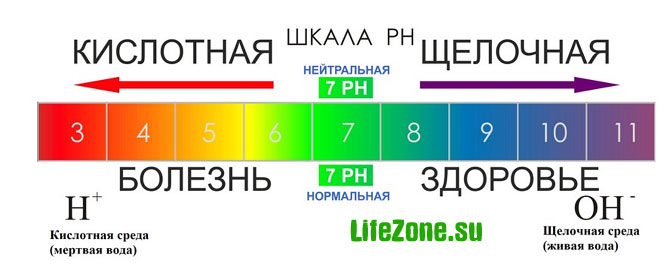 Значение pH в организме человека: pH мозг – 7,1 pH слюна – 6,0-7,4 pH желудочный сок = 1,0-3,5 pH желчь – 7,8 pH печень – 7,2 pH панкреатическая секреция – 8,0-8,3 pH моча – 4,5-8,0 pH кости – 7,4 pH мускулы – 6,9-7,2 pH секрет тонкой кишки – 7,5-8,0 pH венозная кровь – 7,3-7,35 pH артериальная кровь – 7,4-7,45 pH капиллярная кровь – 7,35-7,4 pH сердце - 7,0-7,4 Буферные системы и буферная ёмкость. Буферные растворы – растворы, поддерживающие определенную концентрацию ионов водорода (рН) при разбавлении и незначительно изменяющие ее при добавлении небольших количеств сильных кислот или щелочей. К ним относятся: 1. Растворы, содержащие слабую кислоту и соль этой кислоты и сильного основания (СН3СООН + СН3СООNa); 2. Растворы, содержащие слабое основание и соль этого основания и сильной кислоты (NH4OH + NH4Cl); 3. Растворы, содержащие смесь солей слабых многоосновных кислот (Na2HPO4 + NaH2PO4); 4. Растворы, содержащие смесь средней гидролизующейся соли и кислой соли этой же кислоты (NaHCO3 + Na2CO3). Расчет рН буферного раствора производят по формулам: Буферная смесь – количество вещества эквивалента сильной кислоты или щелочи, необходимое для смещения рН 1 л буферного раствора на одну единицу. 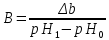 Буферная емкость раствора тем выше, чем больше концентрации компонентов и чем меньше эти концентрации различаются между собой. Разбавление раствора не влияет на изменение рН, но сильно влияет на величину буферной емкости. Поддержание постоянного уровня рН в крови и тканевых жидкостях достигается благодаря наличию нескольких буферных систем. Важнейшие буферные системы: 1. Гидрокарбонатная буферная система – равновесием молекул слабой угольной кислоты с образующимися при ее диссоциации гидрокарбонат-ионами: НСО3¯ + Н+ ↔ Н2СО3 НСО3¯ + Н2О ↔ Н2СО3 + ОН¯ 2. Фосфатная буферная система характеризуется равновесием: HPO42ˉ + H+ ↔ H2PO4¯ НРО42ˉ + Н2О ↔ Н2РО4¯ + ОН¯ 3. Буферная система оксигемоглобин-гемоглобин, на долю которой приходится приблизительно 75% емкости крови, характеризуется равновесием между ионами гемоглобина и самим гемоглобином. Таким образом, все буферные системы крови и тканевых жидкостей образуют единую взаимосвязанную систему. Основы метода потенциометрии. Уравнение Нернста. Стеклянный электрод. Потенциометрия – один из самых простых электроаналитических методов. Прежде всего он используется для измерения pH, а также для установления ионного состава биологических жидкостей (кровь, моча). Это также способ преобразования селективных взаимодействий в аналитических сигнал в молекулярных сенсорных устройствах или процессе химической реакции. Потенциометрия основана на измерении потенциала ячейки, т.е. разности потенциалов между двумя электродами в отсутствии тока во внешней цепи. Потенциал и область применения индикатора электрода зависят от его природы и селективности. Два приема: Прямая потенциометрия – измерение потенциала как функции активности определяемого компонента; Потенциометрическое титрование – измерение потенциала электрода как функции объема реагента, добавленного к пробе. Уравнение Нернста – уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. 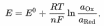 Стеклянные электроды – распространенные, удобные в обращении, ионоселективные электроды. С их помощью определяют рН растворов, концентрацию ионов Na+, K+. 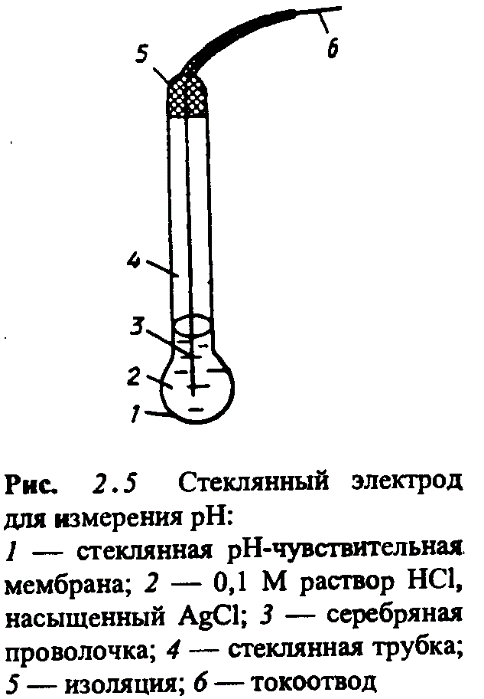 Пригоден для определения рН в интервале от 0 до 12. Для разных участков этого интервала применяют стеклянные электроды из разных стекол.  Недостатком стеклянного электрода является хрупкость стеклянной мембраны, а также возможность избирательной адсорбции некоторых ионов стеклянной поверхностью электрода, вследствие чего возникают ошибки при измерении. Недостатком стеклянного электрода является хрупкость стеклянной мембраны, а также возможность избирательной адсорбции некоторых ионов стеклянной поверхностью электрода, вследствие чего возникают ошибки при измерении. Стеклянные электроды для измерения рН применяют в приборах, называемых рН - метрами. Шкалы рН - метров градуированы в единицах рН. |
