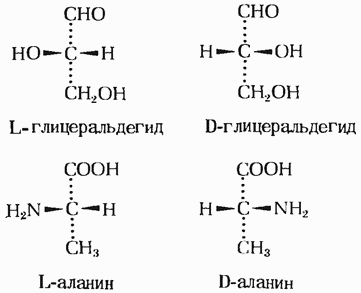1. Классификация органических веществ
К гетероциклическим относится соединение
а)аланин
б)глицерин
в)фенол
г)пиридин
К спиртам относится соединение
а)ацетон
б)глицин
в)глицерин
г)резорцин
Класс соединений, к которому относится молочная кислота
а)гидроксикислоты
б)кетокислоты
в)аминокислоты
г)сульфокислоты
Название класса соединений общей формулы R-S-R
а)тиолы
б)сульфиды
в)простые эфиры
г)сульфокислоты
Первичные амины имеют общую формулу
а)R-NH-R
б)H2N-R-COOH
в)R-CONH2
г)R-NH2
Соответствие между функциональной группой и ее формулой
1) гидроксильная Г) -ОН
2) аминнаяА) -NН2
3) карбоксильная В) -COOH
4) меркапто-группа Б) -SH
|
А) -NН2
Б) -SH
В) -COOH
Г) -ОН
Д) -NO2
Е) -SO3H
|
Соответствие между соединением и классом, к которому оно относится
|
пировиноградная кислота Д) кетокислоты
резоцинГ) фенолы
3) салициловая кислота А) гидроксикислоты
4)серный эфир Б) простые эфиры
|
Б) простые эфиры
В) сложные эфиры
Г) фенолы
Д) кетокислоты
Е) спирты
|
|
|
2. Номенклатура органических веществ
Тривиальное название 2-гидроксибензойной кислоты
а)салициловая
б)молочная
в)пировиноградная
г)щавелевая
Тривиальное название 2-гидроксипропановой кислоты
а)салициловая
б)молочная
в)пировиноградная
г)щавелевая
###Глицерин – тривиальное название пропантриола-1,2,3.
Название аминокислоты аланин по заместительной номенклатуре ИЮПАК
а)аминоуксусная кислота
б)2-амино-3-фенилпропановая кислота
в)2-аминопентандиовая кислота
г)2-аминопропановая кислота
Название ацетона по радикально-функциональной номенклатуре ИЮПАК
а)бутанон
б)пропанон
в)диметилкетон
г)метилфенилкетон
Название серного эфира по радикально-функциональной номенклатуре ИЮПАК
а)метилэтиловый эфир
б)диэтиловый эфир
в)этоксиэтан
г)метоксибензол
Соответствие между формулой соединения и его названием по заместительной номенклатуре ИЮПАК
|
СН3СН2ОН В) этанол
СН3СОН Е) этаналь
3) СН3СН2NН2Б) этанамин
|
А) этиловый спирт
Г) ацетальдегид
Д) анилин
|
|
| Изомерия органических веществ
Вещества, имеющие одинаковый состав, но разное строение называются ###Изомерия
Вещества, молекулы которых относятся друг к другу как предмет и несовместимое с ним зеркальное изображение, называются
а)гомологи
б)энантиомеры
в)аналоги
г)таутомеры
###2 – количество центров хиральности в молекуле треонина. (Запишите число)
###3 – количество структурных изомеров у фенола состава С6Н6О2. (Запишите число)
Соединение, для которого возможна оптическая изомерия
а)2-гидроксипропановая кислота
б)2-метилпропановая кислота
в)диметилэтиламин
г)уксусный альдегид
L-изомер аминокислоты аланина в проекции Фишера
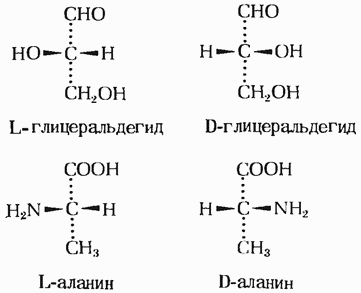
а) COOH в) COOH
|
*
|
|
|
|
*
|
|
|
|
CH3
|
|
CH3
|
б)
|
COOH
|
г)
|
COOH
|
|
*
|
|
|
|
*
|
|
|
H2NН HNH2
H2NН HNH2
CH2COOH CH2OH
Аминокислота, которая не имеет хирального центра
а)аланин
б)глицин
в)серин
г)лизин
22. Аминокислоты с двумя хиральными центрами существуют в виде ###2пар энантиомеров. (Запишите число)
Цис-транс изомерия возможна для кислоты
а)пировиноградной
б)молочной
в)масляной
г)олеиновой
Серный эфир и изобутиловый спирт являются
а)гомологами
б)геометрическими изомерами
в)структурными изомерами
г)энантиомерами
Строение органических веществ
Валентные электроны у атома углерода
а)2s22p2
б)2р2
в)2s2
г)1s22s22p2
Электронная конфигурация атома углерода в возбужденном состоянии
а)1s22s22p2
б)1s22s12p3
в)1s22s12p22d1
г)1s22s12p23s1
Соединение, в котором все атомы углерода находятся в sp3-гибридном состоянии
а)уксусная кислота
б)ацетальдегид
в)тирозин
г)глицерин
…4 – число пи-связей в молекуле салициловой кислоты. (Запишите число)
Одна из связей образована по донорно-акцепторному механизму в соединении
а)CH3NH3Cl
б)CH3NHCH3
в)CH3COOC2H5
г)CH3CH2ONa
Химическая связь, имеющая наибольшую длину
а)С–O
б)C–N
в)C–H
г)C–S
Межмолекулярная водородная связь может образовываться между молекулами
а)ацетона
б)коламина
в)серного эфира
г)ацетальдегида
Внутримолекулярная водородная связь образуется в молекуле
а)гидрохинона
б)салициловой кислоты
в)этанола
г)уксусной кислоты
Последовательность химических связей в порядке возрастания полярности
3), 2), 1), 4)
C–O
C–N
C–С
C=О
Последовательность веществ в порядке увеличения температур кипения
2), 4), 1), 3)
этанол
формальдегид
уксусная кислота
ацетальдегид
Классификация аминокислот в зависимости от строения бокового радикала
Гидроксильную группу в боковом радикале содержит аминокислота
а)треонин
б)аргинин
в)гистидин
г)пролин
Меркапто-группу в боковом радикале содержит аминокислота
а)метионин
б)цистеин
в)триптофан
г)валин
Аминокислота с гидрофобным боковым радикалом
а)серин
б)тирозин
в)фенилаланин
г)лизин
Формула аминокислоты аргинина в) (чет тут развалился он)
а) СН -СН-СООН в) HN2
N
С-NH-(CH
HNNH2 H2N2)3-СН-СООН=
NH2
б) NH2-(CH2)4-СН-СООН г) НООС-CH2-СН-СООН
NH2 NH2
Соответствие между аминокислотой и группой, к которой она относится
метионин
тирозин
аспарагиновая кислота
|
А) ароматические аминокислоты
Б) дикарбоновые аминокислоты
В) аминокислоты, содержащие амидную группу
Г) серосодержащие аминокислоты
Д) иминокислоты
|
Модифицированная аминокислота в составе белков
а)аспарагин
б)гидроксипролин
в)лизин
г)глутаминовая кислота
Соответствие между формулой аминокислоты и ее названием
1)
|
СH3-S-CH2-СН2-С Н-СООН
NH2
|
А) гистидин
Б) цистеин
В) аспарагин
|
2)
|
CH2-С Н-СООН
NH2
N
H
|
Г) триптофан
Д) метионин
Е) серин
|
3)
|
HO-CH2-С Н-СООН
NH2
|
|
Аминокислота, боковой радикал которой способен образовывать водородную связь а)метионин
б)валин
в)фенилаланин
г)тирозин
Кислотно-основная классификация аминокислот. Амфотерные свойства аминокислот
Кислая аминокислота
а)глутаминовая
б)гистидин
в)лизин
г)аспарагин
Нейтральная аминокислота
а)лизин
б)валин
в)аргинин
г)аспарагиновая
Аминокислота, которая в водном растворе дает щелочную реакцию среды
а)аланин
б)аспарагиновая
в)лизин
г)изолейцин
Последовательность аминокислот в порядке возрастания значения их изоэлектрической точки 3) , 2) , 1), 4)
1)лизин
валин
глутаминовая кислота
аргинин
Изоэлектрическая точка (pI) – рН среды, при котором содержание биполярного иона в растворе аминокислоты максимально.
Аминокислоты при взаимодействии с соляной кислотой проявляют свойства
а)кислотные
б)восстановительные
в)окислительные
г)основные
Формула биполярного иона глицина
а)–OOCCH2NH2
б)–OOCCH2NH3+
в)HOOCCH2NH3+
г)HOOCCH2NH2
Аминокислота глицин в сильно щелочной среде находится в виде
а)–OOCCH2NH2
б)–OOCCH2NH3+
в)HOOCCH2NH3+
г)HOOCCH2NH2
Классификация аминокислот в зависимости от их синтеза в организме человека
Аминокислоты, которые не синтезируются в организме человека и должны поступать с пищей, называются незаменимыми
Метионин – тривиальное название незаменимой серосодержащей аминокислоты.
Треонин – тривиальное название незаменимой гидрокси-аминокислоты.
Гистидин и аргинин – тривиальные названия частично заменимых аминокислот.
Частично заменимая аминокислота
а)глицин
б)валин
в)цистеин
г)аргинин
Незаменимая аминокислота
а)аланин
б)серин
в)лизин
г)глутамин
Фенилаланин относится к аминокислотам
а)незаменимым
б)условно заменимым
в)частично заменимым
г)заменимым
Соответствие между аминокислотой и группой, к которой она относится
-
триптофан
гистидин
глицин
цистеин
|
А) частично заменимая
Б) заменимая
В) условно заменимая
Г) незаменимая
|
Биологически важные реакции аминокислот
Серотонин образуется из аминокислоты
а)пролин
б)гистидина
в)фенилаланина
г)тирозина
д)триптофан
Соответствие между аминокислотой и продуктом ее декарбоксилирования
серин
гистидин
глутаминовая кислота
|
А) гистамин
Б) ГАМК
В) серотонин
Г) тирамин
Д) коламин
|
Ферменты, которые катализируют декарбоксилирование аминокислот
а)гидратазы
б)карбоксилазы
в)декарбоксилазы
г)аминотрансферазы
В результате прямого окислительного дезаминирования глутаминовой кислоты образуется кислота
а)щавелевоуксусная
б)альфа-кетоглутаровая
в)пировиноградная
г)гамма-аминомасляная
д)глутаровая
В результате внутримолекулярного дезаминирования гистидина образуется уроканиновая кислота и выделяется аммиак
Трансаминирование – ферментативная реакция межмолекулярного переноса аминогруппы от молекулы альфа-аминокислоты к молекуле альфа-кетокислоты.
Ферменты, которые катализируют трансаминирование аминокислот
а)амилазы
б)дезаминазы
в)ацилтрансферазы
г)аминотрансферазы
Соответствие между аминокислотой и образующейся при ее трансамиировании кетокислотой
-
аланин
аспрагиновая
глутаминовая
|
А) альфа-кетоглутаровая
Б) глутаровая
В) щавелевоуксусная
Г) ацетоуксусная
Д) пировиноградная
|
Классификация и основные функции белков
Белки, выполняющие каталитическую функцию, называются
а)гормоны
б)ферменты
в)витамины
г)нуклеозиды
1) простые 2)сложные
|
А) нуклеопротеины
Б) нуклеозиды
В) альбумины
Г) стерины
|
липопротеины
нуклеопротеины
фосфопротеины
гликопротеины
|
А) нуклеиновые кислоты
Б) фосфорная кислота
В) углеводы
Г) липиды
|
Соответствие между белком и его основной выполняемой функцией
-
гемоглобин
актин
коллаген
|
А) сократительная
Б) питательная
В) транспортная
Г) каталитическая
Д) структурная
|
Иммуноглобулины относятся к сложным белкам
а)гликопротеинам
б)нуклеопротеинам
в)фосфопротеинам
г)липопротеинам
Фибриллярный белок
а)гемоглобин
б)альбумин
в)кератин
г)инсулин
Фибриллярные белки имеют
а)нитевидную форму и хорошо растворяются в воде
б)сферическую форму и хорошо растворяются в воде
в)сферическую форму и обычно не растворяются в воде
г)нитевидную форму и обычно не растворяются в воде
Структурная организация белков
В состав белков входят
а)альфа-D-аминокислоты
б)бета-D-гидроксикислоты
в)альфа-L-аминокислоты
г)альфа-L-гидроксикислоты
Определенной последовательностью аминокислот в полипептидной цепи характеризуется первичная структура белка.
В полипептидной цепи аминокислоты соединены связью
а)водородной
б)пептидной
в)ионной
г)дисульфидной
Пептидная связь
а)-N=N-
б)-CO-O-CO-
в)-СH2-NH-
г)-СО-NH-
Вторичная структура белка может быть представлена спиральной и слоисто-складчатой формами.
В формировании вторичной структуры белка участвует химическая связь
а)водородная
б)пептидная
в)ионная
г)дисульфидная
Дисульфидные связи в белках образуются за счет остатков аминокислоты
а)лизина
б)серина
в)цистеина
г)метионина
82 574 количество полипептидных цепей, участвующих в образовании молекулы гемоглобина. (Запишите число)
Железо в составе гемоглобина имеет степень окисления
а)0
б)+2
в)+3
г)+6
В результате связывания гемоглобина с кислородом образуется
а)метгемогломин
б)нитрозогемоглобин
в)карбамингемоглобин
г)оксигемоглобин
Последовательность структур белковых молекул по мере их усложнения 2), 4), 1). 3)
третичная
первичная
четвертичная
вторичная
Свойства белков. Качественные реакции на аминокислоты и белки
Суммарный заряд белковой молекулы в изоэлектрической точке равен
(Запишите число) 0
Белок, у которого изоэлектрическая точка находится в кислой среде
а)химотрипсин
б)цитохром с
в)пепсин
г)гемоглобин
Высаливание – процесс осаждения белков с помощью концентрированных растворов солей.
Для выделения белков из растворов методом высаливания используют
а)азотную кислоту
б)гидроксид натрия
в)сульфат аммония
г)этиловый спирт
Процесс нарушения нативной конформации белковой молекулы под действием различных дестабилизирующих факторов
а)денатурация
б)высаливание
в)гидролиз
г)фолдинг
Последовательность образующихся продуктов при ферментативном гидролизе белков в организме 2), 1), 4), 3)
ди- и трипептиды
белки
аминокислоты
пептиды
Качественная реакция на пептидную связь
а)нингидриновая
б)ксантопротеиновая
в)Фоля
г)биуретовая
Реакцию Фоля используют для качественного обнаружения в белках
а)серосодержащих аминокислот
б)пептидых связей
в)водородных связей
г)ароматических аминокислот
С помощью ксантопротеиновой реакции можно обнаружить в белках аминокислоту а)аланин
б)метионин
в)серин
г)тирозин
При проведении ксантопротеиновой реакции в качестве реагента используют
а)гидроксид меди (II)
б)оксид серебра
в)азотную кислоту
г)ацетат свинца (II)
|
 Скачать 40.46 Kb.
Скачать 40.46 Kb.