Тесты химия. Классы соединений
 Скачать 226.13 Kb. Скачать 226.13 Kb.
|
"Растворы. Перманганатометрия как метод объемного количественного анализа.В зависимости от типа химических реакций, которые лежат в основе количественных определений, титриметрические методы анализа подразделяются на несколько основных типов. Укажите, к какому типу относится метод перманганатометрии: Метод оксидиметрии; В клинической лаборатории проводили определение в крови ионов кальция методом перманганатометрического титрования. Укажите соединение, которое необходимо использовать для создания необходимого значения рН среды в данном методе анализа: H2SO4 В одном из методов титриметрического анализа в качестве вещества-окислителя используют дихромат калия K2Cr2O7. Укажите степень окисления хрома в данном соединении: +6; В основе качественного и количественного анализа лежат окислительно-восстановительные реакции. Укажите характеристику, изменение которой всегда происходит при протекании данных реакций: Степень окисления В титриметрическом анализе важное значение имеет понятие молярной массы эквивалента.Укажите, чему равна данная величина (г/моль) для Аl(NO3)3 . 71 Для проведения перманганатометрического титрования необходимо приготовить 500 мл рабочего раствора KMnO4 с молярной концентрацией эквивалента 0,2 моль экв/л. Определите в граммах массу веществаKMnO4: 3,16; Для количественного определения пероксида водорода в таблетках «Гидроперит» фармацевту необходимо приготовить 0,01 н раствор перманганата калия. Укажите формулу, которой он может воспользоваться для расчета массы вещества: Для проведения анализа необходимо приготовить 0,1 моляльный раствор хлорида кальция. Укажите единицы измерения данной концентрации: моль/кг; Для проведения перманганатометрического титрования необходимо приготовить 300 мл раствора KMnO4 с молярной концентрацией эквивалента 0,4 моль экв/л. Определите массу навески перманганата калия в граммах: 3,79; Концентрация приготовленного раствора указывает число моль-эквивалентов растворенного вещества, содержащиеся в 1000 мл раствора. Укажите тип данной концентрации: Нормальная Марганец (Mn) – элемент с переменной валентностью. Укажите, чему равна степень окисления этого элемента в сульфате марганца MnSO4 . + 2; Марганец образует ряд оксидов. Укажите соединение, у которого наиболее ярко выражены основные свойства: MnO Метод перманганатометрии предусматривает применение растворов с точной молярной концентрацией эквивалента. Укажите посуду, которую используют для приготовления данных растворов: Мерные колбы; Метод перманганатометрии предусматривает титрование в кислой среде. Укажите, почему для создания данной среды нельзя использовать азотную кислоту. Является сильным окислителем; О способности веществ проявлять окислительно-восстановительные свойства можно судить по степени окисления атомов элементов, входящих в данное вещество. Укажите соединение, обладающее окислительно – восстановительной двойственностью: Na2SO3 Окончание титрования в методе перманганатометрии определяют по точке эквивалентности. Укажите способ определения этой точки в данном методе анализа: Появление розовой окраски; Определение окисляемости воды проводят методом перманганатометрического титрования. Укажите одно из условий проведения данного метода титрования: Кислая среда; Перманганат калия применяют в медицинской практике как бактерицидный препарат. Укажите химические свойства, которые обуславливают его антимикробную активность: Окислительные; Перманганат калия, обладающий противомикробным действием, находит широкое применение в медицине. Укажите (в %) массовую долю данногосоединения в растворе, применяемого для обработки язв и ожогов: 5,0 При расчете молярной концентрации эквивалента растворенного вещества используют фактор эквивалентности. Укажите, чему он равен для соединения Al2(SO4)3: 1/6 При определении концентрации вещества методом перманганатометрии необходимо приготовить 200 мл раствора KMnO4 с молярной концентрацией эквивалента 0,1 моль-экв/л. Определите массу навескиKMnO4 в граммах: 0,63; При проведении перманганатометрического анализа студент должен установить титр рабочего раствора перманганата калия. Укажите единицы измерения данной величины: г/мл; При решении задачи возникла необходимость найти массу вещества, исходя из молярной концентрации эквивалента. Укажите формулу, которую можно применить для расчета: При титровании методом перманганатометрии необходимо учитывать кислотность среды. Укажите, почему данный метод анализа нежелательно проводить в нейтральной среде: Образуется бурый осадо Продукты восстановления калия перманганата зависят от характера среды. Укажите среду, в которой проводят титрование в перманганатометрии: Сильнокислая Рабочий растворKMnO4 по точной навеске кристаллического препарата приготовить невозможно, так как в нем всегда содержатся примеси. Укажите соединение, используемое для определенияточной концентрации раствора перманганата калия: Щавелевая кислота Среди соединений хлора укажите вещество, обладающее наиболее ярко выраженной окислительной активностью: НClО4 Студент получил задание: для проведения перманганатометрического титрования приготовить 100 мл раствора KMnO4 с молярной концентрацией эквивалента 0,5 моль/л. Определите в граммах массу веществаKMnO4: 1,58; Титрование в методе перманганатометрии проводится в кислой среде. Укажите, почему для этой цели не используют раствор НСl; Проявляет восстановительные свойства; Титрованный раствор калия перманганата по точной навеске кристаллического препарата приготовить невозможно. Укажите причину данного явления: Содержит примеси; Укажите кислоту, которую используют в перманганатометриидля поддержания нужного уровня рН: H2SO4 Кислотно-основное равновесие в организме. Водородный показательЗначение рН желудочного сока приблизительно равно 2. Определите концентрацию гидроксильных ионов (моль/литр) в данной биологической среде. [OH ] = 10 12; У больного рН мочи равно 5,1. Укажите, какой цвет примет лакмусовая индикаторная бумага в данной биологической жидкости. Красный; При изменении кислотно-основного состоянияорганизмаможитразвиться алкалоз. Укажитераствор, которыйнеобходимоприменить напервойстадиилечения. 5% p-p аскорбиновой кислоты; Молярная концентрация водородных ионов [Н+] составляет 1,0∙10 - 8 моль/л. Определите рН данного раствора. 4, среда щелочная;, 8, среда кислая;, 9, среда щелочная;, рН, 8, среда щелочная;, 6, среда кислая При нарушении кислотно-щелочного баланса в организме может развиться ацидоз. Укажите изменения, которые будут при этом происходить в крови. Уменьшение рН крови. В растворах имеет место кислотно-основное равновесие, обусловленное переносом протона. Укажите, согласно протолитической теории, название веществ, которые являются донорами протонов. Кислоты Для выражения кислотности среды используют водородный показатель. Укажите определение, которое характеризует данную величину. Отрицательный десятичный логарифм концентрации ионов водорода; Согласно протолитической теории Бренстеда-Лоури, кислоты - это доноры протонов, а основания - акцепторы протонов. Укажите сопряженную кислоту и сопряженное основание в следующем примере: NH3 + H2O ↔ NH4+ + OH- . NH4+- сопряженная кислота, OH- - сопряженное основание Часто вместо абсолютных значений молярной концентрации ионов H+ пользуются водородным показателем. Укажите математическое выражение данной величины. рН = -lg [Н+] ; Величина, связывающая между собой концентрации водородных и гидроксильных ионов, называется ионное произведение воды. Укажите уравнение, описывающее данную характеристику. Kw = [H+] [OH]; Вода - слабый электролит. Укажите, чему равна ее константа диссоциации при 22 оС: 10 -16. При диагностике заболевания необходимой частью анализа биологических жидкостей является определение рН. Укажите название инструментального средства, с помощью которого определяют данный показатель. Иономер; Вода является слабым электролитом и диссоциирует по следующей схеме: Н2О ↔ H+ + OH-. Укажите определение, характеризующее ионное произведение воды. Произведение концентраций ионов водорода и гидроксил-ионов; Согласно протолитической теории Бренстеда-Лоури, кислоты - это доноры протонов, а основания - акцепторы протонов. Укажите сопряженную кислоту и сопряженное основание в следующем примере: СН3СООН + H2O ↔ СН3СОО - + H3O+ . H3O+- сопряженная кислота, СН3СОО- - сопряженное основание; Активность ферментов слюны находится в определенном интервале значений рН. Укажите диапазон рН, в котором наиболее активны ферменты данной биологической жидкости. 6,35-6,85; Концентрация ионов гидроксила в исследуемом растворе равна 1·10-12моль/л. Укажите рН раствора и характер среды. 12, среда щелочная;, 2, среда слабощелочная;, 12, среда слабощелочная;, pH, 2, среда сильнокислая;, 2, среда слабокислая Концентрации [H+] и [OH-] в растворе ] величины сопряженные. Укажите уравнение, связывающее эти показатели при 22 С. [Н+] · [ОН] = 10 -14 . При сильной рвоте изменяется рН крови, что приводит к возникновению алкалоза. Укажите рН крови, характерное для данной патологии. 7,00 Тканевыекатепсины катализируют синтез белков при рН=7. Определите, кислотность среды, которая отвечает данному значению рН. Нейтральная; Для размножения холерных эмбрионов оптимум рН лежит в пределах 8,3-9,4. Укажите, какая среда отвечает данному значению рН. Щелочная; Буферные растворы При работе в лаборатории для поддержания рН студенты использовали формиатную буферную систему. Укажите компоненты, которые входят в ее состав. HCOOH + HCOONa; При выборе буферной системы с нужным значением рН основную роль играет рКд слабого электролита. Укажите, при каком условии рН= рКд слабого основания, которое входит в состав буферного раствора. Правильные ответы: Соотношение Соснования: Ссоли в составе буферного раствора равно 1;, Н2PO4 –; Na +; НPO4 2–; При проведении исследований необходимо было подобрать основный буфер с диапазоном рН 8,4-10,3. Укажите, какую из перечисленных ниже систем выберут для работы: Аммонийная; Буферные системы поддерживают рН крови на постоянном уровне при добавлении небольших количеств сильных кислот и оснований, а так же при концентрировании и разбавлении. Укажите возможные составляющие данных систем. Слабая кислота и ее соль с сильным основанием; При работе в лаборатории для поддержания рН студенты использовали ацетатную буферную систему. Укажите компоненты, которые входят в ее состав: CH3COOH + CH3COONa; Гидрокарбонатная буферная система является одной из основных буферных систем крови. Укажите, почему при добавлении к данному буферному раствору определенного количества КОН, рН не изменяется. КОН заменяется эквивалентным количеством воды; Ацетатный буфер позволяет регулировать концентрации ионов водорода и гидроксид-ионов. Укажите рН ацетатного буфера, если соотношение компонентов Ссоли : Скислоты = 2 : 1 (рКа уксусной кислоты = 4,8; lg 2 =0,3). 5,1; Фосфатная буферная система входит в состав буферных систем организма. Укажите, почему при добавлении к данному буферному раствору определенного количества HCl, рН не изменяется. HCl заменяется эквивалентным количеством NaH2РO4; В биохимических лабораториях часто используют бикарбонатную буферную систему. Укажите частицы, которые содержатся в данном буферном растворе. НСO3 –; СO32–; Na + ; Н+ В лаборатории имеется несколько ацетатных буферных систем с различным содержанием компонентов. Укажите, какой из них обладает наибольшей емкостью. 50 мл 0,1 М р-ра кислоты и 50 мл 0,1 М р-ра соли При работе в лаборатории для поддержания рН студенты использовали аммонийную буферную систему. Укажите компоненты, которые входят в ее состав. NH3 ·H2О + NH4Cl; При проведении клинического анализа крови пациента после длительного голодания, было определено рН плазмы, которое составило 7,3.Определите кислотно-основное состояние крови по данному показателю. Ацидоз; Кислотно-щелочное состояние организма оценивается с помощью уравнения Гендерсона-Гассельбаха. Укажите, какую величину позволяет определить данное уравнение: рН буферной системы; В лаборатории для работы необходимо было подобрать кислотный буфер с диапазоном рН 3,7-5,6. Укажите, какую из перечисленных ниже систем выберут для работы. Ацетатная; В биохимических исследованиях часто применяют ацетатную буферную систему. Укажите частицы, которые содержатся в данном буферном растворе. СН3СОО–; Н+ ; Na +; В крови, моче, пищеварительных соках содержится фосфатный буфер, который имеет значение рН от 5,9 до 7,8, в зависимости от соотношения компонентов. Укажите, какие компоненты могут образовывать данный буфер. NaH2PO4 и Na2HPO4; Самыми мощными буферными системами крови являются гемоглобиновая и оксигемоглобиновая. Укажите, с каким свойством гемоглобина связано его буферное действие. Со способностью проявлять свойства кислот; В клинике при анализе крови зачительный интерес представляет экспериментальное определение содержания СО2 в крови. Укажите в каком виде содержится данный ион в крови. Растворимые гидрокарбонаты – HCO3 –; Фосфатная буферная система является одной из буферных систем организма. Укажите, почему при добавлении к данному буферному раствору определенного количества NaОН, рН системы не изменяется. Избыток ионов ОН– связывается в воду рН плазмы крови имеет постоянное значение – 7,36, которое обеспечивается бикарбонатным буфером крови. Пользуясь формулой Гендерсона-Хассельбаха, рассчитайте соотношение компонентов Ссоли : Скислоты в гидрокарбонатном буфере, если рН=7,6 (рКа угольной кислоты = 6,6). 10 : 1; Студенту необходимо рассчитать рН гидрокарбонатного буфера, воспользовавшись уравнением Гендерсона-Хассельбальха, при соотношении компонентов Ссоли : Скислоты = 2 : 1 (рКа угольной кислоты = 6,1; lg 2 =0,3). Укажите правильный ответ: 6,4; Лаборанту необходимо приготовить 50 мл ацетатного буфера, обладающего наибольшей буферной емкостью. Укажите соотношение компонентов, которое он выберет для приготовления данной буферной системы. 25 мл 0,2 М р-ра кислоты и 25 мл 0,2 М р-ра соли; В клинике при анализе крови значительный интерес представляет определение резервной щелочности крови. Укажите определение, характеризующее данный показатель. Количество мл СО2 в 100мл плазмы крови; Очень важной буферной системой организма является гидрокарбонатная система. Укажите компоненты, которые входят в ее составH2CO3 + NaHCO3; Для поддержания постоянным рН раствора в лабораториях применяют ацетатный буфер. Укажите, почему при добавлении к данной буферной системе определенного количества сильной кислоты HCl рН раствора не изменяется. HCl заменяется эквивалентным количеством СН3СООH; Фосфатная буферная система входит в состав буферных систем организма. Укажите ионы, которые содержатся в данном буферном растворе. Н2PO4 –; Na +; НPO4 2–; На лабораторно-практическом занятии проводилось определение рН буферных систем и сравнение полученных показателей с расчетными данными. Укажите уравнение Гендерсона-Хассельбаха, которое необходимо применить для фосфатного буфера.  Студенты на занятии готовили аммонийные буферные растворы с заданным значением рН и сравнивали полученные показатели с расчетными данными. Укажите уравнение Гендерсона-Хассельбаха, которое необходимо применить для расчетов.  Студенту при решении задачи необходимо рассчитать буферную емкость. Укажите, формулу позволяющую рассчитать данную величину. 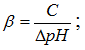 Уравнение Гендерсона-Хассельбальха применяется для определения рН буферной системы, а так же для расчета количества компонентов при приготовлении буферных растворов по заданному значению рН. Укажите, какой вид имеет данное уравнение для бикарбонатного буферного раствора.  Коллигативные свойства растворов. В хирургии для очищения гнойных ран используют марлевые повязки, смоченные в растворе NaCl. Укажите процентную концентрацию раствора, который может быть использован при этом. 10. При работе в лаборатории необходимо было рассчитать повышение температуры кипения разбавленного раствора электролита NaNO3. Укажите формулу, необходимую для расчета. Δtкип. = 2ЕСm. В клинической практике при больших кровопотерях больному вводят физиологические растворы. Укажите данный раствор. 5,0% раствор глюкозы; При помещение клеток в гипертонический раствор наблюдается их сморщивание. Укажите, как называется это явление. Плазмолиз; В клинической лаборатории проводили определение молекулярной массы растворенного вещества, измерив температуру замерзания раствора и растворителя. Укажите методом, каким воспользовались при этом определенииКриометрия; При помещении эритроцитов в раствор, изотоничный крови, сохраняется их нормальное состояние. Укажите раствор изотоничный крови. 5 % глюкозы; Для определение чистоты органических веществ, используя криометрический метод, основанный на измерении температуры замерзания растворов. Укажите фактор, от которого зависит криоскопическая константы в данном методе. Природы растворителя; При определении молекулярной массы вещества необходимо рассчитать понижение температуры замерзания раствора электролита. Укажите формулу для расчета. Δtзам. = iKCm; В биохимических исследованиях понижение температуры замерзания крови называют «депрессией». Укажите определение, характеризующее данное понятие. Понижение температуры замерзания плазмы крови по сравнению с водой; В медицинской практике при сильном обезвоживании больному вводят физиологические растворы. Укажите данный раствор. 0,85-0,9% раствор NaCl; Для расчета осмотического давления растворов электролитов используется изотонический коэффициент і.. Укажите формулу для его расчета. i = 1 + α (β - 1) Для расчета осмотического давления плазмы крови вводится изотонический коэффициент. Укажите фактор, от какого он зависит. Степень диссоциации растворенного вещества; Действие слабительных - горькой соли MgSO4•7H2O и глауберовой соли Na2SO4•10H2O основано на определенном физико-химическом явлении. Укажите его. Осмос; Перемещение веществ в клетку и из нее осуществляется при помощи осмоса. Укажите, что является причиной возникновения этого явления. Два раствора с разной концентрацией, разделенные полупроницаемой мембраной; При работе в лаборатории необходимо было рассчитать повышение температуры кипения разбавленного раствора электролита NaCl. Укажите формулу, необходимую для расчета. 3 Измерение осмотического давления осуществляется определенным прибором. Укажите название этого прибора. Осмометр; При изучении явления гемолиза помещали эритроциты в растворы с различной концентрацией хлорида натрия. Укажите процентную концентрацию раствора, в котором будет наблюдаться данное явление. 0,2; Осмотическое давление крови человека при 37°С имеет определенное значение. Укажите это значение в атмосфера. 7,7; При изучении явления плазмолиза проводилось погружении эритроцитов клетки в растворы с различной концентрацией хлорида натрия. Укажите процентную концентрацию раствора, в котором будет наблюдаться данное явление. 3,5 При работе в лаборатории необходимо было рассчитать повышение температуры кипения разбавленного раствора электролита Na2SO4. Укажите формулу, необходимую для этого расчетаΔtкип. = 3ЕСm; |
