Классификация индикаторов стерильности. Классификация индикаторов стерильности
 Скачать 221.97 Kb. Скачать 221.97 Kb.
|
|
Государственное Бюджетное Профессиональное Образовательное Учреждение «Армавирский Медицинский Колледж» Министерства Здравоохранения Краснодарского края Реферативное сообщение по дисциплине УП.04 Выполнение работ по профессии младшая медицинская сестра по уходу за больными Тема: «Классификация индикаторов стерильности» Выполнила студентка группы 2МС подгруппа 1 Кустрей Кристина Проверил преподаватель Золотарёва Н.С. СОДЕРЖАНИЕ Y ВВЕДЕНИЕ 3 Основные нормативные документы 5 Стерилизация 6 Физические методы стерилизации 7 Паровой метод стерилизации 7 Воздушный метод стерилизации 8 Химические методы стерилизации 10 Стерилизация растворами химических средств 10 Стерилизация газовым методом 12 Радиационный метод (гамма-излучения) 14 Методы контроля эффективности стерилизации 15 Физические методы 15 Химические методы контроля 16 Классификация индикаторов 16 Индикаторы процесса (класс 1) 16 Однопараметрические индикаторы (класс 3) 17 Многопараметрические индикаторы (класс 4) 17 Интегрирующие индикаторы (класс 5) 18 Имитирующие индикаторы (класс 6) 18 Биологический метод 19 Контроль стерильности изделий медицинского назначения 22 ЗАКЛЮЧЕНИЕ 24 Список использованной литературы 25 ВВЕДЕНИЕВ соответствии с требованиями международных стандартов при поставке стерильной продукции дополнительное микробиологическое загрязнение медицинских изделий от любых источников должно быть сведено к минимуму всеми доступными средствами. Даже при производстве изделий в стандартных условиях в соответствии с системой качества на них до стерилизации могут в малых количествах находиться микроорганизмы. Такие изделия нестерильны. Цель процесса стерилизации и стерилизантов состоит в том, чтобы уничтожить микробиологические контаминанты и, таким образом, преобразовать нестерильные изделия в стерильные. Само слово стерилизация (от лат. sterilis - бесплодный) - полное освобождение различных веществ и предметов от живых микроорганизмов. Понятие стерилизации обозначает уничтожение всех способных к размножению микробов. Особенно важно, что при стерилизации уничтожаются также споры. Поэтому однозначным требованием является следующее: все медицинские инструменты и предметы ухода за пациентом, проникающие в стерильные в норме ткани, сосуды, или контактирующие с кровью и инъекционными растворами, считаются "критическими" предметами. К ним, например, относятся: хирургические инструменты, мочевые и сосудистые катетеры, иглы. Критические инструменты представляют высокий риск инфицирования в случае их микробной контаминации. Таким образом, предметы медицинского назначения этой категории должны быть подвергнуты стерилизации. Большим преимуществом стерилизации, помимо ее действенности, является возможность ее автоматизированного проведения, а также сравнительно непродолжительное время процесса. Однако, следует учитывать, что все методы стерилизации требуют предварительной подготовки изделий, предназначенных для стерилизации (отмывки, сушки и упаковки), а также их транспортировки к стерилизатору. Основные нормативные документы В соответствии со сложившейся в нашей стране концепцией, технологический процесс стерилизации изделий медицинского назначения включает следующие этапы: дезинфекцию использованных изделий, предстерилизационную очистку и собственно стерилизацию. Основные нормативные документы, регламентирующие требования к соблюдению дезинфекционного режима в лечебно-профилактических учреждениях: - Федеральный Закон "О санитарно-эпидемиологическом благополучии населения" № 52 - ФЗ от 30.03.1999 г.; - СанПиН 2.1.3.1375 - 03 "Гигиенические требования к размещению, устройству, оборудованию и эксплуатации больниц, родильных домов и других лечебных стационаров"; - СП 3.1.958-99 "Профилактика вирусных гепатитов. Общие требования к эпидемиологическому надзору за вирусными гепатитами"; - СП 3.5.1378 - 03 "Санитарно-эпидемиологические требования к организации и осуществлению дезинфекционной деятельности"; - приказ МЗ СССР от 03.09.1991 г. "О развитии дезинфекционного дела в стране"; - отраслевой стандарт ОСТ № 42-21-2-85 "Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы"; - МУ от 30 декабря 1998 г. № 287-113 "Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения"; - МУ от 28.02.1991 г. № 15/6-5 "Методические указания по контролю работы паровых и воздушных стерилизаторов"; - руководство Р 3.1.683-98 "Использование ультрафиолетового бактерицидного облучения для обеззараживания воздуха и поверхностей в помещениях"; - методические указания по применению конкретного препарата, используемого для дезинфекции и (или) предстерилизационной очистки, а также стерилизации медицинского инструментария. Стерилизация — это полное уничтожение микроорганизмов и их спор. Методы, средства и режимы стерилизации изделий медицинского назначения определены стандартом ОСТ 42 – 21 – 2 – 85. Медицинские изделия, проникающие при манипуляциях в стерильные в норме ткани организма пациента, контактирующие с кровью и инъекционными препаратами, относят к так называемым "критическим", представляющим высокий риск инфицирования пациента в случае микробной контаминации этих изделий. С учетом имеющихся данных о вспышках инфекций, связанных с неадекватной обработкой изделий, применяемых в хирургической практике, важная роль отводится стерилизации изделий, в частности, хирургическим инструментам. Стерилизация Стерилизация – это уничтожение не только вегетативных форм микроорганизмов, но и их спор. Стерилизации должны подвергаться все изделия, соприкасающиеся с раненой поверхностью, контактирующие с кровью или инъекционными препаратами, и отдельные виды медицинских инструментов, которые в процессе эксплуатации соприкасаются со слизистой оболочкой и могут вызвать ее повреждения. Методы стерилизации: Стерилизацию осуществляют физическими (паровой, воздушный, в среде нагретых шариков) химическими (применение растворов химических средств, газовый) методами в промышленных условиях используют радиационный метод (гамма-излучения). Выбор адекватного метода стерилизации зависит от особенностей стерилизуемых изделий. Физические методы стерилизации Паровой метод стерилизацииПри паровом методе стерилизации стерилизующим средством является водяной насыщенный пар под избыточным давлением 0,05 МПа (0,5 кгс/см2) 0,21 МПа (2,1 кгс/см2) температурой 110 - 135 °C; стерилизацию осуществляют в паровых стерилизаторах (автоклавах). Паровым методом стерилизуют общие хирургические и специальные инструменты, детали приборов и аппаратов из коррозионно-стойких металлов, стекла, шприцы с пометкой 200 °C, хирургическое белье, перевязочный и шовный материал, изделия из резин (перчатки, трубки, катетеры, зонды и т.д.), латекса, отдельных видов пластмасс. Стерилизационные коробки (биксы) не являются упаковкой для хранения простерилизованных изделий. Хирургическое белье, перевязочный материал укладывают в стерилизационные коробки параллельно движению пара. Резиновые перчатки перед стерилизацией пересыпают внутри и снаружи тальком для предохранения их от склеивания. Между перчатками прокладывают марлю или бумагу, каждую пару перчаток заворачивают отдельно в марлю или бумагу и в таком виде помещают в стерилизационную коробку или в другую упаковку. В целях уменьшения неблагоприятного воздействия пара резиновые перчатки, как и другие изделия из резин, стерилизуют при температуре 120 - 122 °C. Паровым методом стерилизуют лигатурный шовный материал: нити хирургические шелковые крученые, нити хирургические капроновые крученые, шнуры хирургические полиэфирные (далее - лигатурный шовный материал). Лигатурный шовный материал готовят к стерилизации в виде косичек, мотков, наматывая на катушки, стеклянные палочки и т.д. Подготовленный лигатурный шовный материал заворачивают в два слоя упаковочного материала (при размещении в стерилизационной коробке в один слой упаковочного материала) в количестве, рассчитанном на одну операцию. На упаковке отмечают вид шовного материала и его номер. Нити хирургические капроновые крученые стерилизуют паром только при температуре 120 - 122 °C; лигатурный шовный материал других перечисленных видов допускается стерилизовать, кроме того, при температуре 130 - 134 °C. Лигатурный шовный материал хранят в той же упаковке, в которой он был простерилизован, в специальных шкафах для стерильных изделий. Неиспользованный стерильный лигатурный шовный материал в случае нарушения условий или истечения срока хранения может быть повторно (еще лишь один раз) простерилизован паровым методом при температуре 120 122 °C. Режимы паровой стерилизации 132 °C — 2 атмосферы(2 кгс/см2) — 20 минут — основной режим. Стерилизуют все изделия (стекло, металл, текстиль, КРОМЕ РЕЗИНОВЫХ). 120 °C — 1,1 атмосфера(1,1 кгс/см2) — 45 минут — щадящий режим. (стекло, металл, резиновые изделия, полимерные изделия — согласно паспорту, текстиль) 110 °C — 0,5 атмосферы(0,5 кгс/см2) — 180 мин — особо щадящий режим(нестойкие препараты, пит.среды) Воздушный метод стерилизацииДля проведения обработки используют воздушные стерилизаторы — ГИСС. В ОСТ 42–21–2–85 приводятся режимы стерилизации изделий медицинского назначения с использованием сухого горячего воздуха: 1) 180°С при времени экспозиции 60 минут. 2) 160°С при времени экспозиции 150 минут. Весь цикл работы стерилизатора включает время на разогрев стерилизатора, время на стерилизацию аппарата и обычно составляет 2–4 часа в зависимости от объема стерилизационной камеры и количества стерилизуемых изделий. При воздушном методе стерилизации стерилизующим средством является сухой горячий воздух температурой 160 °C и 180 °C; стерилизацию осуществляют в воздушных стерилизаторах. Воздушным методом стерилизуют хирургические, гинекологические, стоматологические инструменты, детали приборов и аппаратов, в том числе изготовленные из коррозионно-нестойких металлов, шприцы с пометкой 200 °C, инъекционные иглы, изделия из силиконовой резины. Перед стерилизацией воздушным методом изделия после предстерилизационной очистки обязательно высушивают в сушильном шкафу при температуре 85 °C до исчезновения видимой влаги. Качество стерилизации воздушным методом зависит от равномерности распределения горячего воздуха в стерилизационной камере, что достигается правильной загрузкой стерилизатора. Изделия загружают в таком количестве, которое допускает свободную подачу воздуха к стерилизуемому изделию. Стерилизуемые изделия, равномерно распределяя, укладывают горизонтально поперек пазов кассет (полок); не допускается перекрывать продувочные окна и решетки вентиляции. Объемные изделия следует класть на верхнюю металлическую решетку, чтобы они не препятствовали потоку горячего воздуха. При загрузке необходимо следить за тем, чтобы стерилизуемые изделия не попадали в зону вращения крыльчатки. Загрузку и выгрузку изделий проводят при температуре в стерилизационной камере 40 - 50 °C. Изделия стерилизуют завернутыми в стерилизационные упаковочные материалы. Шприцы стерилизуют в разобранном виде. Во время стерилизации металлических инструментов без упаковки их располагают так, чтобы они не касались друг друга. Стерилизация в среде нагретых стеклянных шариков В стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков (гласперленовые шариковые стерилизаторы), стерилизуют изделия, применяемые в стоматологии (боры зубные, головки алмазные, дрильборы, а также рабочие части гладилок, экскаваторов, зондов и др.). Изделия стерилизуют в неупакованном виде по режимам, указанным в инструкции по эксплуатации конкретного стерилизатора, разрешенного для применения. Метод крайне прост - инструмент погружается в среду мелких стеклянных шариков, нагретых до температуры 190 - 2900С (таким образом, чтобы над рабочей поверхностью инструмента оставался слой шариков не менее 10 мм) на 20 - 180 секунд, в зависимости от размера и массы инструмента. После стерилизации инструменты используют сразу по назначению. Химические методы стерилизации Стерилизация растворами химических средствСтерилизация изделий растворами химических средств является вспомогательным методом, поскольку изделия нельзя простерилизовать в упаковке, а по окончании стерилизации их необходимо промыть стерильной жидкостью (питьевая вода, 0,9 % раствор натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению простерилизованных изделий микроорганизмами. Данный метод следует применять для стерилизации изделий, в конструкцию которых входят термолабильные материалы, то есть в тех случаях, когда особенности материалов изделий не позволяют использовать другие официально рекомендуемые методы стерилизации. Конструкция изделия должна позволять стерилизовать его растворами химических средств. При этом необходим хороший доступ стерилизующего средства и промывной жидкости ко всем стерилизуемым поверхностям изделия. Для стерилизации растворами химических средств используют средства, указанные в Табл.1 , в том числе электрохимически активированные растворы, вырабатываемые в диафрагменных электрохимических установках типа «СТЭЛ», а также вырабатываемые другими установками, разрешенными к выпуску, согласно инструктивно-методическим документам, утвержденным в установленном порядке в Российской Федерации. При стерилизации растворами химических средств используют стерильные емкости из стекла, металлов, термостойких пластмасс, выдерживающих стерилизацию паровым методом, или покрытые эмалью (эмаль без повреждений). Температура растворов, за исключением специальных режимов применения перекиси водорода и средства Лизоформин 3000, должна составлять не менее 20 °C для альдегидсодержащих средств и не менее 18 °C для остальных средств. Стерилизацию проводят при полном погружении изделий в раствор, свободно их раскладывая. При большой длине изделия его укладывают по спирали. Разъемные изделия стерилизуют в разобранном виде. Каналы и полости заполняют раствором. Во избежание разбавления рабочих растворов, используемых для стерилизации, погружаемые в них изделия должны быть сухими. После стерилизации все манипуляции проводят, строго соблюдая правила асептики. Изделия извлекают из раствора с помощью стерильных пинцетов (корнцангов), удаляют раствор из каналов и полостей, а затем промывают в стерильной жидкости, налитой в стерильные емкости, согласно рекомендациям методического документа по применению конкретного средства. При каждом переносе из одной емкости в другую освобождение каналов и полостей и их заполнение свежей жидкостью осуществляют с помощью стерильного шприца, пипетки или иного приспособления. Промытые стерильные изделия после удаления остатков жидкости из каналов и полостей используют сразу по назначению или помешают (с помощью стерильных пинцетов, корнцангов) на хранение в стерильную стерилизационную коробку, выложенную стерильной простыней, на срок не более 3 суток. Стерилизация газовым методомДля газового метода стерилизации используют смесь ОБ (смесь окиси этилена и бромистого метила в весовом соотношении 1:2,5 соответственно), окись этилена, пары раствора формальдегида в этиловом спирте, а также озон. Стерилизацию смесью ОБ и окисью этилена проводят при комнатной температуре (не менее 18 °C), при температуре 35 °C и 55 °C , парами раствора формальдегида в этиловом спирте при температуре 80 °C Эндоскопы и медицинские инструменты к гибким эндоскопам стерилизуют согласно режимам, изложенным в соответствующих методических документах (см. Приложение № 1). Стерилизацию газовым методом осуществляют в стационарных газовых стерилизаторах, разрешенных к применению в установленном порядке, а также в портативных аппаратах (микроанаэростаты объемом 2,0 дм3 и 2,7 дм3). Для поддержания температуры стерилизации (35, 55 °C) в портативных аппаратах их помещают в термостат или водяную баню. Перед газовой стерилизацией изделия после предстерилизационной очистки вытирают чистой салфеткой либо подсушивают при комнатной температуре или температуре 35 °C до исчезновения видимой влаги. Удаление влаги из каналов полимерных (резиновые, пластмассовые) катетеров, трубок проводят с использованием централизованного вакуума, при его отсутствии - с помощью водоструйного насоса, подсоединенного к водопроводному крану. Изделия после подсушивания упаковывают в разобранном виде в пакеты из рекомендованных упаковочных материалов, затем помещают их в стационарный или в портативный аппараты и закрывают крышкой, которую прижимают зажимом. При стерилизации смесью ОБ и окисью этилена из портативного аппарата удаляют воздух до давления 0,9 кгс/см2 по показанию вакуумметра. Дозирование газов осуществляют по парциальному давлению непосредственно из баллона через штуцер микроанаэростата. При использовании портативного аппарата после окончания стерилизационной выдержки его открывают в вытяжном шкафу и выдерживают 5 часов. Озоном, вырабатываемым в «Стерилизаторе озоновом СО-01-С.-Пб.», стерилизуют инструменты простой конфигурации из коррозионностойких сталей и сплавов, применяемые в хирургии и стоматологии (скальпели, пинцеты, зеркала цельнометаллические, гладилки, зонды, шпатели, боры стоматологические твердосплавные. После стерилизации инструменты используют по назначению сразу (без дополнительного проветривания). Стерилизация аппаратов экстракорпорального (искусственного) кровообращения. Аппараты искусственного кровообращения стерилизуют в разобранном и в собранном виде. Подготовка аппарата к стерилизации предусматривает все этапы предстерилизационной очистки. Отдельные блоки и детали аппарата (оксигенераторы, резервуар для донорской крови, резервный сосуд, артериальные канюли, венозные катетеры, тройник, ловушки, трубки из полимерных материалов и т.д.) стерилизуют паровым методом при температуре 120 - 122 °C. Трубки из полимерных материалов при стерилизации приобретают молочный цвет, исчезающий после подсушивания в сушильном шкафу при температуре 60 - 80 °C в течение 10 часов. Сборку аппарата осуществляют в асептических условиях. Стерилизацию аппаратов экстракорпорального кровообращения в собранном виде проводят газовым методом окисью этилена. Радиационный метод (гамма-излучения)Стерилизующим агентом при радиационной стерилизации является проникающее гамма- или бета-излучение. Наиболее широко используется гамма-излучающий изотоп кобальта-60, реже изотоп цезия-137, в связи с его низким уровнем энергии и излучения. Бета-излучающие изотопы используются вообще крайне редко, так как бета-излучение обладает гораздо меньшей проникающей способностью. Эффективность радиационной стерилизации зависит от общей дозы излучения и не зависит от времени. Средняя летальная доза для микроорганизмов всегда одинакова, проводится ли облучение при низкой интенсивности в течение длительного промежутка времени или недолго при высокой интенсивности излучения. Доза 25 кГр (2,5 Мрад) надежно гарантирует уничтожение высокорезистентных споровых форм микроорганизмов. Радиационная стерилизация обладает рядом технологических преимуществ: высокая степень инактивации микроорганизмов, возможность стерилизации больших партий материалов, автоматизация процесса, возможность стерилизации материалов в любой герметичной упаковке (кроме радионепрозрачной). Немаловажным обстоятельством является то, что температура стерилизуемых изделий в ходе стерилизации не повышается. Радиационный метод используется для промышленной стерилизации одноразовых изделий из полимерных материалов, режущих инструментов, шовного и перевязочного материала, некоторых лекарственных препаратов. В лечебно-профилактических учреждениях радиационная стерилизация не применяется в связи с большой дороговизной установок и по соображениям техники безопасности. Методы контроля эффективности стерилизацииВ комплексе мероприятий по стерилизации изделий медицинского назначения важное значение имеет организация и проведение контроля за ее эффективностью. Используемые до настоящего времени методы и средства контроля не всегда позволяют выявить дефекты стерилизации, что влечет за собой повышение уровня внутрибольничных инфекций. Контроль эффективности работы стерилизационного оборудования осуществляется физическими, химическими и биологическим (бактериологическим) методами. Надежность этих методов неодинакова. Физические и химические методы предназначены для оперативного контроля и позволяют контролировать соблюдение параметров режимов паровой, газовой, воздушной стерилизации, температуру, давление, экспозицию. Недостаток этих методов заключается в том, что они не могут служить доказательством эффективной стерилизации. Достоверным для определения эффективности является только бактериологический метод. Физические методы Физические методы контроля осуществляются с помощью средств измерения температуры (термометры, термопары), давления (манометры, мановакуумметры) и времени (таймеры). Современные стерилизаторы оснащены также записывающими устройствами, фиксирующими отдельные параметры каждого цикла стерилизации. Химические методы контроляИспользование химических веществ или их комбинаций, изменяющих под влиянием процесса стерилизации свое состояние или цвет, принято называть химическим контролем. Вещества, используемые для контроля стерилизации, называют химическими индикаторами. Химические индикаторы могут реагировать на воздействие одного, нескольких или всех критических параметров процесса стерилизации. Классификация индикаторов Индикаторы процесса (класс 1)Индикаторы процесса предназначены для использования с изделиями или отдельными упаковками (например, пакетами, коробками) с целью подтверждения того, что данные изделия или упаковки прошли стерилизационную обработку. Они позволяют отличить стерилизованные изделия (упаковки) от нестерилизованных.   Индикаторы для специальных испытаний (класс 2) Эти индикаторы предназначены для использования в специальных испытаниях стерилизационного оборудования, определяемых соответствующими стандартами. Наиболее распространенный индикатор этого класса - тест Бови-Дик (Bowie & Dick) Однопараметрические индикаторы (класс 3)Однопараметрические индикаторы должны реагировать на один из критических параметров и указывать на проведение стерилизационной обработки при установленном значении выбранного параметра. Многопараметрические индикаторы (класс 4)Многопараметрические индикаторы стерилизации должны реагировать на два или более критических параметра и указывать на достижение установленных значений выбранных параметров во время стерилизации. «Наружные» химические индикаторы 4 класса для контроля паровой стерилизации размещают на стерилизационных упаковках или в контрольных точках в камере стерилизатора. Обеспечивают контроль соблюдения критических параметров паровой стерилизации (температура, время, наличие насыщенного пара) в стерилизаторах с гравитационным способом удаления воздуха. «Внутренние» химические индикаторы 4 класса для контроля паровой стерилизации размещают внутри упаковок с изделиями и позволяют получить информацию о соблюдении параметров паровой стерилизации в непосредственной близости от изделий. Позволяют подобрать оптимальный способ и материал для упаковывания изделий.  «НАРУЖНЫЕ» ХИМИЧЕСКИЕ ИНДИКАТОРЫ 4 КЛАССА СЕРИИ ИКПС  «ВНУТРЕННИЕ» ХИМИЧЕСКИЕ ИНДИКАТОРЫ 4 КЛАССА СЕРИИ ИКПС-ВН/01 Интегрирующие индикаторы (класс 5)Интегрирующие индикаторы должны реагировать на все критические параметры метода стерилизации. Контрольные значения параметров для индикаторов класса 5 определяются заданной степенью инактивации тест-микроорганизмов с определенными значениями величины D и, если это применимо, величины z в соответствии с ГОСТ Р ИСО 11138-1 и ГОСТ Р ИСО 11138-3. Химические индикаторы 5 класса призваны обеспечить высочайший уровень контроля соблюдения параметров паровой стерилизации. Срабатывание химического индикаторы 5 класса соответствует полной гибели тестовых микроорганизмов, что позволяет сразу после завершения цикла стерилизации судить о качестве стерилизации. 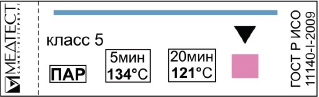 ХИМИЧЕСКИЕ ИНДИКАТОРЫ 5 КЛАССА ДЛЯ ПАРОВОЙ СТЕРИЛИЗАЦИИ (ИНТЕГРИРУЮЩИЕ) Имитирующие индикаторы (класс 6)Эти индикаторы должны реагировать на все критические параметры метода стерилизации (определенной группы режимов). Контрольные значения параметров определяются соответствующими режимами стерилизации. Реагируют на все критические параметры паровой стерилизации. Предназначены для точной проверки работы стерилизатора и соблюдения параметров стерилизации. Реагируют только в присутствии пара требуемой температуры при соответствующем времени выдержки. 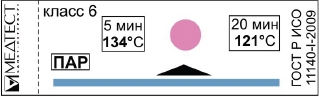 ХИМИЧЕСКИЕ ИНДИКАТОРЫ 6 КЛАССА ДЛЯ ПАРОВОЙ СТЕРИЛИЗАЦИИ Цвет химического индикатора, приобретенный им после использования, при хранении может возвращаться к исходному. Такие индикаторы не подлежат архивированию.ий контроль стерилизация Биологический метод Наряду с физическими и химическими применяется бактериологический метод контроля стерилизации. Он предназначается для контроля эффективности стерилизационного оборудования. До недавнего времени для контроля паровой и воздушной стерилизации использовались пробы садовой земли, содержащей микроорганизмы, высокорезистентные к воздействию стерилизующих факторов. Однако устойчивость микроорганизмов в различных пробах неодинакова, что не позволяет стандартизировать результаты контроля. В настоящее время для проведения бактериологического контроля используются биотесты, имеющие дозированное количество спор тест-культуры. Контроль эффективности стерилизации с помощью биотестов рекомендуется проводить 1 раз в 2 недели. В зарубежной практике принято применять биологическое тестирование не реже 1 раза в неделю. Биологический контроль с помощью биологических индикаторов (биотестов).В основе биологического метода контроля процесса стерилизации лежит гибель определенного числа тестовых, устойчивых к воздействию стерилизующего агента микроорганизмов. Единственным недостатком этого метода является тот факт, что биотесты нельзя использовать в качестве средства оперативного контроля. Для получения результата необходимо биологический индикатор термостатировать в течение двух суток. При этом стерильный материал, в присутствии которого осуществлялся биологический контроль также необходимо сохранять и не передавать в работу до получения результата. По информативности результата биологический контроль превосходит описанные выше методы контроля, так как он является средством прямого контроля и дает однозначный ответ о гибели микроорганизмов при стерилизации. Ошибочное срабатывание биологического индикатора при эффективной стерилизации стремится к нулю, естественно при соблюдении главного требования при работе с биотестами – исключение из технологического процесса работы с ними возможности их повторной контаминации. Биологические индикаторы используют для определения эффективности стерилизации[1,2]. Если это определение сравнить с определением назначения химических индикаторов, то сразу же бросается в глаза разница в формулировках функциональности, а, следовательно, и в точности осуществляемых контрольных мероприятий. Химические индикаторы показывают, «имела ли место стерилизационная обработка», а биологические «определяют эффективность процесса стерилизации». Для того чтобы разобраться и понимать, что такое биологический контроль и какие он позволяет решать задачи, необходимо познакомиться с понятиями и определениями. Биологический индикатор – это готовый к применению инокулированный носитель в первичной упаковке, обеспечивающий определенную резистентность (устойчивость) к конкретному режиму стерилизации. Здесь носителем является удерживающий материал, на который нанесены тест-микроорганизмы. А первичной упаковкой является система, предохраняющая инокулированный носитель от повреждения и контаминации, но не препятствующая проникновению стерилизующих агентов. Носитель, на который нанесено определенное количество тест-микроорганизмов называется инокулированным. Кроме того, используя постоянно периодический контроль в практике работы ЦСО, существенно облегчается анализ причин неэффективности стерилизации. Это, в свою очередь, позволяет установить, что эти причины являются результатом ряда скрытых факторов, которые действуют отдельно или в сочетании друг с другом (техническая неисправность оборудования, несоблюдение технологии проведения стерилизации, ошибки персонала, в том числе и при проведении контрольных мероприятий и так далее) [ А самое главное, этот анализ можно осуществить собственными силами специалистов ЦСО без привлечения сторонних организаций, что, в итоге позволяет существенно экономить денежные средства ЛПУ. Еще одним важным аспектом использования биологических индикаторов является возможность их применения на всех существующих режимах стерилизации. А к ним можно отнести российские классические режимы автоклавирования и воздушной стерилизации, так называемые импортные «короткие» режимы паровой стерилизации, стерилизации лекарственных сред, а также режимы обеззараживания (так называемые «режимы убивки») и обработки в дезинфекционных камерах. Рассмотрим подробно все возможные режимы стерилизации, где необходимо осуществлять биологический контроль. Стерилизация растворов лекарственных сред в автоклавах. Стерилизационные режимы: 112°С с временной выдержкой от 8 минут и более; 120°С с временной выдержкой от 10 минут и более. Паровая стерилизация (автоклавирование). Стерилизационные режимы: 110°/180м; 120°/45м; 121°/20м; 126°/10м; 132°/20м; 134°/5м. Воздушная стерилизация. Стерилизационные режимы: 160°/150м; 180°/60м. Паровая стерилизация (автоклавирование). Режимы обеззараживания 110°/45м; 120°/30м; 120°/60м; 126°/45м; 126°/60м; 132°/45м; 132°/60м; 132°/90м. Режимы обработки для дезинфекционных камер. Режимы пароформалиновой дезинфекции: 58°/45м; 50°/150м; 58°/60м; 58°/210м; 126°/60м; 132°/45м; 132°/60м; 132°/90м. Режимы паровой дезинфекции: 100°/30м; 100°/60м; 108°/40м. Плазменная и газовая (окись этилена, озон) стерилизация. Контроль стерильности изделий медицинского назначения Проводят путем взятия смывов на стерильность и посев на питательную среду. Контроль стерильности проводят путем прямого посева (погружения) изделий целиком (при их небольших размерах) или в виде отдельных деталей (разъемные изделия) и фрагментов (отрезанные стерильными ножницами кусочки шовного, перевязочного материала и т.п.) в питательные среды. Объем питательной среды в пробирке (колбе, флаконе) должен быть достаточным для полного погружения изделия (деталей или фрагментов изделия). При проверке стерильности более крупных изделий проводят отбор проб методом смывов с различных участков поверхности изделий: с помощью стерильного пинцета (корнцанга) каждый участок тщательно протирают марлевой салфеткой (размер салфетки 5.5 см), увлажненной стерильной питьевой водой или стерильным 0,9 % раствором хлорида натрия, или раствором нейтрализатора (при стерилизации раствором химического средства). Каждую салфетку помещают в отдельную пробирку с питательной средой. У изделий, имеющих функциональные каналы, рабочий конец опускают в пробирку с питательной средой и с помощью стерильного шприца или пипетки 1 - 2 раза промывают Посевы в тиогликолевую среду выдерживают в термостате при температуре 32 °C, посевы в среду Сабуро - при температуре 20 - 22 °C в течение 14 суток при контроле изделий, простерилизованных растворами химических средств и газовым методом, в течение 7 суток - простерилизованных термическими (паровой, воздушный) методами. При отсутствии роста микроорганизмов во всех пробирках (колбах, флаконах) делают заключение о стерильности изделий. ЗАКЛЮЧЕНИЕ Подводя итоги, следует отметить следующее. Уничтожение микроорганизмов физическими и химическими методами, которые используются при стерилизации медицинских изделий, подчиняется экспоненциальному закону. Это означает, что неизбежно имеется конечная вероятность того, что микроорганизм может выживать независимо от степени проведенной обработки. Для конкретной обработки вероятность выживания определена количеством и типами микроорганизмов и условиями их существования до и во время обработки. Следовательно, стерильность любого изделия в ряду изделий, подвергнутых стерилизации, может выражаться только в терминах вероятности существования нестерильного изделия. Применение современных стерилизантов, тепловая и холодная стерилизация гибкого инструментария после каждого исследования позволяют достигать высокого уровня дезинфекции и стерильности аппаратуры. В качестве стерилизантов используют насыщенный высокотемпературный водяной пар (стерилизация паром), сухой горячий воздух (стерилизация жаром), химические вещества (стерилизация химическая), газ (стерилизация газовая), реже используют ионизирующие излучения (лучевая стерилизация), фильтрование через мелкопористые фильтры (механическая стерилизация), многократное прогревание жидкостей на водяной бане при 100 0С (дробная стерилизация) или 56 0С (тиндализация). Список использованной литературы 1. ОСТ 42-21-2-85 "Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы". 2. Приказ Минздрава СССР от 12 июля 1989 г. N 408 "О мерах по снижению заболеваемости вирусными гепатитами в стране". 3. Приказ Минздрава России от 16 июня 1997г. N 184 "Об утверждении Методических указаний по очистке, дезинфекции и стерилизации эндоскопов и инструментов к ним, используемых в лечебно - профилактических учреждениях". 4. Методические указания по классификации очагов туберкулезной инфекции, проведению и контролю качества дезинфекционных мероприятий при туберкулезе (N 10-8/39 от 04.05.79 г.). 5. Методические рекомендации по дезинфекции, предстерилизационной очистке и стерилизации медицинских инструментов к гибким эндоскопам (N 28-6/3 от 09.02.88 г.). 6. Методические рекомендации по очистке, дезинфекции и стерилизации эндоскопов (N 15-6/33 от 17.07.90 г.). 7. Методические рекомендации по стерилизации лигатурного шовного материала в лечебно - профилактических учреждениях (N 15-6/34 от 19.07.90 г.). 8. Методические указания по контролю работы паровых и воздушных стерилизаторов (N 15/6-5 от 28.02.1991 г.). 9. Методические указания по применению озона, вырабатываемого в стерилизаторе озоновом СО-01-С.-Пб., для стерилизации медицинских инструментов (N МУ-135-113 от 31.07.97 г.). 10. Методические рекомендации по стерилизации аппаратов искусственного кровообращения газообразной окисью этилена (N 1-13-73 от 26.03.72 г.). 11. Методические указания по применению медицинских упаковочных материалов корпорации "РЕКСАМ" (Великобритания) (N МУ-204-113 от 29.12.97 г.). 12. Методические указания по применению медицинских упаковочных материалов "СТЕРИКИНГ" фирмы "Випак Медикал" (Финляндия) (N МУ-157-113 от 10.08.98 г.). |
