Биотехнология подготвка к тесту-1. Клетка органелла
 Скачать 7.29 Mb. Скачать 7.29 Mb.
|
|
КЛЕТКА ОРГАНЕЛЛА Отличие ЭПС от аппарата Гольджи: ЭПС состоит из разветвлённой сети трубочек и карманов, окружённых мембраной, а АГ представляет собой стопку дискообразных мембранных мешочков или иначе цистерн и связанную с ними систему пузырьков. Основные функции ЭПС - синтез и транспорт (либо сразу в цитоплазму, либо в АГ) белков (гранулярная ЭПС), а также липидов и стероидов (агранулярная), принимает участие в создании ядерной оболочки, является депо кальция. Функции АГ - модификация (созревание и разделения так скажем по функциям) и транспорт белков, формирование слизистых секретов — гликозамингликанов (мукополисахаридов), формирование углеводных компонентов гликокаликса плазматической мембраны клетки В чем разница между лизосомами и пероксисомами. Основное различие между лизосомой и пероксисомой заключается в ферментах, которые они содержат, и их функциях. Лизосомы содержат ферменты, которые разлагают биополимеры, такие как белки, липиды, полисахариды и нуклеиновые кислоты. Пероксисомы содержат ферменты для окисления органических соединений, генерации метаболической энергии. Как лизосомы, так и пероксисомы структурно сходны, но различаются по размеру. Лизосомы обычно большие по сравнению с пероксисомами, и их размер варьируется в зависимости от материалов, которые попадают в органеллу. Обе органеллы заключены в одну мембрану. Разница между животной и растительной клеткой. Растительная клетка имеет в клеточной оболочке клеточную стенку, а животная клетка ее не имеет. Животные клетки имеют гликокаликс. Животные клетки имеют центриоли. Среди растений центриоли имеются только у водорослей. Дочерние клетки после деления ядра отделяются у животных перетяжкой, у растений — перегородкой. Запасной углевод у растений — крахмал, а у животных — гликоген. Растительные клетки способны к фотосинтезу, животные — гетеротрофы. Растительные клетки имеют пластиды. Растительные клетки имеют в клеточной оболочке целлюлозу. Растительные клетки имеют центральную вакуоль. Животные клетки могут иметь органеллы (реснички и жгутики) Мембранные и немембранные органеллы 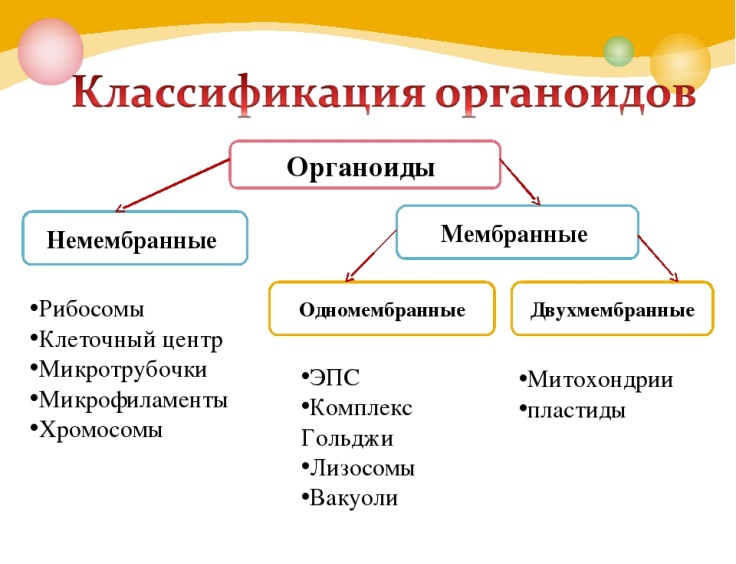 Пластиды Главная функция пластид – синтез органических веществ, благодаря наличию собственных ДНК и РНК, и структур белкового синтеза. В пластидах также содержатся пигменты, обусловливающие их цвет. Снаружи пластиду покрывают две элементарные мембраны, имеется система внутренних мембран, погруженных в строму, или матрикс.  Клеточная стенка бактерий Обеспечивает механическую защиту клетки от воздействий факторов окружающей среды Обеспечивает поддержание формы бактериальной клетки; Дает возможность клетке существовать в гипотонических растворах; Осуществляет транспорт веществ и ионов (характерно для грамот- рицательных бактерий, имеющих наружную мембрану, которая является дополнительным барьером для их поступления; основным барьером служит цитоплазматическая мембрана); Препятствует проникновению в клетку токсических веществ (также более характерно для грамотрицательных бактерий, имеющих наружную мембрану); На клеточной стенке находятся рецепторы, на которых адсорбируются бактериофаги и бактериоцины; В клеточной стенке находятся антигены (липополисахариды у грамотрицательных бактерий и тейховые кислоты у грамположительных бактерий); На клеточной стенке находятся рецепторы, ответственные за взаимодействие клеток донора и реципиента при конъюгации бактерий. Вместе с тем следует отметить, что клеточная стенка не является жизненно важной структурой, так как в определенных условиях она может быть удалена и бактериальные клетки при этом существуют в виде протопластов или сферопластов Различие эукариот и прокариот 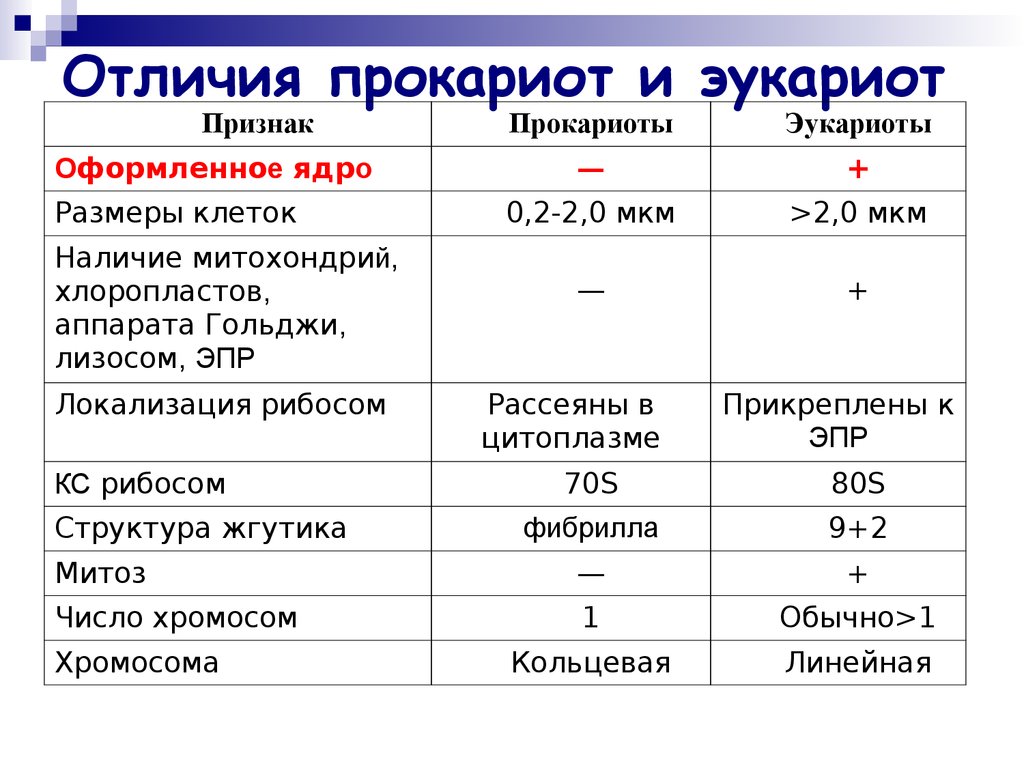 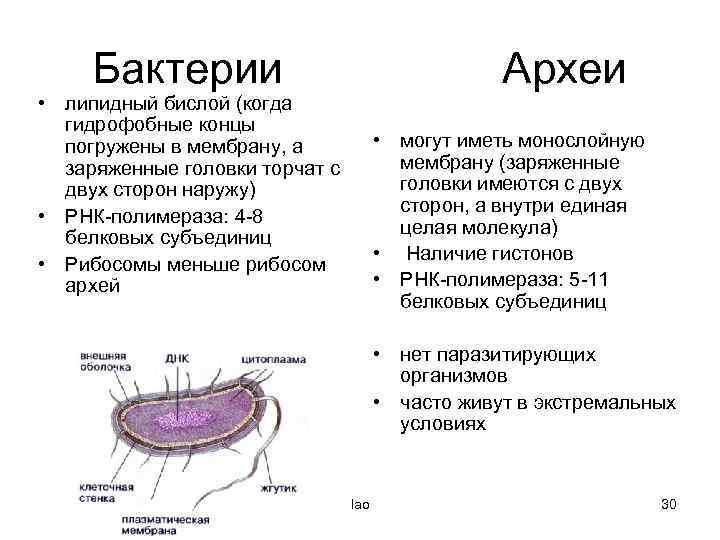 Одноклеточные микроорганизмы без ядра. (археи и бактерии) Одноклеточные микроорганизмы без ядра. (археи и бактерии)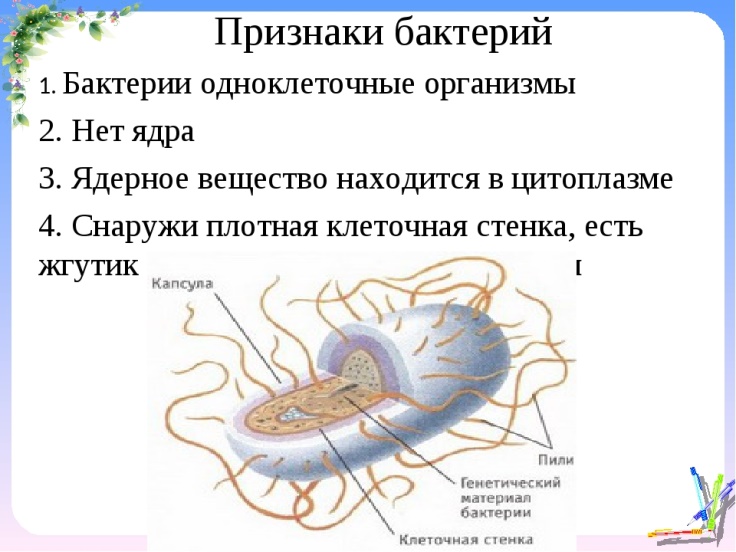 СВЯЗИ И ФУНКЦИОНАЛЬНЫЕ ГРУППЫ Гидроксильная и карбонильная группа Гидроксильная группа — функциональная группа OH органических и неорганических соединений, в которой атомы водорода и кислорода связаны ковалентной связью. (Гидроксильный радикал относится к реактивным формам кислорода и является наиболее активным компонентом оксидативного стресса. Он образуется в клетке в основном при восстановлении перекиси водорода в присутствии переходного металла. Образовавшийся гидроксильный радикал мгновенно реагирует с любой окисляемой молекулой в ближайшем окружении. Из наиболее биологически важных компонентов клетки гидроксильный радикал способен окислять углеводы, нуклеиновые кислоты (что может привести к мутации или повреждению генов), липиды (вызывая перекисное окисление липидов) и аминокислоты.) Карбоксильная группа (карбоксил) -СООН — функциональная одновалентная группа, входящая в состав карбоновых кислот и определяющая их кислотные свойства. Карбоновые кислоты значительно превосходят по кислотности спирты и фенолы, потому что смещение электронной плотности к карбонильному атому кислорода вызывает дополнительную поляризацию связи OH. Н 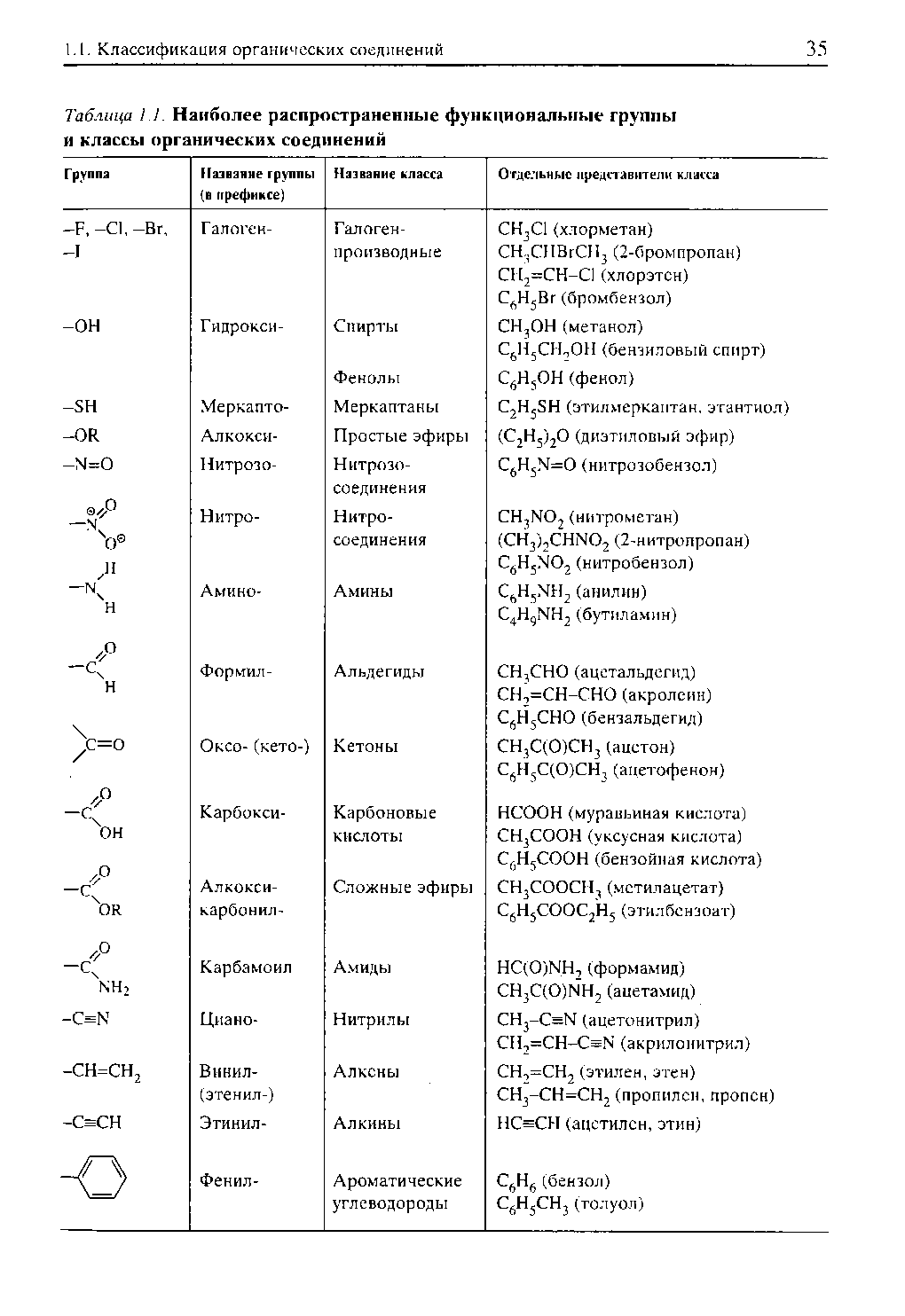 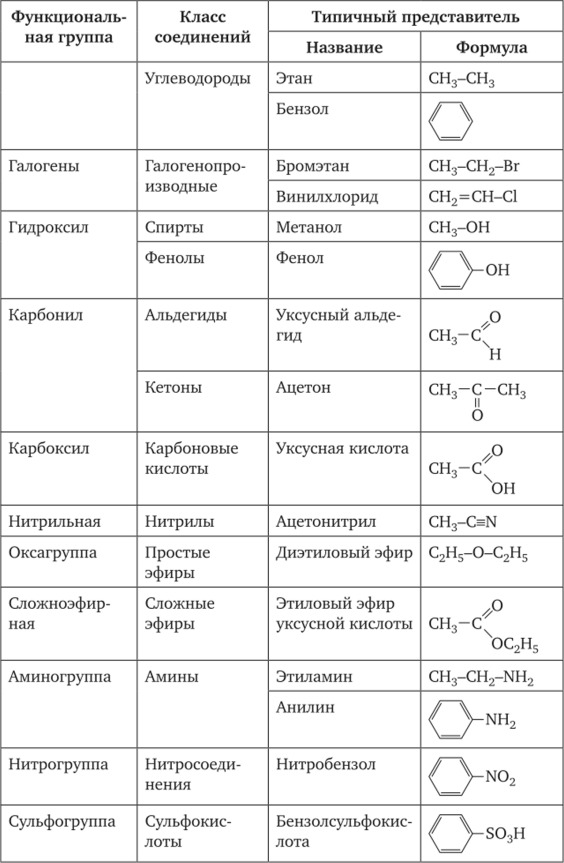 азвания функциональных групп азвания функциональных группИмины  Тиольная 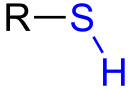 Имиды 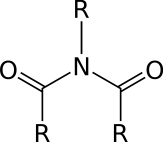 Нековалентные связи Ионная - сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов. Возникает между атомами с большой разностью электроотрицательностей Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединениях, а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода. Связь этого типа, хотя и слабее ионной и ковалентной связей, играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры). Водородная связь в биологии важна при постройке молекул ДНК, в химии водородная связь важна для учёта свойств веществ СТЕРЕОХИМИЯ Хиральные центры (примеры) Хиральный центр – sp3 гибридный атом углерода соединенный с 4 разными заместителями 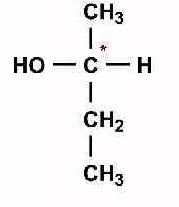 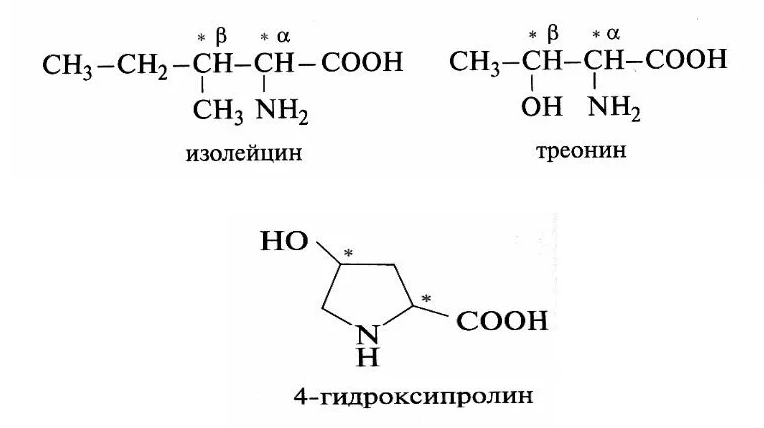 Места со звездочкой – хиральные центры D,L-ИЗОМЕРЫ 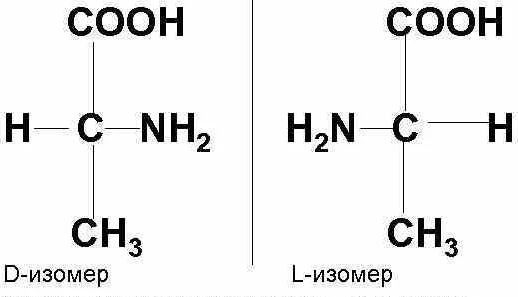 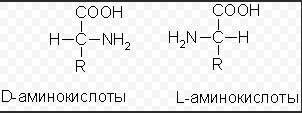 Отсюда вывод: D-изомер – это когда аминогруппа справа, а L-изомер, когда аминогруппа слева. Предлагаю мой способ легко запомнить: L=Left(слева) АМИНОКИСЛОТЫ 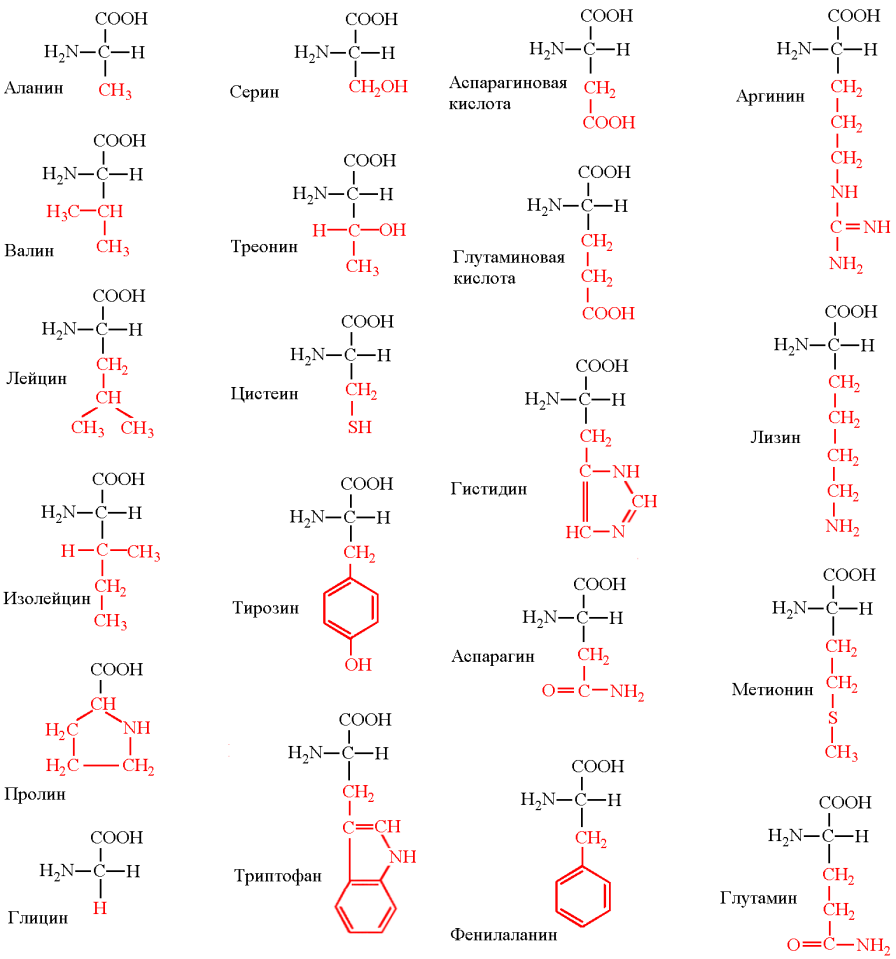 ПЕПТИДЫ. БЕЛКИ Денатурация Денатурация – разрушение вторичной и третичной структуры белка до первичной, под влиянием высоких или низких температур, сильных кислот и щелочей. Денатурация бывает обратимая и необратимая Глобулярные белки́ Глобулярные белки́— белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры — глобулы. Глобулярная структура белков обусловлена гидрофобно-гидрофильными взаимодействиями. Фибриллярные белки — белки, имеющие вытянутую нитевидную структуру, в которой отношение длинной оси молекулы к короткой (степень асимметрии) составляет от 80 до 150. Большинство фибриллярных белков не растворяется в воде, имеет большую молекулярную массу и высокорегулярную пространственную структуру, которая стабилизируется, главным образом, взаимодействиями (в том числе и ковалентными) между различными полипептидными цепями. Первичная и вторичная структура фибриллярного белка регулярна. Полипептидные цепи многих фибриллярных белков расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои.  Растворимость белков Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры. К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (щелк, паутина). Растворимость определяется наличием на их поверхности заряженных и полярных группировок (-СОО-, -NH3+, -OH и др.). Заряженные и полярные группировки белков притягивают к себе молекулы воды, и вокруг них формируется гидратная оболочка, существование которой обусловливает их растворимость в воде. При высоких концентрациях солей растворимость белка снижается (рис. 16) вследствие разрушения гидратной оболочки, приводящего к агрегации молекул белка. Существуют белки, которые растворяются только в растворах солей и не растворяются в чистой воде, такие белки называют глобулины. Существуют и другие белки – альбумины, они в отличие от глобулинов хорошо растворимы в чистой воде. Растворимость белков зависит и от рН растворов. Как мы уже отмечали, минимальной растворимостью обладают белки в изоэлектрической точке, что объясняется отсутствием электростатического отталкивания между молекулами белка. Осаждение сульфатом аммония В биохимии переосаждение сульфатом аммония является общим методом очистки белков. Глобулины, например, осаждаются полунасыщенным раствором сернокислого аммония, а альбумины - только насыщенным раствором. Объясняется это тем, что частицы глобулинов значительно крупнее частиц альбуминов, что используется для разделения альбуминов и глобулинов. Диализ Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные вещества равномерно распределяются между объёмом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе низкомолекулярные-можно, высокомолекулярные-нет. Заряд белков При понижении pH ниже изоэлектрической точки ионы H+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислоты и нейтрализуя их, делая заряд положительным При повышении pH концентрация ионов H+ снижается и положительно заряженные группы белка (NH3+ лизина и аргинина) теряют протоны, их заряд исчезает, делая заряд орицательным Простетические группы Простетическая группа — небелковый (и не производный от аминокислот) компонент, ковалентно связанный с белком, который выполняет важную роль в биологической активности соответствующего белка.  Гемы Гемы - комплексные соединения порфиринов с двухвалентным железом, несущие один или два аксиальных лиганда. Гемы выступают в роли простетических групп (небелковых частей) белков — гемопротеинов (гемоглобинов, миоглобина, цитохромов и др.).  Гликопротеины Гликопротеи́ны это сложные белки, в которых белковая (пептидная) часть молекулы ковалентно соединена с одной или несколькими группами гетероолигосахаридов. Кроме гликопротеинов существуют также протеогликаны и гликозаминогликаны.  Окрашенные белки 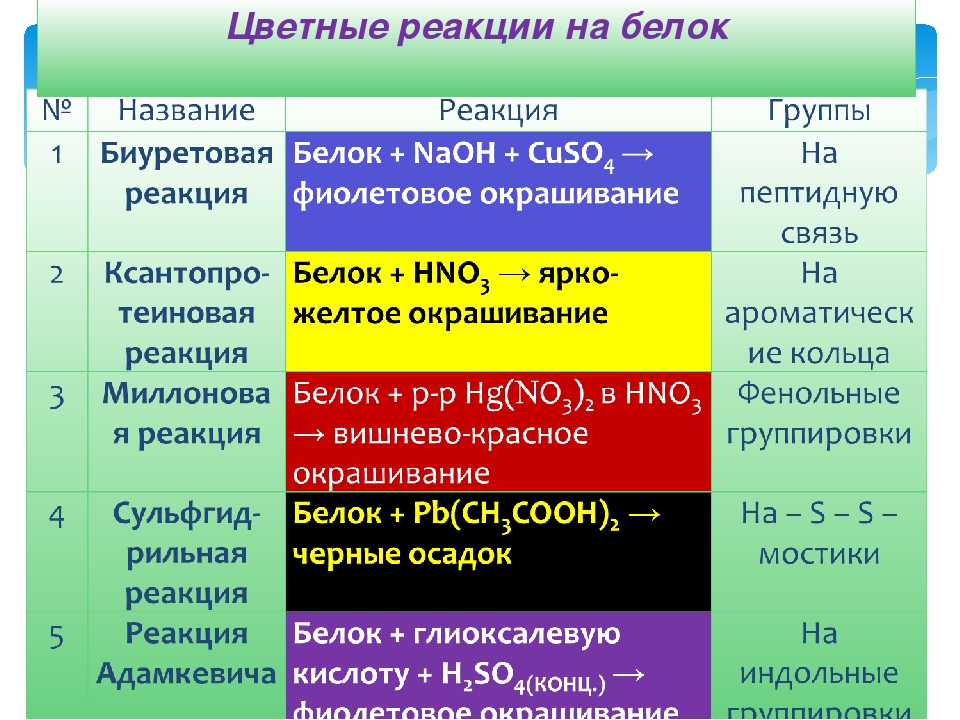 Хромопротеины Хромопротеиды - сложные белки, состоящие из простого белка и связанного с ним окрашенного небелкового компонента - простетической группы. Различают гемопротеины (содержат в качестве простетической группы гем), магнийпорфирины и флавопротеины (содержат производные изоаллоксазина). Хромопротеиды участвуют в таких процессах жизнедеятельности, как фотосинтез, клеточное дыхание и дыхание всего организма, транспорт кислорода и углекислого газа, окислительно-восстановительные реакции, свето- и цветовосприятие. Заменимые и незаменимые аминокислоты Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме. Заменимые аминокислоты – могут синтезироваться в организме Список:  Нингидриновая реакция - реакция на аминогруппы  Основные представители дикарбоновых/трикарбоновых кислот, которые входят в различные циклы   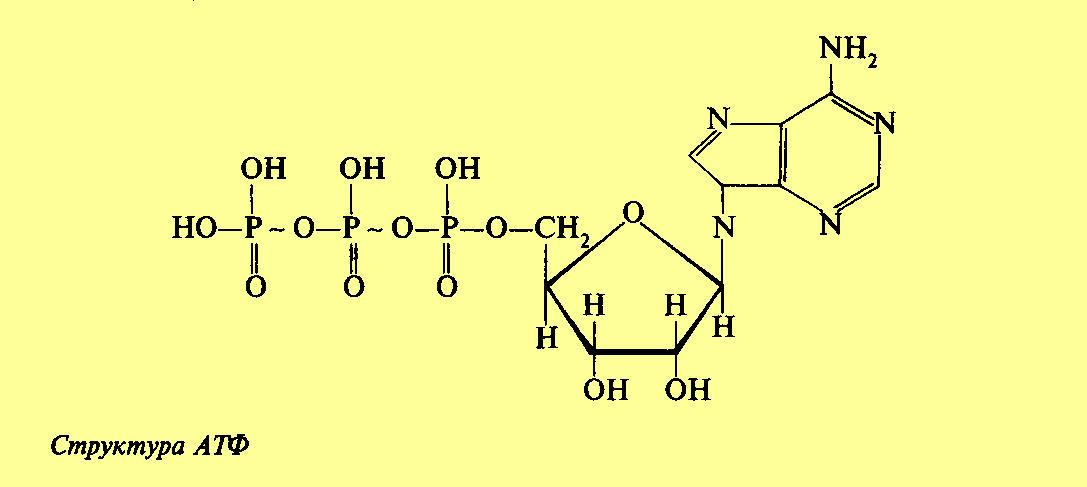 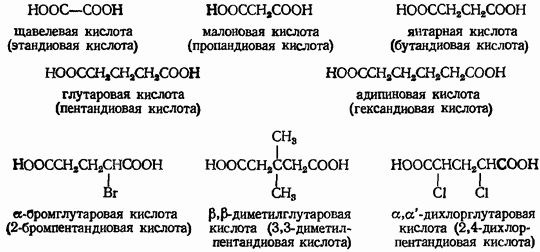 Щавелевая и глутаровая кислоты Щаве́левая кислота (этандиовая кислота) НООССООН — двухосновная предельная карбоновая кислота. Принадлежит к сильным органическим кислотам. Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры щавелевой кислоты называются оксалатами. В природе содержится в щавеле, ревене, карамболе и некоторых других растениях в свободном виде и в виде оксалатов калия и кальция. В организме щавелевая кислота является промежуточным продуктом обмена веществ, выделяется с мочой в виде солей кальция. При нарушениях минерального обмена соли щавелевой кислоты (оксалаты) участвуют в образовании камней в почках и мочевом пузыре. Глутаровая кислота (Пентандиовая кислота) — двухосновная предельная карбоновая кислота. Кето-производное глутаровой кислоты — α-кетоглутаровая кислота (α-кетоглутарат) является важным биологическим соединением. Эта кетокислота образуется при дезаминировании глутамата, и является одним из промежуточных продуктов цикла Кребса 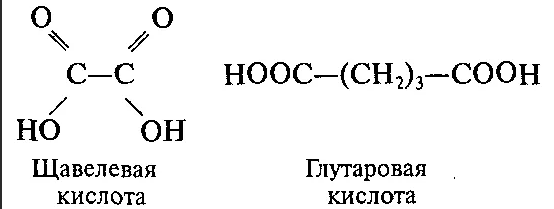 Низкомолекулярные пептиды Состоят от 2 до 40 остатков аминокислот. Важный класс-дипептиды. Связь в пептидах-пептидная– это вид амидной связи, возникающей при образовании пептидов и белков в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (— СООН) другой аминокислоты. 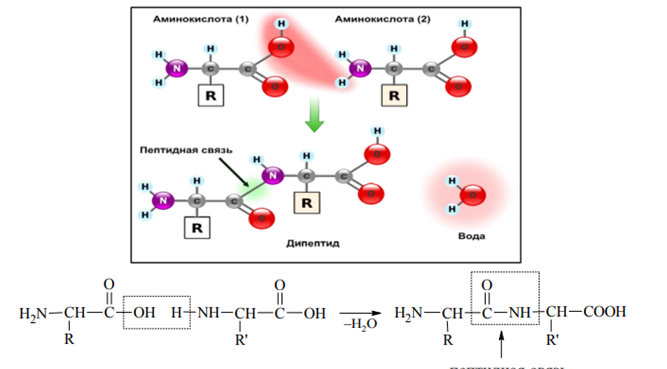  Вазопрессин, окситацин (функции)   ФЕРМЕНТЫ Международная классификация ферментов 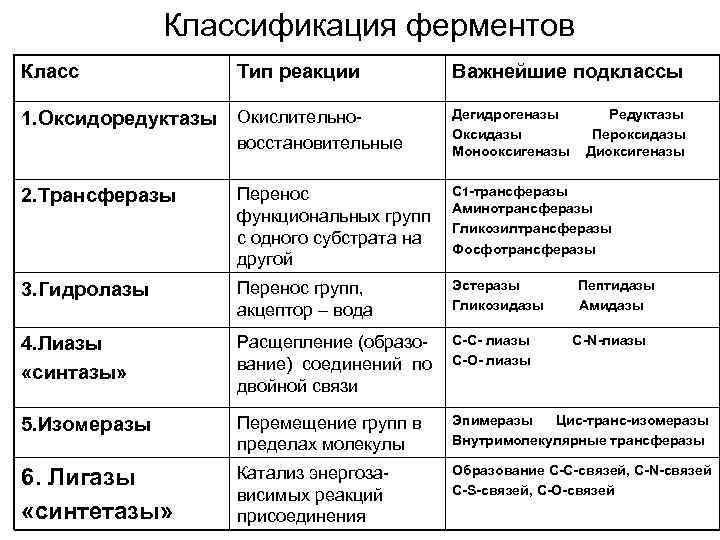 Холиностераза Холинэстеразы — группа ферментов из класса гидролаз карбоновых кислот, субстратами которых являются сложные эфиры холина с уксусной, пропионовой или масляной кислотами. Одной из важных качественных реакций на фермент является — ингибирование алкалоидом эзерином в концентрации 10−5 — 10−8М. Регуляция ферментативных реакций (репрессоры и ингибиторы) Репрессор — ДНК-связывающий или РНК-связывающий белок, который ингибирует экспрессию одного или нескольких генов путём связывания с оператором или сайленсерами. ДНК-связывающий репрессор блокирует прикрепление РНК-полимеразы к промотору, предотвращая таким образом транскрипцию генов в мРНК. РНК-связывающий репрессор связывается с мРНК и предотвращает трансляцию мРНК в белок. Эта блокировка экспрессии называется репрессией. Ингибитор — общее название веществ, подавляющих или задерживающих течение физиологических и физико-химических (главным образом ферментативных) процессов. Единица измерения силы катализатора - /катал/ (моль/секунда) Катал - единица измерения активности катализатора в системе СИ. Если присутствие катализатора увеличивает скорость химической реакции на один моль в секунду, то активность данного количества данного катализатора равна одному каталу. Катал — производная единица СИ, которая через основные единицы выражается следующим образом: 1 кат = моль / с К какой группе относится каталаза Каталаза – фермент, относящийся к классу оксидоредуктаз, который катализирует гетеролитическое расщепление О-О-связи в перекиси водорода. Лактатдегидрогеназа – строение 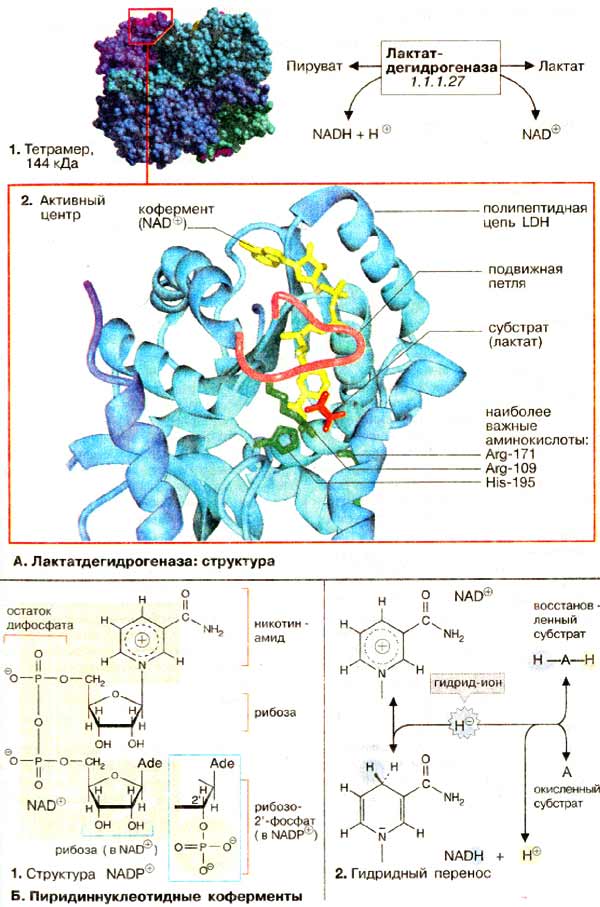  Международная единица ферментативной активности 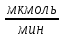 Единица активности (Е) – это количество фермента, которое катализирует превращение одного микромоля субстрата в мин при стандартных условиях (в оптимуме рН, при избытке субстрата, температуре 37 или 20 С) Аллостерический эффект и эффектор Аллостерический эффект — изменение конформации аллостерического фермента в результате взаимодействия его определенного участка с ингибитором или активатором. А.э. часто встречается у белков, состоящих из более чем одной субъединицы. Аллостерический эффектор – низкомолекулярное соединение, оказывающее активирующий или ингибирующий эффект при контакте с регуляторным (аллостерическим) центром фермента. Примером может служить нуклеотиды (адениловая кислота, АТФ) и аминокислоты Уравнение Михаэлиса-Ментен 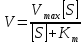 S – субстрат V – скорость Km – константа Михаэлиса Зависимость константы Михаэлиса от конкурентного и неконкурентного ингибирования 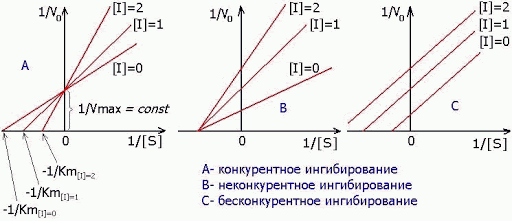 Кофермент Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулы фермента. Молекулярная активность и число оборотов ферментов Молекулярная активность – это число молекул субстрата, превращенное в 1 мин 1 молекулой фермента. Например, молекулярная активность каталазы = 5 мин Число оборотов – максимальное количество субстрата, которое определенный фермент может преобразовать в продукт реакции в единицу времени. Интерфероны Интерфероны — общее название ряда белков со сходными свойствами, выделяемых клетками организма в ответ на вторжение вируса, на некоторые бактериальные вещества и на низкомолекулярные химические соединения. Интерфероны индуцируют либо активируют определённые клеточные белки, блокирующие репликацию вируса. Что влияет на скорость ферментативной реакции? Скорость ферментативной реакции зависит от: концентрации субстрата и фермента, температуры, рН среды, наличия различных регуляторных веществ, способных увеличивать или снижать активность ферментов. Как можно повлиять на конкурентное ингибирование? На конкурентное ингибирование влияет концентрация субстрата ФЕРМЕНТЫ И КОФЕРМЕНТЫ Активный центр и за счет чего он формируется Активный центр — особая часть молекулы фермента, определяющая её специфичность и каталитическую активность. Активный центр непосредственно осуществляет взаимодействие с молекулой субстрата или с теми её частями, которые непосредственно участвуют в реакции. Характер взаимодействия фермента и субстрата говорит о наличии в активном центре ряда структурных групп, соединяющихся с различными участками субстрата. Активный центр формируется за счет радикалов аминокислот, которые оказываются вблизи друг от друга в результате формирования третичной структуры белка Сколько может быть аллостерических центров? Аллостерических центров может быть один или несколько (не ограничено) Мультиферментный комплекс Мультиферментный комплекс – это комплекс, в котором принимают участие несколько ферментов, при этом продукт предшествующей реакции является субстратом следующей реакции. Что происходит при изменение третичной структуры фермента? При изменение третичной структуры фермента меняется его конформация и подходящий ему субстрата. Что происходит с энергией активации во время ферментативной реакции Во время ферментативной реакции ферменты понижают энергию активации. Иммобилизация ферментов Иммобилизация – это процесс фиксации биологического объекта (фермент, клетка) на носителе или в носителе с помощью физических либо химических сил или любое ограничение свободы движения объектов (ферменты, клетки) в пространстве. НУКЛЕОЗИДЫ Название нуклеозидов 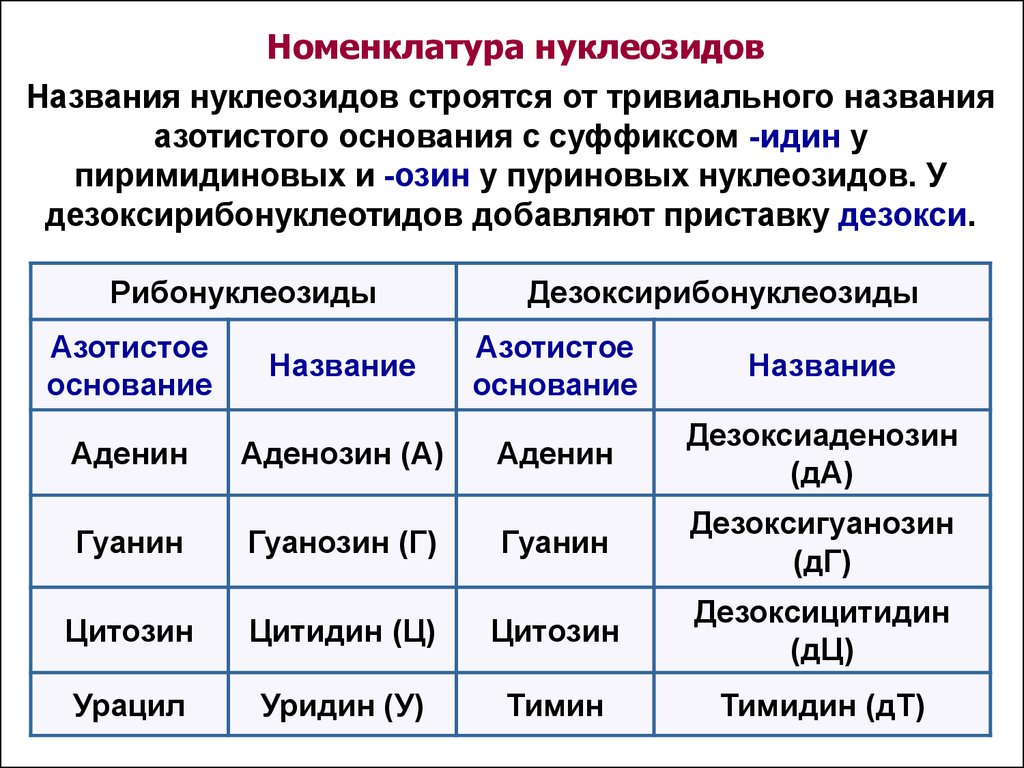 Нуклеиновые основания 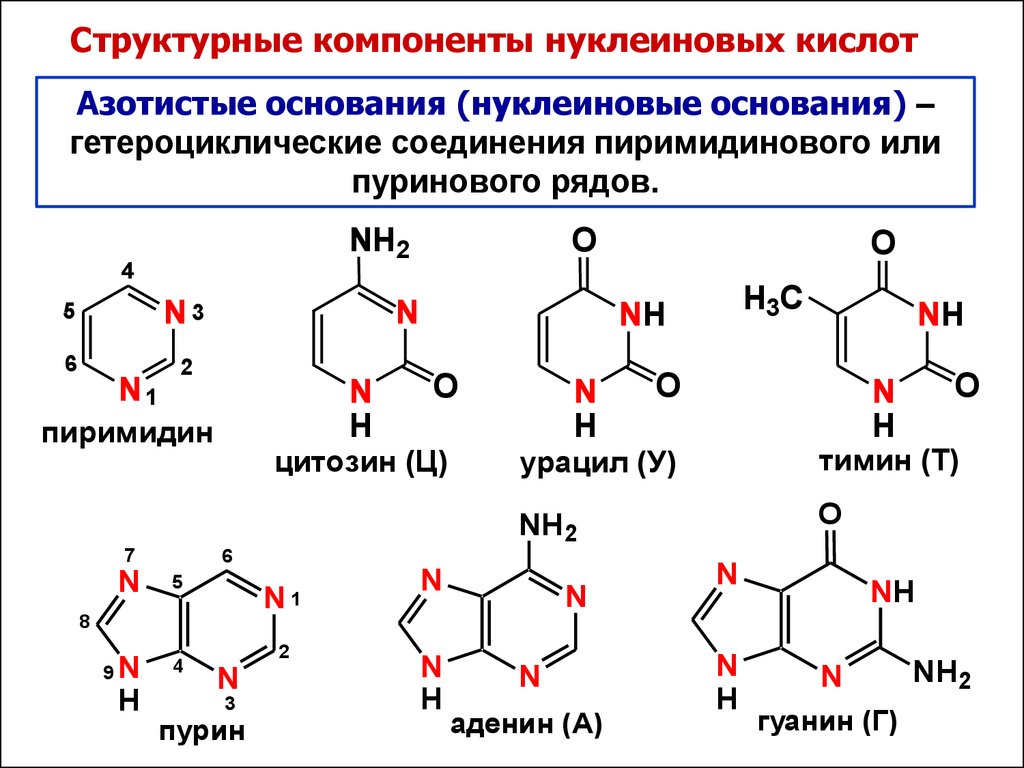 Пурин, пиримидин. В основе каких нуклеотидов оснований лежат?   Пурин лежит в основании аденина и гуанина, а пиримидин лежит в основании цитозина, урацила и тимина Псевдонулеозиды (минорные нуклеотидные). Псевдонуклеозиды (минорные нуклеотидные)— остатки обычных нуклеотидов по основаниям или углеводному остатку, т. е. сохраняется общая структура нуклеотида и к нему добавляется или убавляется определенная часть вещества. ЗАДАЧА Расчет молекулярной массы по брутто-формуле Чтобы решить, надо просуммировать все молярные массы атомов данного вещества. НУКЛЕИНОВЫЕ КИСЛОТЫ Построение комплементарных последовательностей для ДНК/РНК Для ДНК А-Т, Г-Ц. Для РНК А-У, Г-Ц, где А – аденин Т – тимин Г – гуанин Ц – цитозин У – урацил ЗАДАЧА Таблица ген кода (Учитывать, что считывание с 5" конца матрицы) 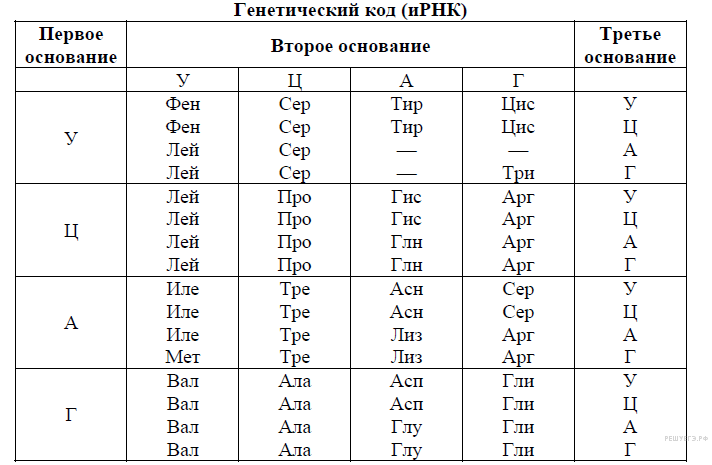 УГЛЕВОДЫ. МОНОСАХАРИДЫ 1Формулы основных моносахаридов   Глюкоза, манноза, галактоза, рибоза, арабиноза 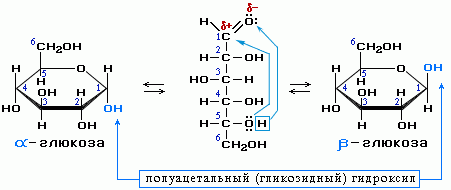 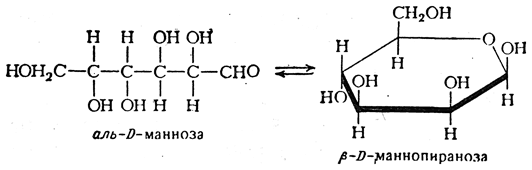 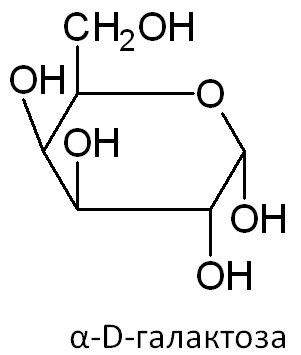 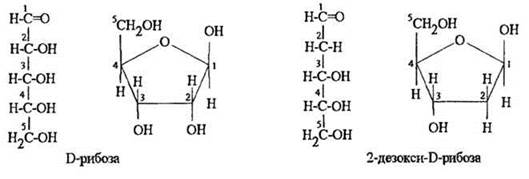 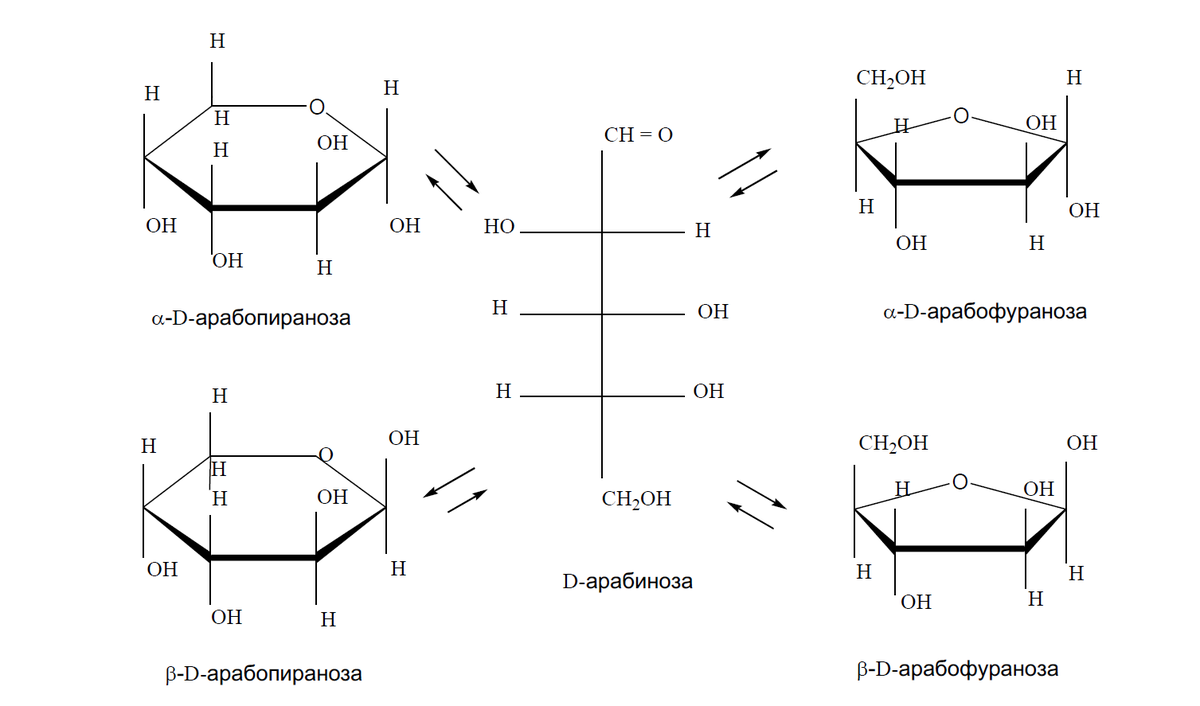 Сахара с замещенными группами (аминосахара: глюкозамин, маннозамин, галактозамин) Глюкозамин 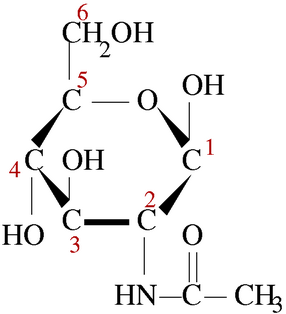 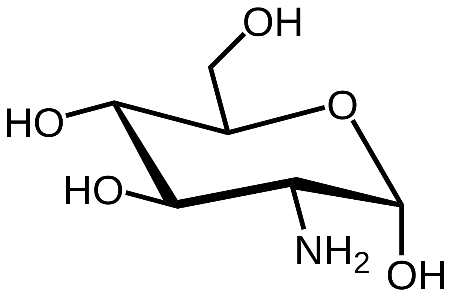 Маннозамин 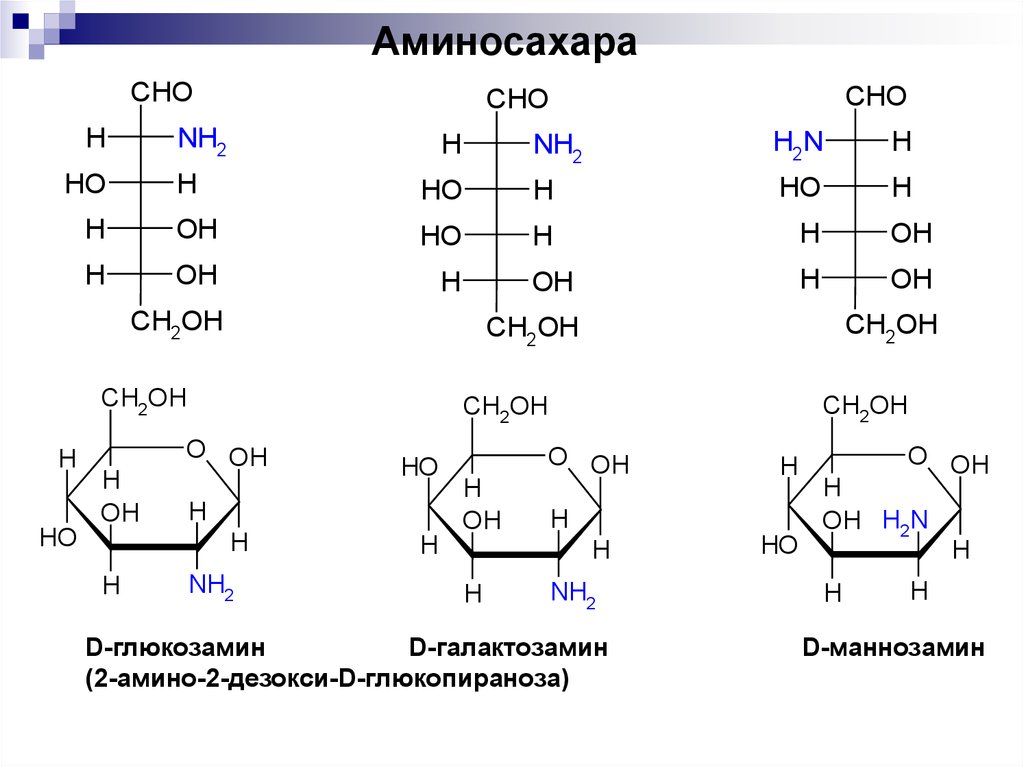  Галактозамин 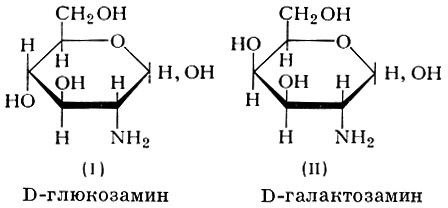 Ацетил-заместитель 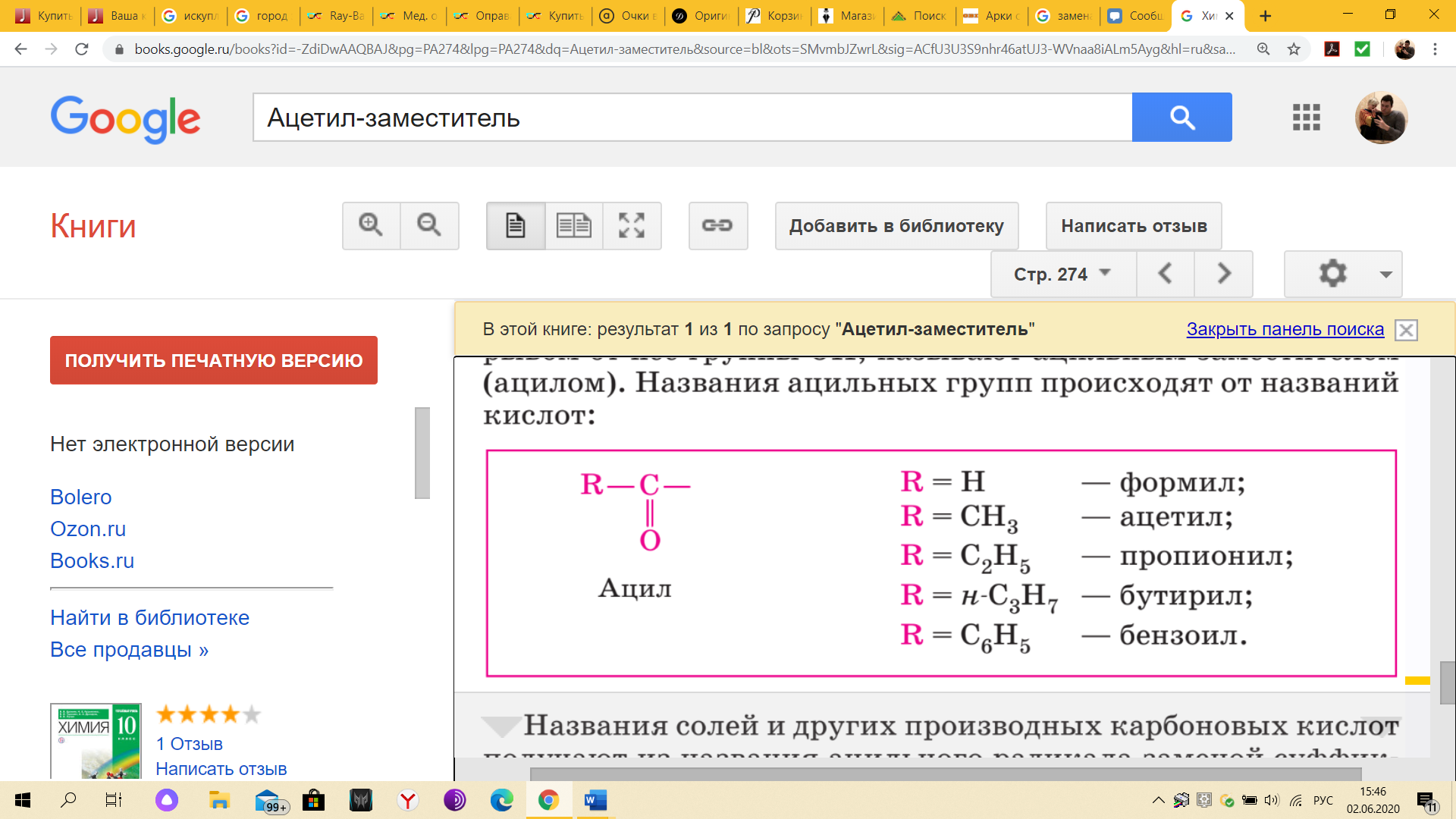 ЛИПИДЫ Насыщенные и ненасыщенные жирные кислоты Насыщенные 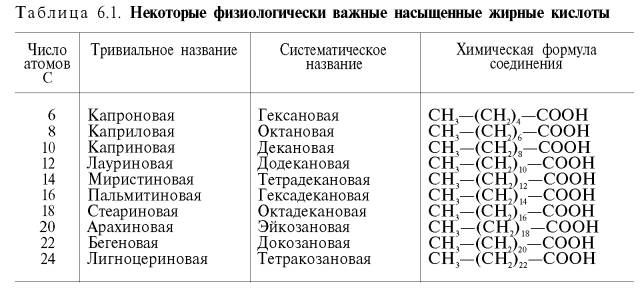 Ненасыщенные  Из какой жирной кислоты получаются простагландины? Простагландины синтезируются из незаменимых жирных кислот (НЖК).Таких, как Гамма-линоленовая кислота (GLA), Арахидоновая кислота (AA;C19H31COOH), Эйкозапентаеновая кислота (ЭПК) - Заменимые/незаменимые жирные кислоты Какие липиды входят/НЕ входят в состав клеточных мембран? Фосфолипиды - наиболее важная группа липидов в составе мембран, они подразделяются на две группы: глицерофосфолипиды (осн. структурные компоненты биологических мембран эукариотических организмов) и сфингофосфолипиды. Фосфатидилхолин (ФХ) является основным мембранным компонентом клеток высших животных и растений, его содержание достигает более 50% от суммы фосфолипидов. В бактериальных клетках ФХ не содержится. Фосфатидилэтаноламин (ФЭА) содержится в тканях животных и растений в меньших количествах, чем ФХ (15 - 30% от общего количества фосфолипидов), но является одним из основных компонентом мембран бактериальных клеток. В плазматических мембранах животных клеток широко распространен сфингомиелин (церамид-1-фосфорилхолин). Гликоглицеролипиды широко представлены в мембранах хлоропластов растений (моногалактозилдиглицерид составляет половину от всех липидов тилакоидной мембраны), они обнаружены также в заметных количествах в сине-зеленых водорослях и бактериях. Какие вещества входят в билипидный слой? (сфинголипиды и фосфолипиды, вроде бы) Углеводородные цепи молекул фосфолипидов, к-ые находятся в жидкокристаллическом состоянии; молекулы белков, способные передвигаться по мембране. Классификация липидов (нейтральные, заряженные) (какие фосфолипиды заряжены положительно/отрицательно) Сфинголипиды разделяют на фосфосфинголипиды (сфингомиелин или по-другому церамид-1-фосфорилхолин) и гликосфинголипиды. Структура гормонов стероидных (с холестерином) 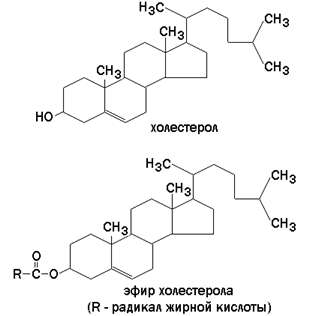 Какие витамины явл-ся производными от липидов? Витамины D,E,K Гидролиз липидов (на какие компоненты распадется)? На жирные кислоты и глицерин ВИТАМИНЫ. ГОРМОНЫ. Строение, биосвойства 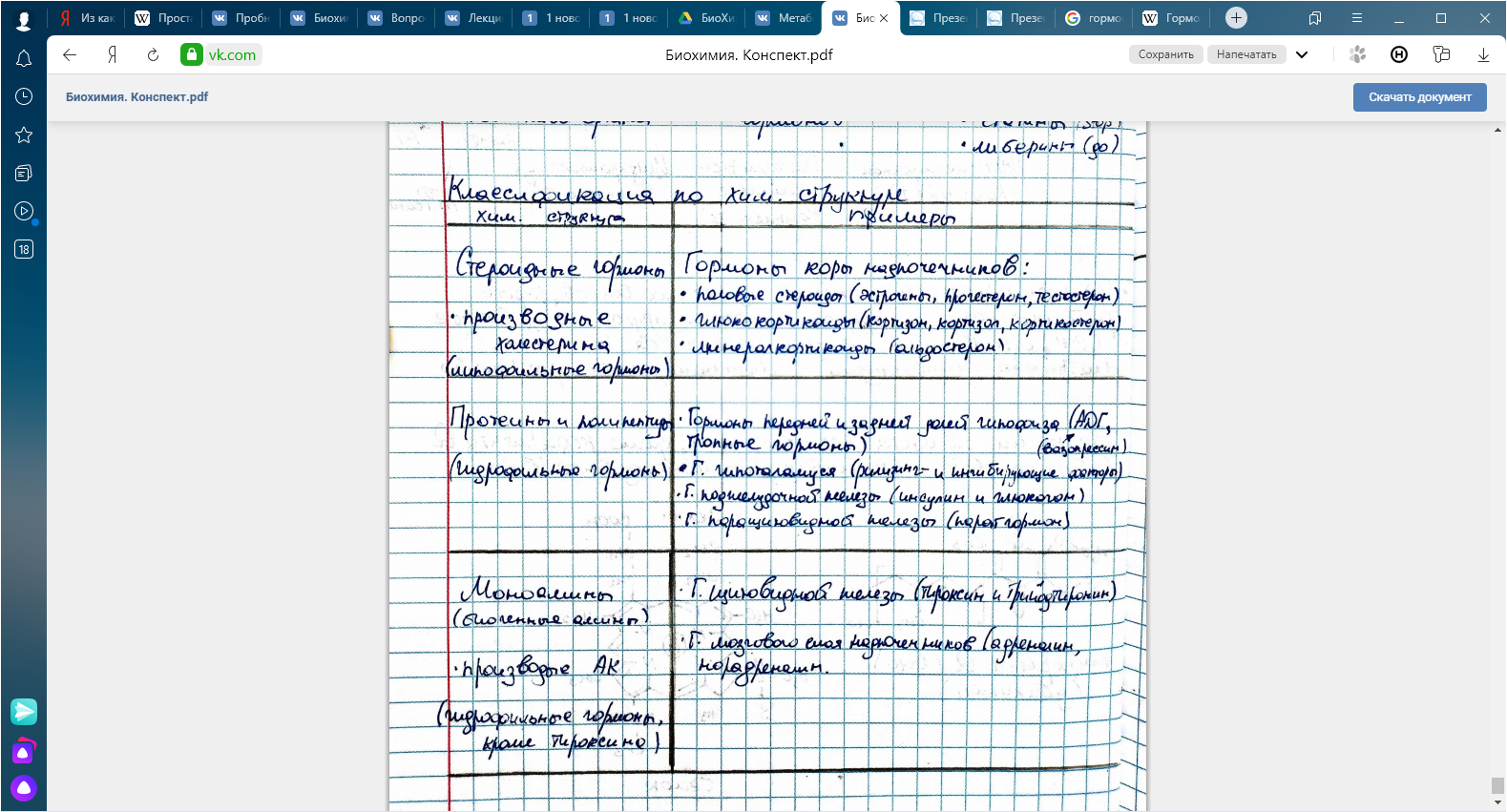 В живых организмах существует много пептидов в качестве самостоятельных соединений. Многие свободные пептиды обладают высокой биологической активностью, например, к пептидам или полипептидам относится ряд гормонов. Гормоны служат химическими медиаторами, они синтезируются в специализированных секреторных клетках эндокринных желез поджелудочной железы, гипофиза и надпочечников; с током крови гормоны переносятся в другие ткани или органы и регулируют их специфические функции. Гормон инсулин, вырабатываемый клетками поджелудочной железы, поступает с кровью в другие органы, особенно в печень и мышцы, где связывается с находящимися на поверхности клеток рецепторами и стимулирует способность этих клеток использовать глюкозу в качестве метаболического топлива. Инсулин состоит из двух полипептидных цепей, одна из которых содержит 30 а.к. остатков, а другая 21. К полипептидным гормонам относится также другой гормон поджелудочной железы, глюкагон, действующий как антагонист инсулина; гормоны гипофиза кортикотропин (39 а.к.), окситоцин (9 а.к.), вазопрессин (9 а.к.). Витами́ны (от лат. vita «жизнь» + амин) — группа низкомолекулярных органических соединений относительно простого строения и разнообразной химической природы. Это сборная по химической природе группа органических веществ, объединённая по признаку абсолютной необходимости их для гетеротрофного организма в качестве составной части пищи (в общем случае — из окружающей среды). Витамины выполняют каталитическую функцию в составе активных центров разнообразных ферментов, а также могут участвовать в гуморальной регуляции в качестве экзогенных прогормонов и гормонов. Заменимые/незаменимые витамины Заменимые: витамин D, который образуется в коже человека под действием ультрафиолетового света; витамин A, который может синтезироваться из предшественников, поступающих в организм с пищей; и одна из форм витамина B3 — ниацин, предшественником которого является аминокислота триптофан. Кроме того, витамины K и В7 обычно синтезируются в достаточных количествах симбиотической бактериальной микрофлорой толстой кишки человека. Незаменимые: Большинство витаминов не синтезируются в организме человека и полностью должны поступать с пищей. Холин (витамин B4),фолат (фолиевая кислота, витамин B9, витамин M),ниацин (витамин B3, витамин P, витамин PP),пантотеновая кислота (витамин B5),рибофлавин (витамин B2, витамин G),тиамин (витамин B1),витамин A (ретинол),витамин B6 (пиридоксин, пиридоксамин или пиридоксаль),витамин B12 (кобаламин),витамин C (аскорбиновая кислота),витамин D (эргокальциферол или холекальциферол),витамин E (токоферол),витамин K (нафтохиноны). Жиро- и водорастворимые витамины. Витамины делятся на две большие группы - водорастворимые и жирорастворимые. К водорастворимым витаминам относятся: витамины С, В1, В2, В3 (РР), В6, В12, фолиевая кислота, пантотеновая кислота и биотин. Их основная особенность - не накапливаться в организме совсем либо их запасов хватает на очень продолжительное время. К жирорастворимым витаминам относятся: витамины А, Д, Е и К. Их основная особенность - способы накапливаться в тканях организма, в основном, в печени. Для какого витамина наибольшая суточная потребность? B13 (оротовая кислота) Витамины, выступающие в качестве коферментов Коферменты – органические природные соединения небелковой природы, необходимые для осуществления каталитического действия ферментов. Фосфорилированные формы витаминов группы B Переносчики Н+ - ФАД И НАД (увидеть у них витаминную часть) 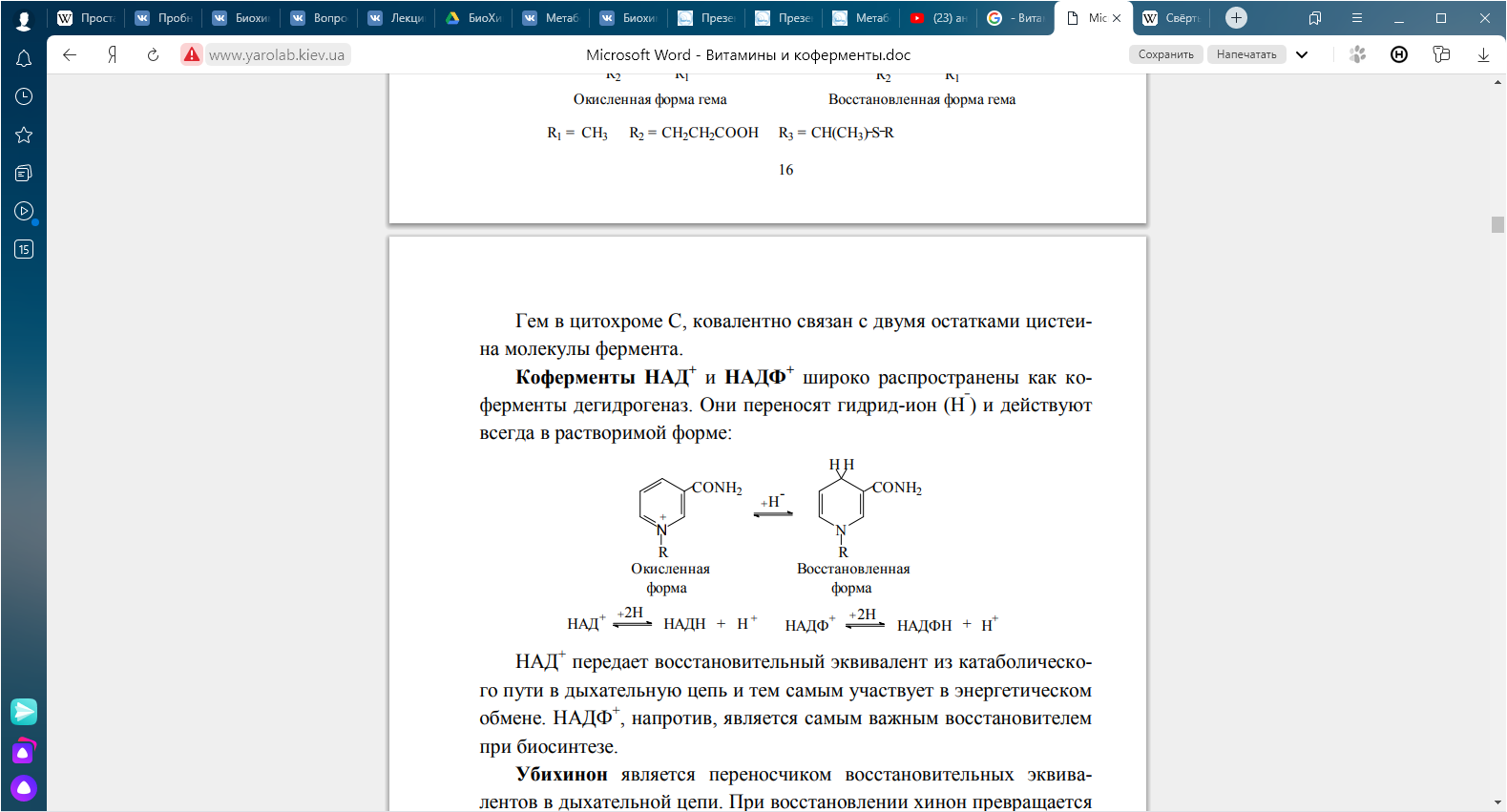 Кофермент А (найти витаминную часть) Кофермент А является водорастворимым коферментом ацилтрансфераз – ферментов, катализирующих реакции переноса ацильных групп. Сокращенно его обозначают как КоА (СоА) или, если 22 требуется записать химическими символами связанный с ним ацильный остаток, его записывают как КоА-SH. В организме КоА образуется из пантотеновой кислоты (витамин В3), цистеамина и АТФ. С химической точки зрения КоА представляет собой эфир пантетеина по γ-гидроксильной группе пантоевой кислоты и 3′-фосфоаденозин-5′-дифосфата по 5′-дифосфатной группе - Стероиды. Что это такое. Как их отличить. (есть вопрос "что НЕ является стероидом")  - Кальмодулин. Строение. Основные функции - Кальмодулин. Строение. Основные функцииОсновные заболевания от недостатка витаминов Цинга, остеопороз, цинга, пиллагра, рахит, склероз, бери-бери Витамины, участвующие в переносе амино-групп / СО2-групп 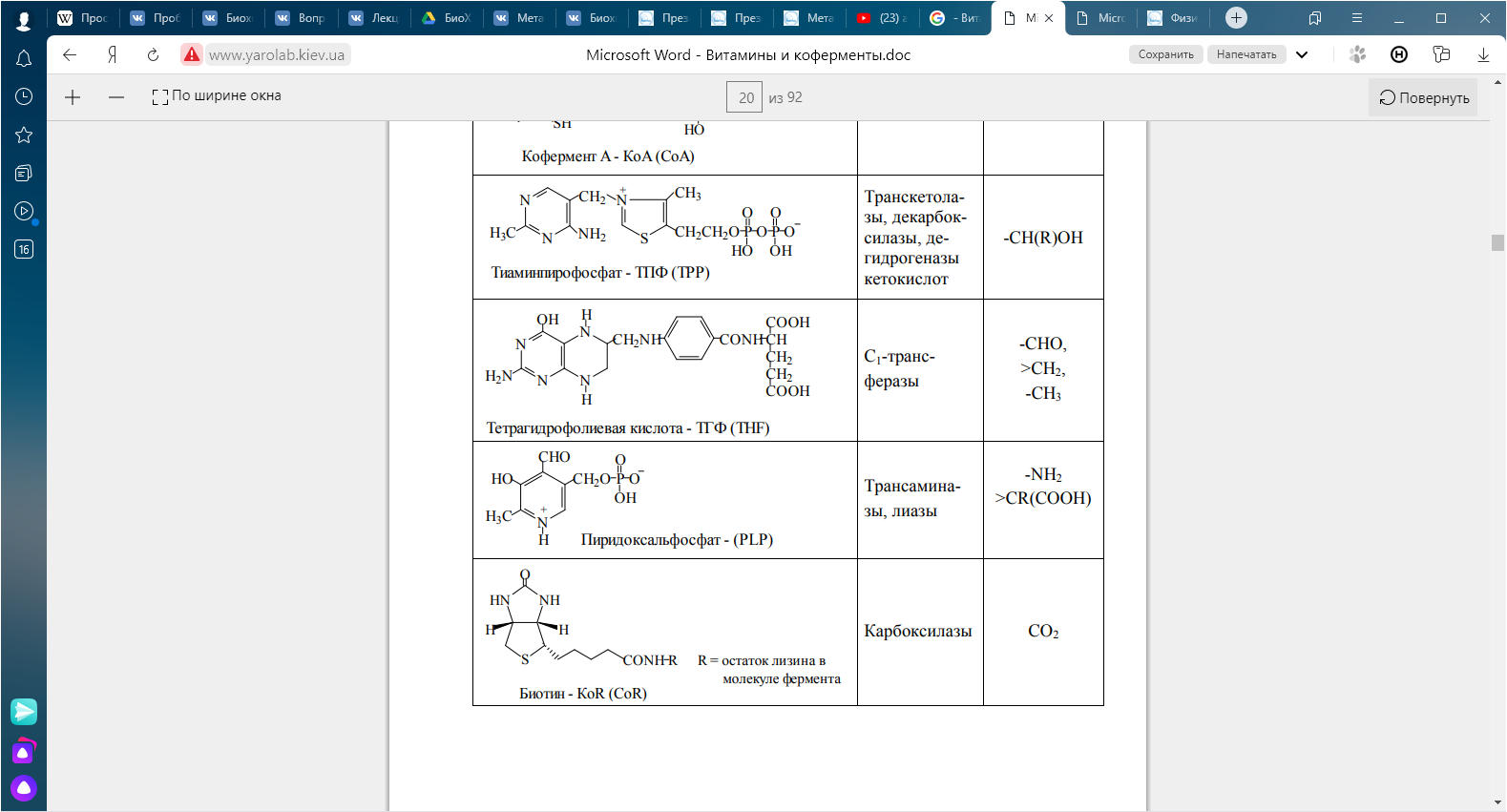 Кортикостероиды (какие гормоны относятся/не относятся). Функции. 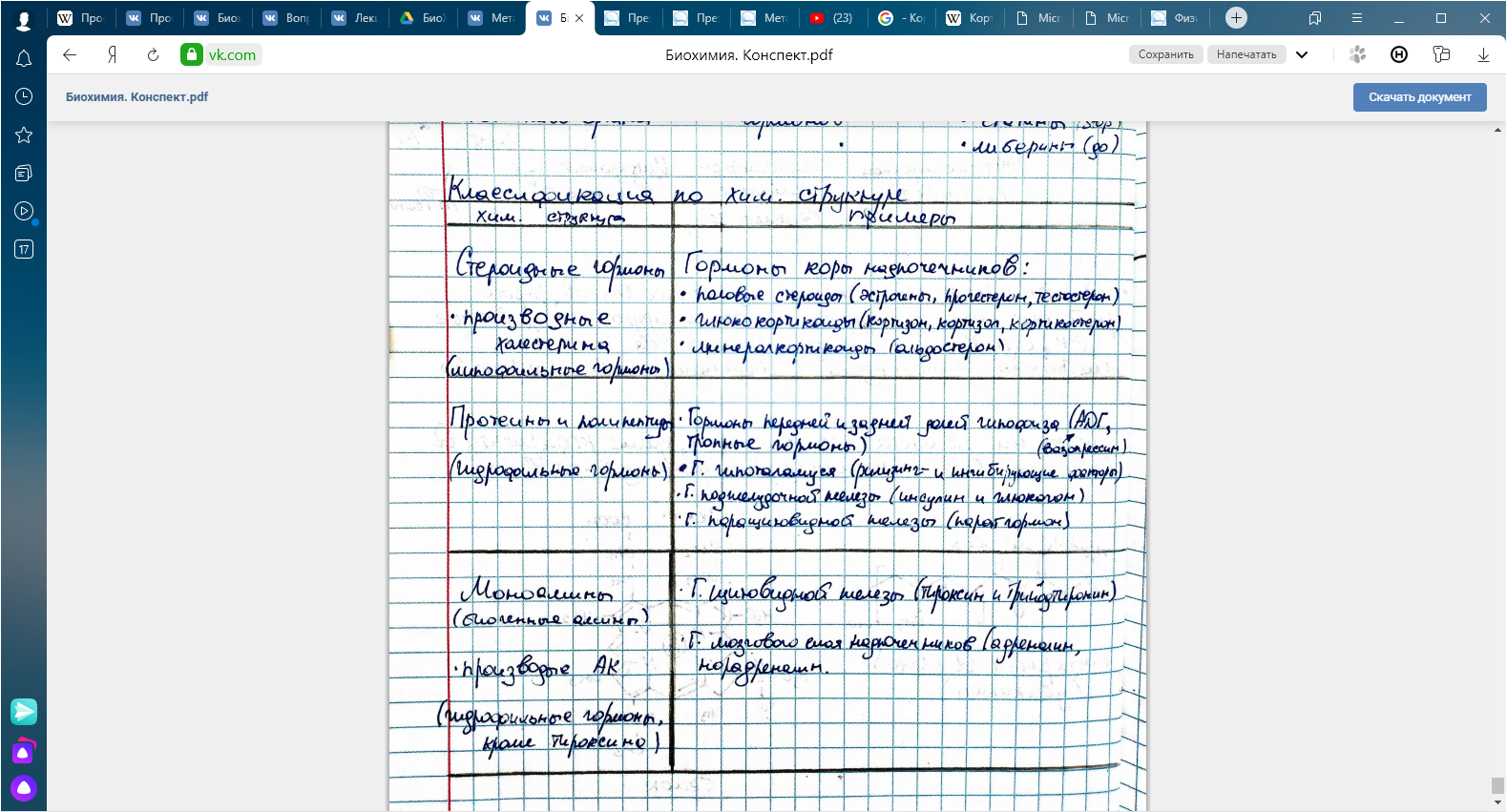 Какой витамин участвует в процессе свертывания крови? Витамин K (филлохинон, антигеморрагический витамин) - Что такое аведин и с каким из витаминов взаимодействует Какой витамин отсутствует в растительной пище? В12 - Гормоны: адреналин, глюкагон, кортизол, окситацин. Структура и природа Гормоны пептидной природы: (какой-то из них верный, посмотреть какой) Кальцийтриол, андростерон, кортизол, окситацин МЕТАБОЛИЗМ Гликолиз. Особенности (этапы: аэробный и анаэробный и какие конечные продукты в каждом случае) Гликолиз – распад глюкозы, завершающий образованием лактата в отсутствие кислорода (анаэробный гликолиз) или образованием пирувата в присутствии кислорода (аэробный гликолиз). Основные ферменты гликолиза. Глюкокиназа (гексокиназа), Фосфоглюкоизомераза, Фосфофруктокиназа, Альдолаза, Триозофосфатизомераза, Глицеральдегид-3-фосфатдегидрогеназа, Фосфоглицераткиназа, Фосфоглицератмутаза, енолаза, пируваткиназа Фосфофруктокеназа - лимитирует подготовительной фазы гликолиза.  Гидролиз лактозы. Какие продукты образуются. 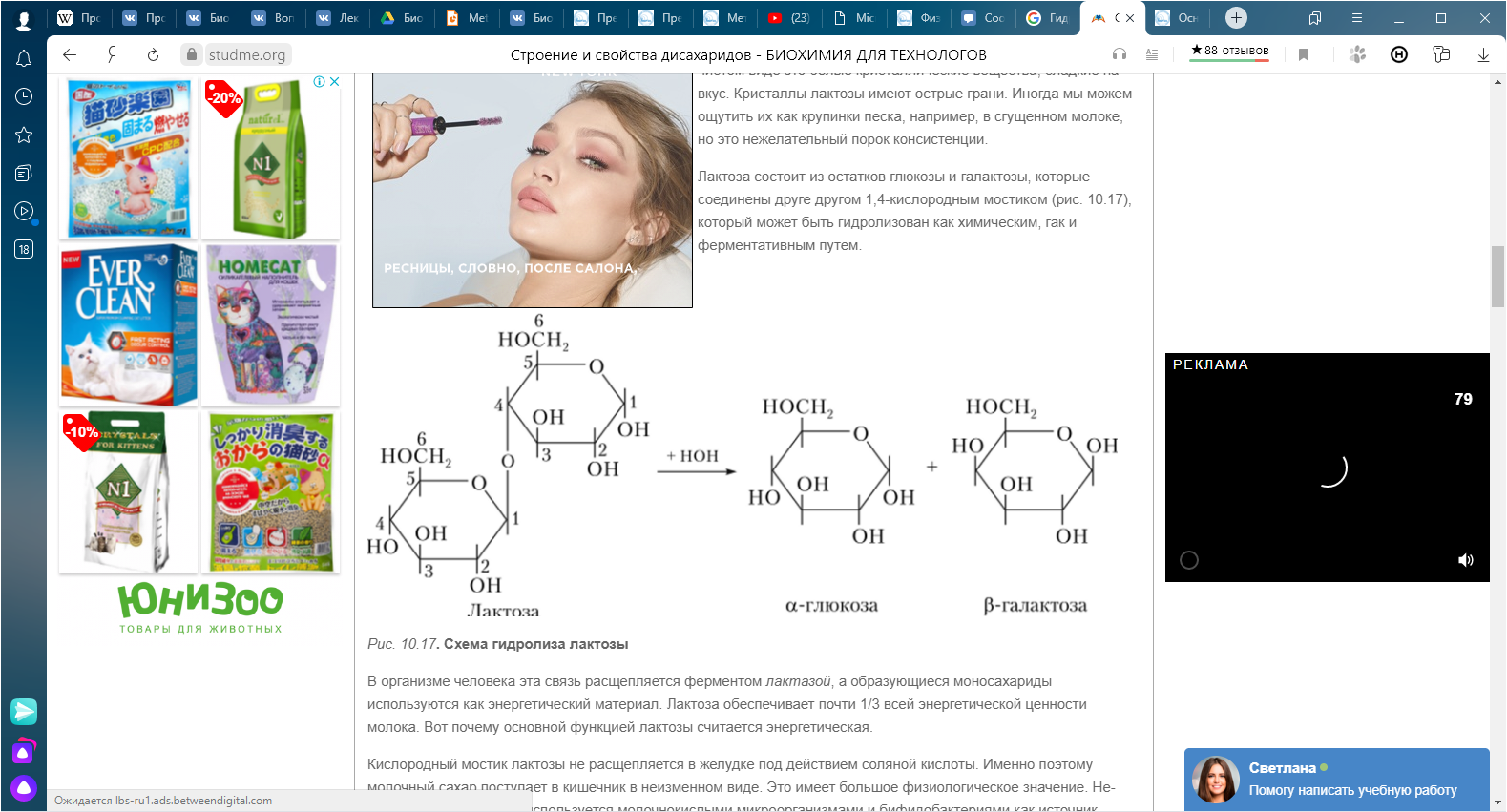 Макроэрги. Примеры. Гликоген. Где больше всего содержится. Продукты распада. Ферменты пентозофосфотного пути. Глюкозо-6-фосфатдегидрогеназы и кофермента НАДФ+, 6-фосфоглюко-натдегидрогеназа (декарбоксилирующая), изомераза Основные субстраты. - Фосфофруктокиназа. Чем активируется. АТФ мэй би - Ответ на вопрос: ТПФ (тиаминпирофосфат) не участвует в гликолизе Аллостерические ферменты. Дегидрогеназа в цикле Кребса. Почему она относится к аллостерическим ферментам. Аллостерические ферменты — регуляторные ферменты, для которых характерно изменение каталитической активности в процессе нековалентного связывания метаболита в участке, не являющемся каталитическим центром - Норм концентрация холестерина в крови - 5 млмоль/л Авторы: https://vk.com/id253220408 , https://vk.com/aefremov1999 , https://vk.com/1belka8 |
