Клонирование и трансгенез животных. Совр пробл биол. Клонирование и трансгеноз животных по дисциплине Современные проблемы биологии
 Скачать 0.87 Mb. Скачать 0.87 Mb.
|
|
Карл Иллмензее исследовал, насколько дифференцированные ядра дрозофилы способны обеспечить нормальное развитие из яйца. Оказалось, что до поры, до времени зародыш развивается нормально, но уже на ранних стадиях эмбриогенеза наблюдаются отклонения от нормы, возникают уродства, и такой эмбрион не способен превратиться даже в личинку, не говоря уже о взрослой мухе! У лягушки, как существа менее развитого, чем млекопитающие, ядерные изменения менее выражены, и то, во-первых, процент успеха при клонировании, как уже отмечалось, невысок (1-2%), во-вторых, даже те лягушки, которые достигают в опытах по клонированию взрослого состояния, не без дефектов, так что о точном копировании донора, к сожалению, трудно говорить даже в этом простейшем случае. Но млекопитающие значительно сложнее лягушек по своему устройству и степени дифференцированности клеток. Естественно, у них процент успеха будет, по крайней мере, не выше (о чем и свидетельствуют результаты опытов Янагимачи). В связи с этим встает проблема — как возвратить изменившиеся ядра соматических клеток в исходное состояние, чтобы они могли обеспечить нормальное развитие той яйцеклетки, в которую их трансплантировали. Успех будет зависеть от того, удалось ли «поймать» такую соматическую клетку (из числа так называемых стволовых), ядро которой еще не утратило свой потенциал, да еще и не повредить это ядро в процессе сложных хирургических с ним манипуляций. Кроме всего прочего, условия развития в матке разных приемных матерей будут различаться, а существует такое понятие как норма реакции — т. е. определенные пределы колебаний проявления данного гена в фенотипическом признаке. Это означает, что в разных условиях развития зародыша одинаковые гены будут обнаруживать свое действие немножко по-разному. А ведь таких генов — тысячи! Следовательно, вероятность полного сходства «клонированных» животных будет не очень велика. Но даже если все проблемы удастся решить и все трудности преодолеть, клонирование человека едва ли будет реальным. Действительно, допустим, что трансплантировали развивающиеся яйцеклетки с чужеродными ядрами нескольким сотням приемных матерей (ведь процент выхода низкий!), чтобы получить хотя бы одну единственную живую и точную копию видного политического деятеля. А что будет с остальными зародышами? Ведь большая часть погибнет в утробе матери или разовьется в уродов, некоторые из которых, к несчастью, родятся. Страшные последствия таких экспериментов — сотни искусственно полученных человеческих уродов! (Неслучайно «создатель» Долли Ян Вильмут вместе с выдающимся специалистом по эмбриологии млекопитающих Янишем в 2001 г. опубликовали в журнале «Science» заметку «Не клонируйте людей!»). Во многих странах мира изданы законы, запрещающие клонирование людей и манипуляции с эмбрионами, в том числе в России. Что касается млекопитающих, то можно говорить о том, что техническая задача получения «клонированных» животных решена, однако, как уже говорилось, основной вопрос заключается в том, насколько точно эти животные будут копировать соответствующий прототип. И второй вопрос — оправдают ли результаты работ по получению подобных клонов те затраты, которых они потребуют. Все дело в том, что состояние здоровья клонированных животных вызывает серьезные опасения. Продолжительность жизни клонированных животных ниже нормы. Так, овечка Долли дотянула лишь до половины средней продолжительности жизни овец, промучившись более 6 лет. Ее австралийский «двойник» — Матильда погибла через два года после рождения. Клонированные в различных лабораториях мыши характеризуются пониженной жизнеспособностью и «выдерживают» на этом свете не более половины средней продолжительности жизни, их обучаемость по сравнению с «исходным образцом» оставляет желать лучшего (это к вопросу о клонировании гениев! Как бы вместо гениев не получились идиоты). Следовательно, практическое использование клонирования млекопитающих весьма проблематично. Тем не менее, опыты по клонированию продолжаются, поскольку они имеют важное фундаментальное значение. Только в таких экспериментах можно понять, что же все-таки происходит с клеточным ядром, с его компонентами, с ДНК в процессе индивидуального развития, как взаимодействуют генные сети в ходе клеточной дифференцировки и можно ли этой дифференцировкой управлять. 3. Достижения в области клонирования животных После рождения Долли путем клонирования появилось много животных, представляющих несколько видов млекопитающих. Успешно были клонированы свиньи, овцы, козы,кошки, кролики, коровы (десять клонированных телят родились от одной взрослой коровы породы джерси) и, совсем недавно, мул (но пока не собаки и не обезьяны). Клонированный мул по кличке Айдахо-Джем привлек к себе особое внимание, поскольку этот биологический вид – гибрид лошади и осла – в нормальных условиях не может иметь потомства. Примечательно, что клонирование не всегда приводит к внешнему сходству, как обстояло дело с клонированной в 2001 г. домашней кошкой Си-Си, которая своим окрасом отличалась от генетического донора. За окрас кошки "отвечают" несколько генов, присутствующих в Х-хромосоме, и некоторые из них произвольно теряют активность в ходе развития зародыша кошек - самок, поскольку у них две Х-хромосомы. Таким образом, некоторые клетки, даже полученные у одного и того же донора, будут "окрашивать" кошку в черный цвет при подавлении других цветообразующих генов, тогда как другие клетки, помещенные в энуклеированное ядро и развившиеся в котенка, дадут рыжий окрас. Основной целью развития методики клонирования животных является содействие их генетической инженерии (трансгенозу). Как правило, новая ДНК, предназначенная изменить гены животных, может вводиться лишь в совсем молодые эмбрионы, обычно на стадии одной или двух клеток. Но будут ли эти гены приняты зародышем, полностью зависит от случайности. Поэтому доля успешных экспериментов очень мала, а сам процесс очень трудоемкий. При клонировании ДНК вводится в выращенные в лабораторных чашках клетки, число которых достигает нескольких тысяч или даже миллионов. Затем появляется возможность определить, какие клетки интегрировали перенесенную ДНК, и лаборанты могут пересадить такие клетки в энуклеированные яйцеклетки в целях развития зародышей, содержащих модифицированную ДНК. Таким образом, клонирование животных представляло бы интерес для некоторых отраслей фармацевтической промышленности и производства продуктов питания, если бы смогло обеспечить постоянный выпуск высококачественной рыночной продукции, такой, как молоко или мясо, терапевтических белков из козьего или коровьего молока либо белка куриного яйца (так называемый "фарминг") или даже внутренних органов свиньи для пересадки человеку без риска отторжения его иммунной системой. В 1997 г. биотехнологическая компания PPL Therapeutics Inc. совместно с Рослинским институтом клонировала овцу по кличке Полли из генетически измененной зародышевой клетки. В молоке Полли содержится белок, вызывающий свертывание крови человека, который может быть использован для лечения гемофилии. Международные нормы регулирования такой методики пока что не установлены, а те или иные эксперименты по клонированию животных тем временем продолжаются. Сообщения об успешном клонировании животных привлекают внимание общественности, однако результаты, которых добиваются ученые, далеко не безупречны. Уровень выхода жизнеспособных клонированных эмбрионов зависит от биологического вида и типа используемых клеток, однако остается, как правило, очень низким. Даже при успешных родах у клонированного животного наблюдается целый ряд аномалий и дефектов, в том числе так называемый синдром большого (крупного) потомства: клонированные животные часто оказываются слишком крупными для нормальных родов, а плацента разрастается больше нормы. Такие дефекты пока что до конца не объяснены, но одной из возможных причин может быть неполное репрограммирование ядра, пересаженного из соматической клетки. Одни считают, что такие проблемы методики клонирования будут решаться по мере развития научного прогресса, другие утверждают, что клонирование абсолютно здорового потомства невозможно в принципе и что даже вполне здоровые на первый взгляд клонированные животные могут иметь генетические болезни. Вымершие виды, которые проще всего клонировать[2]. Несмотря на то, что вымирание видов – процесс естественный, и в живой природе это происходит регулярно, защитники природы весьма жалеют об утрате некоторых из них и не прочь повернуть время вспять. Учёные уже задумываются о возможности клонирования некоторых животных с хорошо сохранившейся цепочкой ДНК. Наиболее вероятными кандидатами являются следующие виды. 1. Это, конечно же, всем знакомый мамонт, размеры которого немногим отличаются от размеров современного слона, а генетического материала предостаточно. Если бы не политическая истерия вокруг клонирования, вполне вероятно, что мы уже могли бы лицезреть первых мамонтов в зоопарке. 2. Почему бы не возродить самую большую птицу в мире – гигантскую моа? Тем более, что её птенцы без проблем может высидеть обыкновенная страусиха. Извлечение ДНК моа из её костей и яиц, найденных в новозеландских пещерах, возможно. 3. Шерстистый носорог, как и мамонт, почти не отличается от своих потомков, и его ДНК находится в отличном состоянии. 4. Сумчатый волк. Последний сумчатый волк (тилацин) из зоопарка Хобарта отправился в мир иной в 1936 году. 5. Саблезубые тигры могли бы снова появиться если не в лесах, то хотя бы в зоопарках… если бы не два препятствия. Во-первых, их останки, сохранившиеся более-менее прилично, лежат в смоляных шахтах Ла-Брея – следовательно, извлечению цепочки ДНК препятствует смола. Во-вторых, получить разрешение и достать мать-донора будет достаточно тяжёлой задачей, ведь тигры сейчас занесены в Красную Книгу. 6. Если бы не запрет на клонирование человека, учёные в первую очередь озаботились бы воссозданием неандертальцев. Также можно было бы клонировать такие виды как ирландский лось, короткомордый медведь, гигантский ленивец и глиптодон, если бы не их размеры. Основная сложность в их клонировании заключается в нахождении подходящей суррогатной матери – все самки близких видов слишком малы [2]. 4. Трансгеноз животных Термин «трансгеноз» возник в начале 70-х годов, значительно ранее того момента, когда он стал использоваться в современном значении этого слова. Первоначально им обозначали перенос генов в клетки, растущие в культуре, т.е. in vitro. В настоящее время этот термин используют применительно к переносу генов в целые организмы (система in vivo), а сами такие генетически измененные организмы называют трансгенными. В 1980 г. Гордон с помощью микроинъекций "голой" ДНК в мужской пронуклеус зиготы мыши получил первых животных, содержавших в своем геноме искусственно введенную экзогенную ДНК. Такие животные в дальнейшем и были названы трансгенными, а сам процесс их получения - трансгенозом. Первоначальный вариант трансгеноза, использованный Гордоном, сейчас называют классическим (рис. 5). С развитием техники молекулярного клонирования генов число публикаций по получению и исследованию трансгенных мышей стремительно росло, постепенно расширялся спектр проблем и задач, решаемых с помощью трансгеноза. Одной из самых впечатляющих работ на ранних этапах развития трансгеноза были эксперименты Пальмитера с соавт. (1982) по микроинъекции в зиготы мышей гена гормона роста крысы, находящегося под контролем сильного промотора гена металлотиенина мыши МТ-1мыши. Перенос такого искусственного конструкта привел к ускоренному росту мышей и значительному увеличению веса трансформированных животных, развившихся из прооперированных зигот (рис. 6). 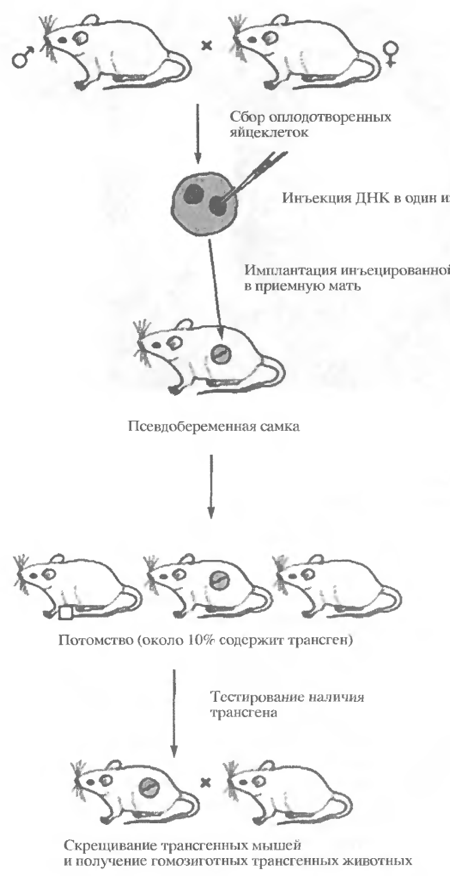 Рисунок 5 - Классическая схема трансгеноза [3] Вскоре анализу экспрессии в организме мышей были подвергнуты сотни структурных генов, генов различных вирусов, онкогенов, антионкогенов и др. К середине 80-х годов были начаты эксперименты по созданию трансгенных сельскохозяйственных (с/х) животных. К этому времени были подобраны оптимальные условия для визуализации пронуклеусов зигот с/х животных, поскольку большинство зигот имеет значительное количество пигментных и жировых гранул, затрудняющих процесс микроинъекции. Попытки переноса гена гормона роста быка, овец, человека, гена рилизинг-фактора гормона роста человека (выход гормона роста в кровь находился под контролем эндогенных регуляторов) в дальнейшем были продолжены на зиготах овец, свиней, кроликов и рыбах как в нашей стране, так и за рубежом.  Рисунок 6 - Трансгенная мышь с геном гормона роста быка (слева) и контрольная [3] Трансгеноз открыл новые пути направленного изменения продуктивности разных видов с/х животных (повышение темпов роста, изменение количества и качества молока, шерсти, увеличение плодовитости), получения животных - биореакторов ценных биологически активных препаратов (таких как фактор свертываемости крови, альфа-антитрипсин, гемоглобин и антитела в молоке, крови или моче), создание новых форм и пород животных, приспособленных к биомедицинским исследованиям, которые могут быть источниками органов для ксенотрансплантации, пород, устойчивых к различным заболеваниям. В частности, с успехом для направленной экспрессии фармакологически ценных белков используются гены, кодирующие основные белки молока - казеины. В России, например, в 1999 г. были получены трансгенные мыши, экспрессирующие в молоко ценный медицинский препарат - гамма-интерферон человека (600 мкг гамма-интерферона на 1 мл молока). Соответствующая генетическая конструкция может быть использована для получения трансгенных коз, в молоке которых будет экспрессироваться лекарственный белок. Вместе с тем с самого начала работ по трансгенозу были выявлены некоторые сложности, связанные с этой технологией. В первую очередь процедура получения трансгенных животных пока еще остается малоэффективной. Трансгенные животные часто менее жизнеспособны, чем природные особи. Имеются проблемы и со стабильностью экспрессии трансгена. Все это, а также ряд других причин, включая настороженное отношение общественности к данной проблеме, и обусловили ту ситуацию, что до сих пор трансгенные животные (в отличие от трансгенных растений) находят пока лишь ограниченное применение в практике. Кроме традиционного (классического) способа введения чужеродной ДНК с помощью микроинъекций в пронуклеус зиготы, получили развитие новые системы и способы переноса генов в геном животных (рис. 64). Они позволяют повысить эффективность трансгеноза, что особенно важно для дорогостоящих экспериментов в области биотехнологии с/х животных. Показано, например, что эффективность получения с помощью микроинъекций трансгенных коров, по меньшей мере, в 40 раз ниже, чем у мышей. Одним из таких альтернативных подходов является использование сперматозоидов в качестве векторов для привнесения чужеродной ДНК в яйцеклетку при ее искусственном оплодотворении. Известно, что сперматозоиды ряда видов животных в отсутствие семенной жидкости способны захватывать чужеродную ДНК. Легкость и простота использования этого метода привели к многочисленным попыткам трансформировать таким образом геном мышей, свиней, крупного рогатого скота, овец, рыб, морского ежа, насекомых, птиц, шпорцевой лягушки, моллюсков. Необходимо отметить, однако, что существует опасность непреднамеренного введения экзогенного генетического материала, который может случайно находиться в окружающей среде, при использовании метода внутрицитоплазматической инъекции сперматозоидов (ICSI) в клиниках по искусственному оплодотворению человека. Показано также, что отмывка сперматозоидов человека после инкубации в растворе с ДНК вируса папилломы человека не приводила к полному удалению экзогенной ДНК из клеток. Часть ДНК прочно связывалось со сперматозоидами и интернализовалась вместе с ними. Еще одним подходом, обеспечивающим увеличение эффективности переноса генов, является использование в качестве векторов ретровирусов. Основное преимущество этих векторов заключается в том, что они способны эффективно инфицировать большое число различных клеточных типов. Чтобы избежать опасности неконтролируемого распространения ретровирусов, используют дефектные по репликации вирусные векторы с вирусом-помощником. Ретровирусные векторы обеспечивают интеграцию единичной копии трансгена в эмбрионы на разных стадиях развития. Однако успешная интеграция вирусного генома с хозяйским геномом происходит только в митотически активных клетках (исключение составляют лентивирусы). Показано, что для транслокации ретровируса в ядро клетки обязателен разрыв ядерной оболочки. Основываясь на этом, Чан с соавт. в 1998 г. предложили новый метод введения ретровирусного вектора в геном крупного рогатого скота, который заключался в следующем. Ооциты, находящиеся на стадии метафазы II второго деления мейоза и не имеющие ядерной оболочки на этой стадии вплоть до образования пронуклеусов после оплодотворения, инфицировали ретро-вирусным вектором, сконструированным на основе вируса мышиной лейкемии Молони (MoMLTV), упакованного в оболочку, в состав которой входил гликопротеин псевдотипа вируса везикулярного стоматита G. В результате оплодотворения инфицированных ооцитов и их культивирования in vitroчасть из них развилось до стадии бластоцисты. После переноса бластоцист реципиентам 4 эмбриона развились до рождения. И хотя количество животных, полученных таким путем, было ограниченным, все они (100%) оказались трансгенными и экспрессировали трансген. Сообщалось о рождении трансгенной обезьяны, полученной аналогичным путем. Указанный вектор, содержащий в своем составе ген, кодирующий зеленый флуоресцентный белок (GFP)под промотором гена альфа-1-фактора элонгации человека, был инъецирован под блестящую оболочку ооцитов макак резусов. Оплодотворение проводили методом ICSI. Эмбрионы на стадии дробления пересаживали суррогатным самкам. 3 эмбриона развивались до рождения, один из новорожденных оказался трансгенным и экспрессировал трансген в клетках ногтей и волос (Чан, 2001). В 2002 г. был предложен простой и эффективный метод получения трансгенных мышей, крыс и других животных путем инфицирования оплодотворенных яйцеклеток с помощью рекомбинантного лентивирусного вектора. 10-100 пкл раствора данного вектора, содержащего ген GFP, вводили непосредственно под блестящую оболочку зигот мышей. 80% полученных таким образом потомков оказались трансгенными, почти у всех потомков была обнаружена экспрессия трансгена (Луи и др., 2002). В результате прогресса в развитии трансгеноза появились возможности для крупномасштабных изменений генома, включая манипуляции с фрагментами или целыми хромосомами. Последняя технология получила название хромосомная инженерия. Ей способствовала разработка подходов к созданию искусственных хромосом млекопитающих, обязательными элементами которых являются центромера, теломеры и oriрепликации. Искусственные хромосомы предоставляют уникальную возможность для изучения взаимосвязи между хромосомными структурами и их функциями. Использование хромосомного трансгеноза позволяет осуществлять перенос очень больших генов и целых кластеров генов со всеми окружающими их природными генетическими элементами. При этом также полностью исключается негативное влияние эффекта положения на трансген. Использование нового подхода на базе эмбриональных стволовых клеток (ЭСК), получившего название опосредованного микроклетками транспорта хромосом, позволило получать химерных мышей с целыми хромосомами человека или их фрагментами (трансхромосомные мыши). В частности, были получены мыши, содержащие фрагменты хромосом человека с локусами легких и тяжелых цепей иммуноглобулинов, которые оказались способными синтезировать специфические человеческие антитела. |
