Клонирование и трансгенез животных. Совр пробл биол. Клонирование и трансгеноз животных по дисциплине Современные проблемы биологии
 Скачать 0.87 Mb. Скачать 0.87 Mb.
|
|
Молекулярные механизмы трансгеноза. При микроинъекции в пронуклеусы экзогенной ДНК встройка трансгена происходит, как правило, в единичный участок генома в виде тандемов (до 50 и более копий, расположенных чаще всего в ориентации голова-хвост). Единичные фрагменты генов удается встраивать в геном при использовании в качестве вектора ретровирусов. При этом в большинстве случаев чужеродная ДНК встраивается в произвольные участки генома. Между тем постепенно накапливаются данные, свидетельствующие о том, что существуют некоторые «предпочтительные» зоны, с которыми интегрирует экзогенная ДНК. Таковыми, по-видимому, являются транскрибирующиеся участки генома, "горячие" точки рекомбинации, области начала репликации, а также разнообразные повторяющиеся последовательности. Последние облегчают встраивание трансгенов за счет механизмов негомологичной рекомбинации. 5. Трансгенные животные и моделирование заболеваний человека Очень важным направлением использования трансгенных животных является создание моделей различных патологий человека. Это, с одной стороны, позволяет подтвердить роль тех или иных генов в определенном заболевании, а, с другой, создать модель, на которой можно более детально исследовать молекулярные механизмы нарушений и осуществлять целенаправленный подбор лекарственных средств. Использование для этих целей мышей важно с той точки зрения, что у них примерно такой же размер генома и такое же число генов, как у человека. В настоящее время с помощью трансгеноза осуществлено моделирование множества различных заболеваний человека, таких, например, как рак груди, рак простаты, нейрофиброма, эритролейкемия. диабет и др. На модели трансгенных животных проведены многочисленные исследования по выяснению роли различных онкогенов в злокачественных перерождениях клеток млекопитающих. Благодаря этим экспериментам установлено, в частности, что отдельные онкогены, перенесенные в мышей и крыс, могут определять появление у трансгенных особей опухолей в тех тканях, где они экспрессируются. Так, ген с-тус под контролем регуляторных элементов гена иммуноглобулина (гены иммуноглобулинов экспрессируются тканеспецифично в В-клетках) вызывал у трансгенных мышей лимфомы В- и пре-В-клеток, а этот же онкоген под контролем LTR вируса MMTV обусловливал возникновение аденокарциномы в молочной железе самок, т.е. в том органе, где экспрессируются гены вируса MMTV. С использованием трансгенных мышей продемонстрировано онкогенное свойство мутантного гена р53. В кооперации с онкогеном ras мутантный ген р53 вызывал злокачественное перерождение клеток. У 20% трансгенных животных возникали аденокарциномы легких, остеосаркомы и лимфомы. Полученные данные позволили прийти к заключению о том, что нормальный ген р53 является не онкогеном, а антионкогеном, продукт которого инактивируется при наличии мутантного белка р53. Другим примером моделирования патологий человека может служить болезнь Альцгеймера (БА), которая является наиболее распространенной причиной прогрессирующей деменции в пожилом возрасте. Была показана важная роль в этом мутаций в трех генах: АРР,пресенилинах 1 и 2 (PSEN1 и 2). Первые попытки смоделировать БА у млекопитающих заключались в получении трансгенных мышей, экспрессирующих ген АРР, несущий мутации, приводящие к развитию заболевания у человека. Такие мыши развивались нормально, но с возрастом накапливали множественные отложения нерастворимого амилоида, а также в ряде случаев демонстрировали отклонения в поведении. Трансгенные мыши, несущие мутант-ный ген АРР, были использованы для разработки нового подхода к терапии БА - Р-амилоидной иммунизации. Сообщалось о переносе целой экзогенной митохондриальной ДНК (мтДНК) в эмбрионы мышей. Цитопласты (энуклеированные клетки), несущие в мтДНК мутацию, связанную с энергетическим метаболизмом, сливали с эмбриональными стволовыми клетками (ЭСК) с инактивированными митохондриями. Затем эти ЭСК использовали для получения химер. В результате химерные мыши и их потомки имели ряд аномалий, сходных с клиническими проявлениями болезни человека, обусловленной аналогичной мутацией в мтДНК (Хирано, 2001). Эмбриональные стволовые клетки и таргетинг генов. Все вышеперечисленные системы получения трансгенных животных имеют тот недостаток, что вводимая этими способами ДНК интегрируется с реципиентным геномом случайным образом, зачастую в виде множества копий, часто наблюдаются перестройки трансгена, мутации в геноме хозяина вплоть до летальных. Вследствие этого нередко экспрессия одного и того же трансгена может варьировать в широких пределах у трангенных животных до полного ее отсутствия. Однако в последнее десятилетие техника введения чужеродной ДНК в геном животных усовершенствовалась так, что стало возможным осуществлять направленное введение ДНК в любую желаемую часть генома или конкретного локуса. Основой новой технологии послужило создание эмбриональных стволовых клеток (ЭСК). В 1981 г. одновременно в двух лабораториях были получены первые культуры клеток, выделенных из внутренней клеточной массы бластоцист мыши (Evans, Kaufman, 1981; Martin, 1981). Все ЭСК имеют нормальный диплоидный кариотип, обладают активностями щелочной фосфатазы и теломеразы, экспрессируют ряд других маркеров, характерных для недифференцированных клеток. Это состояние поддерживается в определенных условиях культивирования, в частности, при наличии в культуре фидерного слоя эмбриональных фибробластов и/или фактора ингибирования лейкемии LIF. При удалении последних ЭСК начинают дифференцироваться в многоклеточные агрегаты, состоящие из дифференцированных и недифференцированных клеток, называемые эмбриоидными телами. Несколько позднее были получены культуры эмбриональных герминативных клеток (ЭГК), выделенные из первичных половых клеток мыши (Donovan, 1994). Затем были выделены линии клеток, подобные ЭСК, из эмбрионов кролика, хомячка, норки, свиньи, коровы, овцы, обезьян и, наконец, в последние годы такие линии выделены из бластоцист и первичных половых клеток человека. ЭСК и ЭГК сохраняют высокие плюрипотентные свойства при длительном культивировании in vitroи, будучи вновь введенными в эмбрион, способны формировать химер, участвуя в развитии тканей всех трех зародышевых листков, включая образование гамет. Однако способность ЭСК к формированию химер и наследованию этих клеток у их потомков твердо установлена пока только для ЭСК мышей. Уникальная способность ЭСК сохранять длительное время in vitroсвои плюрипотентные свойства открыла широкие возможности для различных манипуляций с их генами. Были разработаны пути и методы направленного введения чужеродной ДНК в ЭСК путем гомологичной рекомбинации с экзогенной ДНК. При трансформации ЭСК in vitroв результате такой рекомбинации происходит вставка эндогенной ДНК в «ген-мишень». Затем, после отбора ЭСК с модифицированным геномом, их инъецируют в полость бластоцисты другой линии мышей или агрегируют с зародышами более ранних стадий развития, после чего их пересаживают в матку приемной матери. Среди потомков отбирают химерных животных, в результате скрещивания которых получают гомозиготных мышей. Генотип гомозигот представлен исключительно модифицированными ЭСК. Общая схема осуществления направленного изменения генов у животных приведена на рис. 7. Данная технология позволяет получать направленные изменения в любом желаемом гене (технология «genetargeting» или «knockout»). Совокупность перечисленных выше методов можно определить как генетическую модификацию генома на уровне индивидуальных генов. Они позволили применять, по крайней мере, к мышам такие два основных генетических подхода как «от фенотипа к гену» и «от гена к фенотипу». Это имело революционизирующее воздействие как в фундаментальных научных, так и во всевозможных прикладных исследованиях. 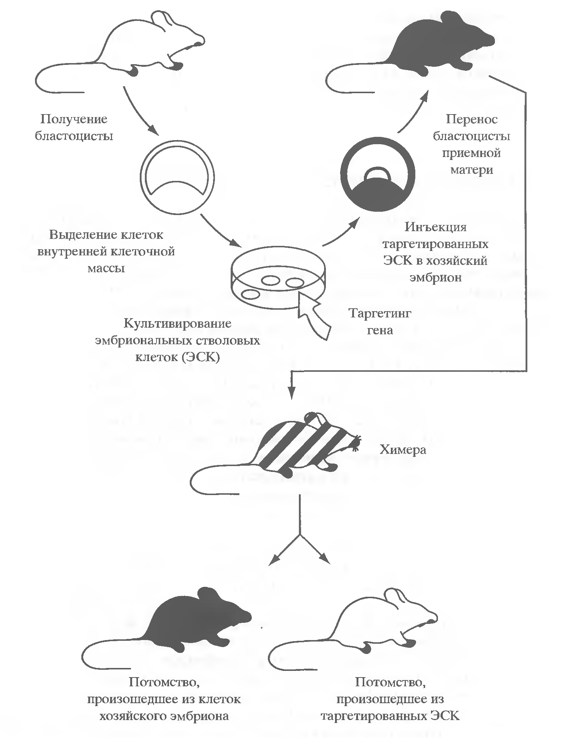 Рисунок 7 - Схема получения трансгенных мышей путем таргетинга генов в ЭСК[3] В первую очередь технология таргетинга внесла существенный вклад в генетику мыши и анализ различных аспектов функции генов in vivo. В результате использования таргетинга генов были созданы многочисленные трансгенные мыши с различными целенаправленными изменениями генов, начиная от точечных мутаций и кончая хромосомными перестройками. Важнейшим моментом в развитии методологии направленного изменения генов явилось создание различных технологий сайт-специфического встраивания генов, с помощью которых можно встраивать любой ген или участок ДНК в любой заданный сайт хромосомы. В результате внедрения в практику этих технологий в настоящее время получены принципиально новые данные о функции тысяч различных генов. Таким образом, генный нокаут, как и перенос новых генов, митохондрий и целых хромосом, позволяет не только определять функцию гена, но и моделировать многие патологии человека. В настоящий момент этот прием становится одним из ключевых в молекулярной генетике. Его чрезвычайная важность на данном этапе исследований определяется массовым переходом от исследований по структурной генетике к функциональной генетике. Трансгеноз и клонирование животных. Как известно, первая технология клонирования млекопитающих была разработана Вилмутом в 1997 г. Сама техника клонирования была основана на переносе ядер соматических клеток донора в цитоплазму энуклеированного ооцита реципиента. Альтернативным подходом к решению этой проблемы явилась трансформация чужеродными генами клеток фибробластов плодов с последующей пересадкой их ядер в энуклеированные ооциты овец и коров (1998), что привело к рождению трансгенных потомков. Вскоре появилось первое сообщение (МакКрет и др., 2000) о целенаправленном введении в клеточную культуру фибробластов плода овцы вектора, созданного на ос-нове альфа -1-проколлагенового гена овцы, содержащего в своем составе ген aльфа -1-антитрипсина человека под промотором бета-лактоглобулина. Были отобраны клоны фибробластов, прошедшие гомологичную рекомбинацию и экспрессирующие альфа- 1-антитрипсин человека. Ядра этих фибробластов пересадили в энуклеированные ооциты овец, а эмбрионы, развившиеся из них до стадии морулы или бластоцисты, были перенесены суррогатным матерям для их дальнейшего развития. Из 16 проанализированных плодов и новорожденных 15 содержали в своем геноме таргетированную аллель. 14 потомков развилось до рождения, и трое из них достигли годовалого возраста. У одной из самок был обнаружен в молоке aльфа -1-антитрипсин в количестве 650 мкг/мл. Аналогичным путем были получены трансгенные свиньи, в которых был нокаутирован один аллель локуса aльфа -1,3-галактозилтрансферазы, ответственной за острую реакцию отторжения органов при ксенотрансплантации. Трансгенные особи были получены с использованием техники клонирования, когда в качестве доноров ядер были использованы нокаутированные по данной аллели клетки фибробластов плода свиньи (Лей и др., 2002). ЗАКЛЮЧЕНИЕ: Таким образом, за последние два – три десятилетия научные достижения в эмбриологии, молекулярной биологии, генетике и структурной геномике, появление новых методов и подходов в трансгенной технологии модификации генома животных создали основу для решения большого числа общебиологических, биомедицинских и биотехнологических задач. Если генная инженерия послужила основой для развития структурной геномики, то трансгеноз стал основной технологией, способствующей прогрессу в функциональной геномике. Без всякого сомнения, в ближайшие годы широкое применение и дальнейшее развитие получат такие направления, как классический трансгеноз, направленный таргетинг генов в определенных типах клеток и/или на определенных стадиях развития организмов. Технология получения трансгенных животных с заданными хозяйственно ценными признаками будет в дальнейшем одним из перспективных направлений современной биотехнологии. Она позволит создавать разнообразные организмы, обладающие свойствами, не имеющими аналогов в природе. Трансгенные животные помогут решению ряда проблем, с которыми человечество сталкивается на всем протяжении своей истории. Это, прежде всего проблема создания лекарственных препаратов и их получения в достаточном количестве, а также потенциально - продовольственная проблема. Сочетание же клонирования с трансгенозом может стать очень эффективным путем как для дальнейшего развития функциональной геномики, так и для решения различных прикладных задач. В перспективе эти подходы, наряду с генной терапией, могут быть весьма полезными для клеточной и органной терапии человека. СПИСОК ИСТОЧНИКОВ: 1. Геном, клонирование, происхождение человека. – Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 2. Вымершие звери и птицы, которых проще всего клонировать. – Электронный ресурс. – 2013. 3. Андреева, Л.Е., В.З. Тарантул. Трансгенные животные: фундаментальные и прикладные аспекты / Л.Е. Андреева, В.З. Тарантул // Проблемы и перспективы молекулярной генетики. Том 1 / Отв. ред. Е.Д.Свердлов. – М.: Наука, 2003. – С. 184 – 217. 4. Клонирование человека. Вопросы этики. – Париж, Изд-во ЮНЕСКО, 2004. – 21 с. |
