|
|
хим8. Количество вещества. Моль. Число Авогадро. Молярная масса вещества
Раздел:
|
8.2А Количество вещества
|
ФИО педагога
|
Веретинская Т.В
|
Дата:
|
|
Класс: 8
|
Количество присутствующих:
|
Количество отсутствующих:
|
Тема урока
|
Количество вещества. Моль. Число Авогадро. Молярная масса вещества
|
Цели обучения в соответствии
с учебной программой
|
8.1.1.1 -знать моль, как единицу измерения количества вещества и знать число Авогадро
8.1.1.2 -уметь вычислять молярные массы соединений
|
Цели урока
|
Учащиеся будут:
- анализировать информацию из предоставленного источника
- интерпретировать информацию, представленную в виде схемы в текстовую
– понимать физический смысл постоянной Авогадро
- решать задачи на определение молярной массы вещества
|
Ход урока
Этап урока/ Время
|
Действия педагога
|
Действия ученика
|
Оценивание
|
Ресурсы
|
Начало урока
5 мин
|
Вызов. Для получения определенного количества вещества в лаборатории или на заводе необходимо брать определенное количество исходных веществ.
Подумайте, в чем лучше измерять вещество?
Но в химии важно, в каком количестве взаимодействуют атомы и молекулы друг с другом. Поэтому важно знать, сколько атомов или молекул находится в той или иной порции вещества. В лаборатории и на заводе чаще всего пользуются весами, значит нужна такая единица измерения, которая сочетает в себе и массу, и число частиц вещества.
Для этого в 1971 году ввели новую физическую величину – количество вещества. И именно об этой величине мы сегодня и будем говорить.
Что бы изучить физическую величину количество вещества и научиться ее применять, мы на какие вопросы в течение урока должны будем ответить?
|
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока.
|
2 балла
|
|
Середина урока
20 мин
|
Работа с терминами
RU
|
KZ
|
EN
|
Моль
|
Моль
|
mole
|
количество вещества
|
зат мөлшері
|
amount of substance
|
Молярная масса
|
Молярлық масса
|
molar mass
|
число Авогадро
|
Авогадро саны
|
Аvogadro number
|
молекула
|
молекула
|
molecule
|
ион
|
ион
|
ion
|
Работа в группе по стратегии «Посол». Каждой группе дается задание ознакомиться со своей частью темы, обсудить в группе, поделиться прочитанным, затем группы обмениваются своими участниками и слушают пересказ каждого ученика, пришедшего из другой группы
1-я группа. Количество вещества
2-я группа. Моль. Число Авогадро
3-я группа. Молярная масса вещества
Объяснение учителя:Количество вещества обозначается ν (ню), или n. Единица измерения: моль
Расчеты показали. Что если взять порцию вещества массой равной его относительной молекулярной массе, то в этой порции будет содержаться 6 ∙1023частиц вещества.
Демонстрация веществ количеством один моль (активированный уголь, поваренная соль, вода)
Постановка проблемного вопроса : Что я должна была сделать, что бы отмерить 6∙1023атомов углерода?
Порция вещества, в которой находится 6∙1023частиц вещества, называется 1 моль.
Записываем определение в тетрадь.
1моль – это такое количество вещества, в котором содержится 6∙1023частиц вещества.
Количество частиц вещества в одном моле называется постоянной Авогадро (NA).NA =6∙1023.
Число всех песчинок в пустыне Сахара = 3 моль!!!Предположим, что вы соединили вместе 1 моль (6, 02·1023) скрепок для бумаги и попытались опоясать этой лентой земной шар. У вас это получится более, чем 5·1016(50 триллионов раз).
Если в жаркий день выпить один моль воды, все равно будете испытывать жажду. 1 моль воды - это менее 1/10 чашки или только 18 г (18 мл, один глоток). Число Авогадро больше числа всех капель воды на Земле.
1 моль H2O содержит 6*1023 молекул
Сколько молекул содержит 2 моль H2O ?
Сколько молекул содержит 0,5 моль H2O
Как узнать число частиц (N), содержащихся в определённом количестве вещества?
Как узнать какое количество вещества составляет любое число частиц?
Сколько моль содержит 18*1023 молекул ?
Сколько моль содержит 30*1023 молекул ?
Три формулы можно объединить в треугольник:
1 моль вещества имеет массу, которая называется молярной. Обозначается М , измеряется в г/моль. Численно молярная масса равна относительной молекулярной массе или атомной, которую мы можем рассчитать по таблице Менделеева.
Запишите : Масса 1 моль вещества называется молярной. М=[г/моль], М=Mr
Чему равна масса 1 моль воды?
1 моль H2O имеет массу, равную 18 грамм, так как Mr(H2O)=18.
2 моль H2O имеет массу?
0,5 моль H2O имеет массу?
Как можно найти массу вещества, если известно количество вещества?
А как можно определить количество вещества по известной массе вещества?
Отсюда
M= 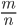
|
Учащиеся вначале знакомятся с глоссарием, затем работают индивидуально, а также в группах
|
5 баллов
|
карточки
|
Конец урока
10 мин
|
Задание 1. Определите численное значение молярной массы.
1.водорода М ( ) =
2.воды М ( ) =
3.оксида азота (IV) М ( ) =
4.нитрата железа (III) М ( ) =
5.кристаллогидрата медного купороса М(CuSO4•5H2O) =
Дескриптор:
−вычисляет молярные массы соединений;
−указывает единицы измерения.
Задание 2. решить задачи
1. Сколько молекул кислорода содержится в 2 моль его? Какую массу будет иметь это количество кислорода?
2. Какую массу имеют 5 моль водорода? Сколько молекул водорода содержится в этом его количестве?
3. Сколько весят 3*1020 молекул воды?
Дескриптор:
-определить количество вещества
-определить число молекул
|
Выполняют задания для ФО
|
3 балла
|
карточки
|
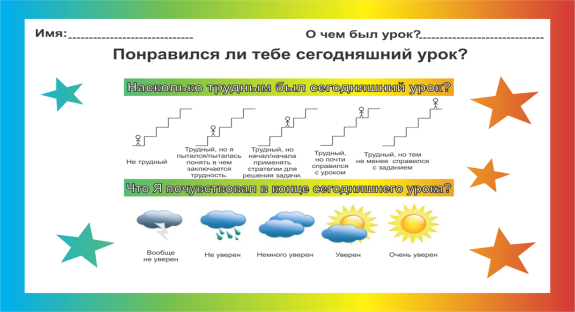
Рефлексия
5 мин
|
Рефлексия
|
Обратная связь, комментарии учителя и учащихся
|
|
Текст
| |
|
|
 Скачать 109.65 Kb.
Скачать 109.65 Kb.