Комплексты косылыстар. Комплексті қосылыстар. Комплексті осылыстар
 Скачать 180.36 Kb. Скачать 180.36 Kb.
|
 Комплексті қосылыстар Комплекс қосылыстар –құрамында комплексті иондары бар,тотығу дәрежесі белгілі орталық атомы иондармен немесе молекулалармен байланысқан күрделі химиялық заттар. Комплекс қосылыстардың молекуларында комплекс түзгіш не орталық атом көбінесе оң зарядты атомдардың бірі орталық орынды алады, оған координацияланған теріс иондар не бейтарап молекулалар лигандалар болады. Комплекс түзгіш және лигандалар ішкі сфераны құрайды да, квадрат жақшамен бөлінеді. Комплекс түзгіш пен лиганда арасында донарлы-акцепторлы механизм бойынша түзілген σ-коваленті байланыс болады, бұл байланыс саны координациялық сан деп аталады. Егер комплекс қосылыстың ішкі сферасы оң зарядты болса (катионды комплекс), сыртқы сферада теріс зарядты ион болады, не керісінше, ішкі сфера теріс зарядталса (анионды комплекс), сыртқы сферада оң зарядты ион болады. Егер ішкі сфера бейтарап болса, сыртқы сфера болмайды. Сыртқы сфера мен ішкі сфера арасында ионды байланыс болғандықтан күшті электролиттер сияқты жақсы диссоциацияланады. Ал ішкі сферада комплекс түзгіш пен лиганда арасында ковалентті байланыс болғандықтан, ерітіндідегі диссоциациясы аз болады: K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4 -; [Fe(CN)6]4 -↔ Fe2 + + 6CN Комплексті қосылыстардың биологиялық рөлі. Комплексті қосылыстардың маңызы: Халық шаруашылығында қолданады: оларды Pt металдарын,Au, Ag, Cu, Ni, Co алуға және тазалауға пайдаланылады.Сирек кездесетін металдарды бөлуге аналитикалық химияда сапалық, сандық анализдерге қолданады.Металдарды коррозиядан қорғауға қолданады. Металдарға жабысқақ қасиеті бар тұрақты және ерімейтін комплексті қосылыстар коррозия процесін баяулатады немесе мүлдем тоқтатады. Комплексті қосылыстар жануарлар мен өсімдіктердің тіршілік процестерінде үлкен рөл атқарады. Адамдар мен жануарлар қанының құрамындағы гемоглобин тыныс алу процесін қамтамасыз етеді. Гемоглобин – комплекс - белок глобинмен байланысқан күрделі протеид. Гемоглобинді қанның тыныс алу пигменті деп атайды. Ол оттегін қайтымды түрде қосып алып, оны өкпеден қан тамырлары арқылы барлық ұлпаларға жеткізеді, ол ұлпадан көмірқышқыл газын тасымалдайды. Темірдің тотығу дәрежесінің оңай өзгеруінің арқасында, гемоглобин оттегімен оңай қосылады да, оны ұлпаға ешқандай қиындықсыз береді. Комплексті қосылыстар жануарлар мен өсімдіктердің тіршілік процестерінде үлкен рөл атқарады. Адамдар мен жануарлар қанының құрамындағы гемоглобин тыныс алу процесін қамтамасыз етеді. Гемоглобин – комплекс - белок глобинмен байланысқан күрделі протеид. Гемоглобинді қанның тыныс алу пигменті деп атайды. Ол оттегін қайтымды түрде қосып алып, оны өкпеден қан тамырлары арқылы барлық ұлпаларға жеткізеді, ол ұлпадан көмірқышқыл газын тасымалдайды. Темірдің тотығу дәрежесінің оңай өзгеруінің арқасында, гемоглобин оттегімен оңай қосылады да, оны ұлпаға ешқандай қиындықсыз береді. Биокомплекстер Тіршілік үшін қажетті көптеген элементтер (Fe,Co,Mn,Cu,Mo,Zn) организмде биокомплекстер түрінде кездеседі.Көптеген биокомплекстер,мысалы,виамин B12,гемоглобин, хлорофилл,тағы басқалары физиологиялық және биохимиялық процестерде маңызды рөл атқарады. Тіршілік үшін қажетті көптеген элементтер (Fe,Co,Mn,Cu,Mo,Zn) организмде биокомплекстер түрінде кездеседі.Көптеген биокомплекстер,мысалы,виамин B12,гемоглобин, хлорофилл,тағы басқалары физиологиялық және биохимиялық процестерде маңызды рөл атқарады. Металлоферменттер Металлоферменттер - бұл белгілі бір металдар катиондарының жұмыс істеуі үшін ферменттер класының жалпы жиынтық атауы. Мұндай ферменттің құрамында бірнеше түрлі металл иондары болуы мүмкін. Бұл жағдайда металл катионы металлоферменттің белсенді орталығының кеңістіктегі дұрыс конфигурациясын қамтамасыз етеді.Металлоферменттерге мысал ретінде тиренді трииодтиронинге немесе темірге тәуелді тіндік респираторлық ферменттерге айналдыратын селенге тәуелді монодеодиназа жатады. Металлоферменттер ферменттер класына жатудан басқа, металопротеидтердің кең класына жатады - белоктар (міндетті түрде ферменттер емес), оларға катиондар кіреді. Металлоферменттер - бұл белгілі бір металдар катиондарының жұмыс істеуі үшін ферменттер класының жалпы жиынтық атауы. Мұндай ферменттің құрамында бірнеше түрлі металл иондары болуы мүмкін. Бұл жағдайда металл катионы металлоферменттің белсенді орталығының кеңістіктегі дұрыс конфигурациясын қамтамасыз етеді.Металлоферменттерге мысал ретінде тиренді трииодтиронинге немесе темірге тәуелді тіндік респираторлық ферменттерге айналдыратын селенге тәуелді монодеодиназа жатады. Металлоферменттер ферменттер класына жатудан басқа, металопротеидтердің кең класына жатады - белоктар (міндетті түрде ферменттер емес), оларға катиондар кіреді. Гемоглобин Гемоглобин - омыртқалы қызыл қан клеткаларында темір бар пигмент, ол оттегін өкпеден дененің басқа бөліктеріне тасымалдайды. Демек, ол тыныс алу пигменті ретінде қарастырылады. Сонымен қатар, бұл хлорофилл молекуласының құрылымына ұқсас қызыл түсті пигмент. Гемоглобин - омыртқалы қызыл қан клеткаларында темір бар пигмент, ол оттегін өкпеден дененің басқа бөліктеріне тасымалдайды. Демек, ол тыныс алу пигменті ретінде қарастырылады. Сонымен қатар, бұл хлорофилл молекуласының құрылымына ұқсас қызыл түсті пигмент. Хлорофиллге ұқсас гемоглобин де C, H, N және O түзеді, бірақ оның құрамында орталық ион ретінде Fe бар. Ол оттегін тасымалдап қана қоймай, сонымен қатар көмірқышқыл газы, азот оксиді және т.б. сияқты бірнеше басқа да газдарды тасымалдайды. Адамның , омыртқалы және кейбір омыртқасыз жануарлырдың қанының қызыл пигменті.Тыныс мүшелерінен оттекті ұлпаларға,ал көмірқышқыл газын ұлпадан тыныс мүшелеріне тасымалдайды. Гемоглобин жетіспесе анемия ауруы пайда болады. Гемоглобиннің қалыпты жағдайдағы нормасы әйелдерде 120-150г/л,ер адамдарда 130-160 г/л.Егер гемоглобин мөлшері шектен тыс көп болса,қан қоюланып жүрек қан тамыр ауруына шалдығады. Құрамында гемоглобин бар азық-түліктер:бауыр,ет т.б. Гемоглобин қанның қызыл жасушалары эритроциттердің құрамында болады.Эритроцит оттегіні өкпеден бұлшықет тарамдарынан көмірқышқыл газын алып,өкпеге апарады.Бұл "гем" деп аталатын ерекше ақуыз көмегімен жүзеге асырылады.Гемге оттегі молекуласы қосылады,ол -гемоглобин бөлігі.Жалпы гемоглобин 96%-ы нәруыз -глобиннен,4%-ы темір атомы бар гемнен тұрады. Адамның , омыртқалы және кейбір омыртқасыз жануарлырдың қанының қызыл пигменті.Тыныс мүшелерінен оттекті ұлпаларға,ал көмірқышқыл газын ұлпадан тыныс мүшелеріне тасымалдайды. Гемоглобин жетіспесе анемия ауруы пайда болады. Гемоглобиннің қалыпты жағдайдағы нормасы әйелдерде 120-150г/л,ер адамдарда 130-160 г/л.Егер гемоглобин мөлшері шектен тыс көп болса,қан қоюланып жүрек қан тамыр ауруына шалдығады. Құрамында гемоглобин бар азық-түліктер:бауыр,ет т.б. Гемоглобин қанның қызыл жасушалары эритроциттердің құрамында болады.Эритроцит оттегіні өкпеден бұлшықет тарамдарынан көмірқышқыл газын алып,өкпеге апарады.Бұл "гем" деп аталатын ерекше ақуыз көмегімен жүзеге асырылады.Гемге оттегі молекуласы қосылады,ол -гемоглобин бөлігі.Жалпы гемоглобин 96%-ы нәруыз -глобиннен,4%-ы темір атомы бар гемнен тұрады. Хлорофилл Хлорофилл - фотосинтетикалық ағзалардың өсімдіктер мен балдырларды қамтитын негізгі пигменті. Бұл күн сәулесінен жарық энергиясын алуға қабілетті жасыл түсті пигмент. Шынында, хлорофилл өсімдік пигменттерінің тобына жатады. Ол бірнеше хлорофилл пигменттерінен тұрады, бірақ а және b хлорофилл - жалпы пигменттер. Хлорофилл - фотосинтетикалық ағзалардың өсімдіктер мен балдырларды қамтитын негізгі пигменті. Бұл күн сәулесінен жарық энергиясын алуға қабілетті жасыл түсті пигмент. Шынында, хлорофилл өсімдік пигменттерінің тобына жатады. Ол бірнеше хлорофилл пигменттерінен тұрады, бірақ а және b хлорофилл - жалпы пигменттер. Сонымен қатар, хлорофилл молекуласы көміртектен, сутектен, азоттан және оттектен тұрады. Демек, бұл элементтер магнийдің орталық металды ионына айналды. Хлорофиллдер сары және көк түсті толқындардың ұзындығын электромагниттік сәулеленуден алады және жасыл шағылысады. Демек, бұл олардың жасыл түсте көрінуінің себебі. Хлорофилл мен гемоглобиннің қандай ұқсастықтары бар? Хлорофилл және гемоглобин - екі табиғи пигмент. Олардың құрылымы ұқсас. Сондай-ақ, екеуінде төрт пирроль сақинасы бар. Сонымен қатар, олар бірдей элементтерден тұрады; C, H, O және N. Сонымен қатар, екеуі де тіршілік процестері үшін өте маңызды. Сонымен қатар, хлорофилл мен гемоглобин процестері оттегі мен көміртегі диоксидін басқарады. Хлорофилл және гемоглобин - екі табиғи пигмент. Олардың құрылымы ұқсас. Сондай-ақ, екеуінде төрт пирроль сақинасы бар. Сонымен қатар, олар бірдей элементтерден тұрады; C, H, O және N. Сонымен қатар, екеуі де тіршілік процестері үшін өте маңызды. Сонымен қатар, хлорофилл мен гемоглобин процестері оттегі мен көміртегі диоксидін басқарады. Хлорофилл мен гемоглобиннің арасындағы айырмашылық неде? Хлорофилл - бұл өсімдіктер, балдырлар және цианобактериялар сияқты фотосинтетикалық ағзаларда кездесетін жасыл түсті пигмент. Екінші жағынан, гемоглобин - бұл омыртқалы қызыл қан клеткаларында кездесетін тыныс алу пигменті. Демек, бұл хлорофилл мен гемоглобиннің арасындағы маңызды айырмашылық. Хлорофилл мен гемоглобиннің арасындағы тағы бір айырмашылық - бұл басқа элементтер жиналған орталық ион. Хлорофиллде магний ионы, ал гемоглобинде Fe ионы болады. Хлорофилл - бұл өсімдіктер, балдырлар және цианобактериялар сияқты фотосинтетикалық ағзаларда кездесетін жасыл түсті пигмент. Екінші жағынан, гемоглобин - бұл омыртқалы қызыл қан клеткаларында кездесетін тыныс алу пигменті. Демек, бұл хлорофилл мен гемоглобиннің арасындағы маңызды айырмашылық. Хлорофилл мен гемоглобиннің арасындағы тағы бір айырмашылық - бұл басқа элементтер жиналған орталық ион. Хлорофиллде магний ионы, ал гемоглобинде Fe ионы болады. Химиялық байланыс — атомдардың химиялық қосылыс түзіп әрекеттесуі. 19 ғасырдың басында К.Бертолле Химиялық байланыс түзілуінің гравитациялық, 1810 жылы Й.Я Берцелиус электрхимиялық, 1861 жылы орыс ғалымы А.Н Бутлеров заттардың химиялық құрылыс теориясын, 1915 жылы неміс физигі Кассель, 1916 жылы ағылшын ғалымы Г.Льюис электрондық теорияларын ұсынды. Кванттық механика көзқарасы тұрғысынан Химялық байланыс валенттілік сұлба және молекулалық орбиталдар әдісімен түсіндіріледі. Химиялық байланыс түзілуіне қарай төртке бөлінеді: иондық ковалентті металдық сутектік Иондық Химиялық байланыс электр терістілігі бойынша айырмашылығы үлкен металл мен бейметалл атомдары арасында түзіледі. Химиялық әрекеттескенде валенттік электрондарын беріп, оң зарядты иондарға (катиондарға): К־–е–К+ бейметалл атомдары электрондар қосып алып, теріс зарядты иондарға (аниондарға) айналады: Cl+е–Cl־. Әр аттас зарядты иондар бірін-бірі тартып молекула құрайды: K+ + Cl ־= KCl. Иондық Химиялық байланыс қарама-қарсы зарядталған иондардың электрстатикалық тартылысы нәтижесінде жүзеге асады. Иондар түзілу арқылы жүзеге асатын байланыстарды иондық байланыс, қосылыстың өзін иондық қосылыс деп атайды. Иондық қосылыстардың қайнау, балқу температурасы жоғары, қызуға тұрақты, олар полюстік еріткіштерде тез ериді, ерітінділері электр тогын жақсы өткізеді. Ковалентті Химиялық байланыста — әрекеттесуші атомдарға ортақ электрондар жұбы пайда болып, олардың санына қарай бір немесе бірнеше еселенген байланыстар түзіледі. Мысалы, сутек молекуласы атомдары арасында бір (Н:Н), оттек молекуласында қос (:О::О:), азот молекуласында үш (:N:::N:) еселенген ковалентті Химиялық байланыс бар. Ковалентті Химиялық байланыстар электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді. Полюсті молекулада Химиялық байланыс түзетін ортақ электрондар электр терістілігі күшті атомға ығыса орналасады. Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюстік молекулалардың қайнау және балқу температурасы төмен, полюсті еріткіштерде үйектеліп иондарға ыдырайды. Полюссіз ковалентті Химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасқан. Полюссіз Химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді. Ортақтаспаған электрон қосағынан және электронсыз бос орбитасы бар атомдардан (донар-акцепторлы) түзілетін сутектік және металдық Химиялық байланыстар координациялық байланыс деп аталады. Сутекті Химиялық байланыс — екі не бір молекуладағы атомдар арасында сутек атомының оң заряды арқылы түзіледі. Металдық Химиялық байланыс — металл атомдарының сыртқы қабатындағы бос электрондар қатысуымен түзілетін байланыс. Химиялық байланыс валенттік электрондар арқылы жүзеге асады. Химиялық байланысының негізгі сипаттамалары: байланыс энергиясы, байланыс ұзындығы, валенттік бұрыш. Байланыс энергиясы — өзара байланысқан атомдарды не иондарды бір-бірінен ажырату үшін жұмсалатын энергия. Байланыс ұзындығы — Химиялық байланыстағы атомдар ядроларының арасындағы қашықтық, валенттік бұрыш — байланысқан атомдар ядролары арқылы жүргізілетін жорамал сызықтар арасындағы бұрыш. Бұл көрсеткіштер зат молекуласының құрылысын, пішінін және беріктігін сипатта Ковалентті байланысКовалентті байланыс екі бейметалл атом арасында ортақтасқан электрондары болатын байланыс түрі. Химиялық байланыстың түзілуін электртерістілік ұғымын қолданып түсіндіруге болады. Электртерістіліктері бірдей элемент атомдарының арасында (Н2, О2, N2, С12) байланыста болатын сутек молекуласының түзілу мысалында қарастырайык. Сутек атомының электрондық формуласы 1s1. Сутектің электротерістілігі 2,1. S-электрондарының электрон бұлттары сфера (шар) тәрізді, олардың өзара әсерлесуін былай көрсетуге болады: 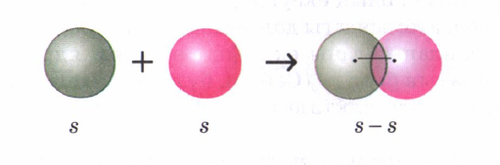 Cонда s электрондарының бұлттары өзара қабысып, екі электрон екі ядроға да ортақ, олардан бірдей қашықтықта орналасады. Бірдей атомдардың арасындағы байланыс полюссіз ковалентті байланыс деп аталады. Электрон бұлттары қабысуы нәтижесінде энергия бөлініп, молекула түзіледі. Бұл энергия шамасы молекуладағы байланыс беріктілігін сипаттайды, олай болса молекула жеке атомдарға қарағанда тұрақты жүйе болғаны. Полюссіз ковалентті байланыста байланыстырушы электрон жұбының бұлты ядролардан бірдей қашықтықта орналасады. Иондық байланысИондық байланыс катиондар мен аниондардың арасында электро-статикалық тартылу күшінің нәтижесінде пайда болады. Химиялық әрекеттескен атомдар 8 электронды тұрақты октет қабатқа ие болып, катион мен анионға айналу үшін олар күшті металдар мен бейметалдарға жатуы тиіс. Иондық байланысқан қатты заттар иондық кристалдық торға ие болады. Сондықтан олар қатты, берік, қиын балқитын заттарға жатады. Иондық байланыс көбіне нағыз типтік металдардың оксидтері мен гидроксидтеріне және барлық тұздарға тән. Әдетте, бір молекуланың ішінде байланыстың әр түрлі типтері кездеседі. Мысалы, күшті негіздерде (КОН, Са(ОН)2, т.б. ) металл катионы мен гидроксотоп арасында иондық, ал оттек пен сутек арасында коваленттік полюсті байланыс түзіледі. Оттекті қышқылдардың тұздарында да (K2SО4, СаСО3, т.б.) металл катионы қышқыл қалдығының анионымен иондық байланыспен байланысса, оттек пен бейметалл (С, S) арасында коваленттік полюсті байланыс түзіледі. Жалпы алғанда, химиялық байланысты типтерге жіктеу шартты сипатқа ие. Өйткені олардың түпкі негізі бір. Мысалы, иондық байланысты коваленттік байланыстың шекті түрі деп қарау керек. Металдық байланыста коваленттік полюсті байланыстың да, иондық байланыстың да элементтері бар. Көптеген заттарда "таза" бір ғана химиялық байланыс типі бола бермейді. Мысалы, ас тұзы — натрий хлориді иондық байланысты қосылыстарға жатады. Іс жүзінде оның 84% байланысы иондыққа, қалған 16%-і коваленттіге тиесілі. Сондықтан химиялық байланыстың полюстік дәрежесін біліп тұрып, нақты қай типке жататынын сөз еткен дұрыс. Егер галогенсутектер қатарындағы байланыстың полюстік дәрежесінің өзгеруіне келсек, фторсутектен астатсутекке қарай: HF→HCl→HBr→HI→HAt төмендейді. Себебі галоген мен сутектің электртерістіктерінің айырмашылығы азая түседі де, ақыры астатсутекке жеткенде байланыс полюссіз коваленттіге жуықтайды. Химиялық байланыстың барлық типтері мен түрлерінің негізі бір болатыны — олардың бәрінің де табиғаты электрондық бұлттардың тығыздығының өзгеруіне тәуелді. Химиялық байланыстың түзілуі кез келген жағдайда электрондық-ядролық әрекеттесудің арқасында, осы кездегі энергия ұтысының (бөлінуінің) нәтижесінде іске асады. Оны барлық химиялық байланыс типтерінің белгілерін өзара салыстырғанда байқаймыз.[4] Сутектік байланысСутектік байланыс оң зарядтыполюстікке ие болған сутек атомы мен теріс полюсті, электртерістігі күшті, бөлінбеген электрон жұбы бар (көбіне F, О, N, кейде CI, S) атомдар арасында түзіледі. Сондықтан сутектік байланыстың механизмін жартылай электростатикалық, жартылай донорлы-акцепторлы деп қарастыруға болады. Сутектік байланысқа белоктардағы карбонил тобы мен амин тобындағы сутектің арасында түзілген байланыс мысал бола алады. Бұл полинуклеотидтер молекуласында іске асатын молекула ішіндік сутектік байланысқа жатады. Ал химияда көбіне молекула- аралық сутектік байланыстар кездеседі. Оны этил спиртінің өзінен немесе оны суға араластырғанда жылу бөле жүретін процестен байқауға болады. Кіші молекулалы су, спирт, альдегид тәрізді заттардың қалыпты жағдайда сұйық күйде болуы сутектік байланыстың әсерінен. Сонымен қатар аммиак, фторсутек сияқты газ күйіндегі заттардың оңай сұйылуы олардың молекуласының арасында түзілетін сутектік байланыстар арқылы іске асырылады. Сутектік байланыспен байланысқан заттар молекулалық кристалдық торға ие болады Металдық байланысТолық мақаласы: Металдық байланыс Металдың кристалдық торының түйіндерінде атомдар немесе олардың иондары орналасатыны белгілі. Металдық тордағы бостау күйдегі делокальданған электрондар көптеген ядролардың арасында өзара тарту күштерін тудырып, металдық байланыс түзеді. Металдардың сыртқы деңгейіндегі валенттік электрондар саны аз болатындықтан, олардың иондарға айналуы қиын емес: Me - ne- → Ме+n Мұндай қабілетті металдар бос күйде де, химиялық әрекеттесу кезінде де көрсетеді. Бос күйдегі металдың белгілі физикалық қасиеттері: электр- және жылуөткізгіштігі, қаттылығы, иілімділігі, созылғыштығы, өзіне тән жылтыры, т.б. булардың барлығы металдық байланысқа тәуелді. Металдардың валенттік электрондары өз ядросымен нашар байланысқан. Сондықтан, бір-бірінен оңай ажырайды және металда теріс иондар қатары қалыптасады. Бұл иондар кристалдық торда орналасқан және электрондардың көбісі бүкіл кристалл бойынша жылжи алады. Металдың электрондары бүкіл металдағы атомдарды байланыстырады. [5] Металдағы электрондар(валенттік электрондар) газ бен кристалдық торлардағызарядталған иондардың арқаумен бір-бірімен әрекеттесуіне себепші болған - химиялық байланыс. Металдық байланыстың идеалды моделі металдың валенттік электрондармен жарым-жартылай топтастырылған энергетикалық аймағының (өткізу қабілеті бар зонасы) пайда болуына сәйкес келеді. Металдарды құрастыратын атомдардың жақындасуымен валенттік электрондардың атомдық орбиталдары, түйіндес қоспаның делокализдалған p-орбиталдар сияқты, кристалдық торлар бойынша делокализдалған p-орбиталдарға айналады. Металдық байланыстыңсандық сипаттамасы квант механикасымен ғана бола алады. Сапалық сипаттаманы коваленттік байланыстың ұғымымен түсінуге болады. Металдың екі атомы жақындасқанда, мысалы Li, коваленттік байланыс пайда болады, сонымен валенттік электрондың әр энергетивтік деңгейі екіге бөлінеді. Li атомдардың N саны кристалдық торларды жасаған кезде, көрші атомдардың электрон бұлттарының қайта жабуы валенттік электрондың әр энергетикалық деңгейі N деңгейлерге бөлінеді. Деңгейлердің саны көп болғандықтан, олар бір-біріне жақын орналасқан. Сол үшін оларды энергетикалық деңгейлердің бөлінбейтін, әрі ақырғы ені бар, бір зонасы деп есептеуге болады. Валенттік электронлардың саны бірдей болған екі атомдық молекуламен салыстырғанда, әр атом көп байланыстардың пайда болуына үлес қосып жатады. Сондықтан, жүйенің энергиясының минимумы (немесе байланыстың максимумы) молекуладағы екі центрлік байланысына қарағанда, үлкен қашықтыққа жете алады. Қазақ тілі терминдерінің салалық ғылыми түсіндірме сөздігі: Химия. Н.Нұрахметов, А.Ниязбаева, Р.Рысқалиева, Н.Далабаева. — Алматы: "Мектеп" баспасы, 2007. — 336 бет. ↑ "Қазақ Энциклопедиясы", 9 том ↑ Химия: Жалпы білім беретін мектептің 8 сыныбына арналған оқулық. Усманова М.Б., Сақариянова Қ.Н. / Алматы: Атамұра, 2009. - 216 бет. ↑ Химия: Жалпы білім беретін мектептің жаратылыстану-математика бағытындағы 11-сыныбына арналған оқулық / Ә. Темірболатова, Н. Нұрахметов, Р. Жұмаділова, С. Әлімжанова. – Алматы: «Мектеп» баспасы, 2007. – 352 бет, суретті |
