Конспект лекций по курсу технология лекаственных форм и галеновых препаратов для студентов специальности Технология фармацевтических препаратов
 Скачать 0.61 Mb. Скачать 0.61 Mb.
|
|
Лекция № 20т. Растворители и экстрагенты. Изготовление лекарственных препаратов связано с применением различных жидкостей, необходимых для растворения или извлечения фармакологически активных веществ. В зависимости от назначения эти жидкие вещества могут быть растворителями или экстрагентами. Под растворителями подразделяют индивидуальные химические соединения или смеси, способные растворять различные вещества, т.е. образовывавшие однородные системы – растворы, состоящие из 2-х и более числа компонентов. К растворителям относятся вещества, обладающие свойствами: 1) обладающие активной растворимостью; 2) неагрессивны к растворяемому веществу и аппаратуре;
Под экстрагентами подразделяют растворители, использованные при экстракции растительного или биологического материала либо при экстракции из жидкостей тех или иных ценных веществ. К растворителям, используемых в качестве экстрагентов, предъявляются дополнительные требования:
Все растворители и экстрагенты подразделяются на неорганические и органические. Из класса неорганических соединений наибольшее значение имеет вода. Схему получения и очистки воды для фармацевтических производств рассмотрено ниже. Сейчас ознакомимся с самыми распространенными растворителями и экстрагентами. Этиловый спирт – в фармацевтической промышленности применяется спирт, получаемый путем сбраживания крахмалсодержащего сырья – в основном картофеля. Сброженное сусло – бражка – содержит 8 – 10% спирта. Путем перегонки из нее получается спиртовой сырец, содержащий до 88% спирта. В спирте – сырце всегда содержатся примеси – 0,3 – 0,4%, которые ухудшают вкусовые качества спирта, придают ему неприятный запах и которые очень вредны для здоровья человека. К ним относятся летучие органические кислоты (уксусная, молочная, масляная); сивушные масла (высшие спирты – пропил, изобутил); эфиры (уксусно-этиловый, масляно-этиловый) и альдегиды (уксусный и др.). В связи с этим спирт - сырец подвергается многократной перегонки называемой ректификацией, в результате которой содержание примесей уменьшается в 300 раз. При этом дополнительно происходит укрепление спирта до 95 – 96%. В ректификационной колонне сначала удаляются головные, т.е. легко кипящие примеси (кислоты, эфиры и альдегиды). В процессе ректификации часть конд-ти из дефлегматора (флегма) отводится обратно в аппарат, чтобы, находясь в контакте с парами спирта, способствуют его укреплению. Высококипящие сивушные масла остаются в «хвостовых» примесях. Схема ректификационной установки. 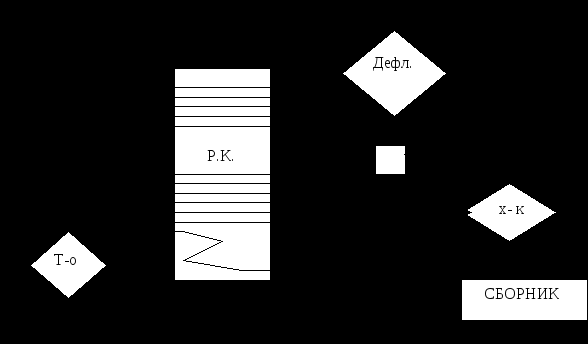 Свойства спирта как растворителя и экстрагента:
2. Значительно труднее, чем вода, проникает через стенки клеток (отнимая воду и белков, спирт превращает их в осадки, закупоривавших поры клеток и таким образом ухудшается диффузия) чем ниже концентрация спирта, тем легче он проникает внутрь клеток. 3. Чем крепче спирт, тем менее возможен гидрометич. процесс. Спирт инактивирует ферменты.
Крепость спирта выражается весовых или объемных процентах. Под крепостью понимаются % содержания б/в (абсолютного) спирта в дал. растворе. Объем спиртоводного раствора изменяется в зависимости от температуры, крепость его в объемных процентах относят к t=20ºC. Перевод объемных % в весовые: Д100 Р = q ——– Дq Перевод весовых % в объемные: Др q = p ―― Д100 Где р – весовые проценты; q – объемные проценты; Дq – плотность водно-спиртового раствора, крепость которого q об. %; Дp - плотность водно-спиртового раствора, крепость которого р вес. %; Д100 – плотность б/в спирта (0,78927). При смешивании спирта с водой выделяется тепло и температура смеси повышается. Наибольшая теплота – при получении 30 вес. % спирта. Кроме того, при смешивании воды и спирта наблюдается явлении контракции, заключающееся в уменьшении объема смеси против арифметической суммы исходных веществ: 50 л спирта + 50 л воды = 96,4 л смеси (чтобы получилось 100 л 54% об. спирта нужно взять 54 л спирта и 49,679 л воды). Поэтому разработаны таблицы для разведения спирта (приложение к ГФ Х). Другие растворители и экстрагенты:
ВОДА. Вода дистиллированная (Aqua destillata) До сих пор вы имели дело с водой дистиллированной при проведении лабораторных занятий. Качество ее регламентируется ГФ ХI . Она должна быть бесцветной, прозрачной, без запаха и вкуса, значение рН в пределах 5,0 – 6,8, сухой остаток не должен превышать 0,001% (т.е. 1 мг в 100 мл), в ней должно отсутствовать нитраты, нитриты, хлориды, сульфаты, кальций, тяжелые металлы, углерода диоксид, допускаются следы аммиака (0,00002%). Общий принцип получения воды дистиллированной заключается в следующем. Питьевую воду или воду, прошедшую в/п, помещают в дистиллятор, состоящий из 3-х основных узлов: испарителя, конденсатора и сборника. Испаритель с водой нагревают до кипения. Пары воды поступают в конденсатор, где они сжижаются и в виде дистиллята поступают в сборник. Все нелетучие примеси, находящиеся в исходной воде, остаются в дистилляторе. По способности нагрева дистилляторы делятся на электрические и паровые. Известны дистилляторы электрические непрерывного действия марки ДЭ-1 и ДЭ-25. Один из них Q = 4 л/ч работает в одной из лабораторий. Вода деминерализованная (Aqua deminevalisata). В последнее время уделяют внимание использованию воды деминерализованной вместо дистиллированной. Это связано с тем, что электрические дистилляторы часто выходят из строя. Высокое содержание солей в исходной воде приводит к образованию накипи на стенках испарителя, что ухудшает условие дистилляции и снижает качество воды. Для обессоливания воды применяется различные установки. Принцип их действия основан на том, что вода освобождается от солей при пропускании ее через ионно-обменные смолы. Основной частью таких установок являются колонки, заполненные катионитами и анионитами. Активность катионитов определяется наличием карбоксильной или сульфоновой группами, обладающие способностью обменивать ионы Н+ на ионы щелочных и щелочноземельных металлов. Аниониты – чаще всего продукты полим-и аминов с формальдегидом, обменивают свои гидроксильные группы ОН на анионы. Установки также имеют емкости для растворов кислоты, щелочи и воды дистиллированной для регенерации смол. Очищенная и апирогенная вода. Однако сегодня в фармацевтической промышленности используется только вода очищенная (ФС42-2619-89) и вода для инъекций. (ФС42-2620-89). На примере устройства и работы установки «Джерело – 500» ознакомимся с типовой схемой очистки воды. Принцип работы установки основан на методе обратного осмоса, т.е. фильтрации жидкости с малой концентрацией растворенных веществ через полупроницаемые мембраны рулонного о-о элементов (ЭРО) под воздействием избыточного давления жидкости. При этом из пермеата снимается 98% растворенных солей. Остаток соли снимается при помощи и-о фильтров. Установка состоит из о-о блока и блока доводки воды (возможно включение в схему блока в/п). Описание схемы: Исходная вода за счет давления в сети подается на вход фильтра Ф1 (задерживаемая способность 20 мкм) и далее в фильтр Ф2 (задерживаемая способность 5 мкм). Из фильтра Ф2 поступает на насос высокого давления для подачи в последовательно соединенные о-о аппараты (ЭРО). Очищенная вода (пермиат) отбирается из о-о аппаратов и поступает в блок доводки воды, где последовательно проходит через к –о фильтр Ф3, а-о фильтр Ф4 и фильтры финишная очистки Ф5 и Ф6 с задерживаемой способностью 5 мкм и 0,22 мкм соответственно. К-КУ-2-8(Н+); А-АВ-17-8(ОН-). В процессе очистки из воды удаляются: - Fe; (фильтр грубой очистки)
Сборники для химической очистки ЭРО, регенерация Ф3 иФ4 . Кириши – УОВ и УВВ. УВВ-500.
Zn – 80%; Мn – от 50 до 96%; Fe от 60 до 95%; цезий и стронций – 99%% фенол – 65%; хлорорганика – 85%; аммиак – 35%; нитриты – 58%; нитраты – 80%; бактерии – 95%; диоксин – 99%.
Соли 90 – 95%; полное удаление по п.1.
Выходит сверхчистая вода.     |

 оли; обратный осмос, и-о
оли; обратный осмос, и-о