конспект. Конспект по топливу. Конспект по топливу doc
 Скачать 1.79 Mb. Скачать 1.79 Mb.
|
2. Скорость процессов горения.1 меньше скорости диффузии окислителя к поверхности реагирования. Это означает, что окислитель имеется в достаточном количестве и его подвод к окисляемой среде (топливу) не имеет существенного значения.Как показывает практика, осуществление процессов горения зависит от химического состава топлива (природы топлива), концентрации реагирующих веществ и физических факторов, определяющих процесс горения (температура и давление). Для большинства процессов горения, осуществляемых в топке, протекающих в близком к атмосферному авлению, наибольшим физическим фактором является температура. Давление на скорость процесса горения оказывает влияние в установках, работающих под давлением. При относительно низкой температуре скорость химической реакции при Градиент (разность) концентраций окислителя на поверхности реагирования и в окружающей среде мал. При указанных условиях скорость горения в целом определяется кинетикой химических реакций на поверхности (кинетическая область реагирования). - скорость частиц (1234) d – диаметр частиц (d1 d2 d3d4). Согласно закономерности рисунка с увеличением температуры скорость горения растет по экспоненциальному закону. Коэффициент скорости реакции определяем согласно закона Аррениуса: K=Koe-E/RT, где Ко – предэкспонециальный коэффициент; Е – энергия активизации, кДж/кмоль; Т – абсолютная температура, К; R – универсальная газовая постоянная, кДж/кмоль. Подобное условие, в котором увеличение скорости реакции горения связано с увеличением температуры, длится до тех пор, пока скорость химической реакции не станет соизмеримой со скоростью подвода окислителя к поверхности реагирования для каждого диаметра. При дальнейшем повышении температуры скорость химической реакции становится на столько значительной, что процесс горения лимитируется поступлением окислителя к поверхности реагирования. Весь подведенный окислитель незамедлительно вступает в химическую реакцию с горючим. Поэтому концентрация окислителя на поверхности приближается к 0. В этом случае скорость горения определяется условиями подвода окислителя, т.е. гидродинамическими факторами (относительная скорость потока и размеры частиц). Относительная скорость частицы – скорость потока минус скорость движения частицы. Соотношение кинематической и диффузионной областей реагирования представлено на выше приведенном рисунке. Скорость диффузионного горения растет с увеличением относительной скорости газового потока и уменьшением размера частиц. Кинематическая и диффузионная области в чистом виде являются предельными областями реагирования. Между ними находится промежуточная область, для которой скорость химической реакции и скорость диффузии окислителя к поверхности реагирования соизмеримы.(Диффузия – “проникновение” ) При определенных условиях возможно смещение горения из одной области реагирования в другую область. Так уменьшение размеров частичек топлива или увеличение относительной скорости газового потока при неизменной температуре перемещает горние из диффузионной области реагирования в промежуточную и даже в кинетическую. Понижение температуры также сдвигает горние в область кинетического реагирования. Большинство процессов, осуществляемых в топочных устройствах или промышленных печах, происходит в промежуточной области реагирования. Скорость реакции зависит также от физических свойств топлива. При различных состояниях топлива и окислительной среды, когда имеется поверхность реагирования, процесс называется гетерогенным. Этот процесс при сгорании топлива в среде, которая находится в различных агрегатных состояниях. Когда агрегатное состояние топлива и окислителя одинаковое, то процесс называется гомогенным. Для установившегося гетерогенного процесса количество окислителя, прореагировавшего на поверхности горючего, равняется диффузионному его потоку. Таким образом, скорость горения выражается через скорость химической реакции и скорость диффузии потока реагирующего газа и выражается следующей зависимостью: Ωг= сп· К = αдиф(С – Сп) где r – скорость горения газа, кг/(м2с); Сn – концентрация окислителя на поверхности реагирования, кг/м3; ^С – концентрация окислителя в потоке, кг/м3; К – константа химической реакции; диф – константа скорости диффузии (коэффициент массообмена), м/с. Константа К как было ранее отмечено зависит от температуры и определяется по закону Аррениуса. Константа диф входит в соотношение: где Nидиф–число Нуссельта для диффузионного потока (безразм.); Д –коэффициент диффузии, м2/с; αдиф–м/с; d – характерный размер обтекаемого тела, [м]. После математического преобразования полученных уравнений: 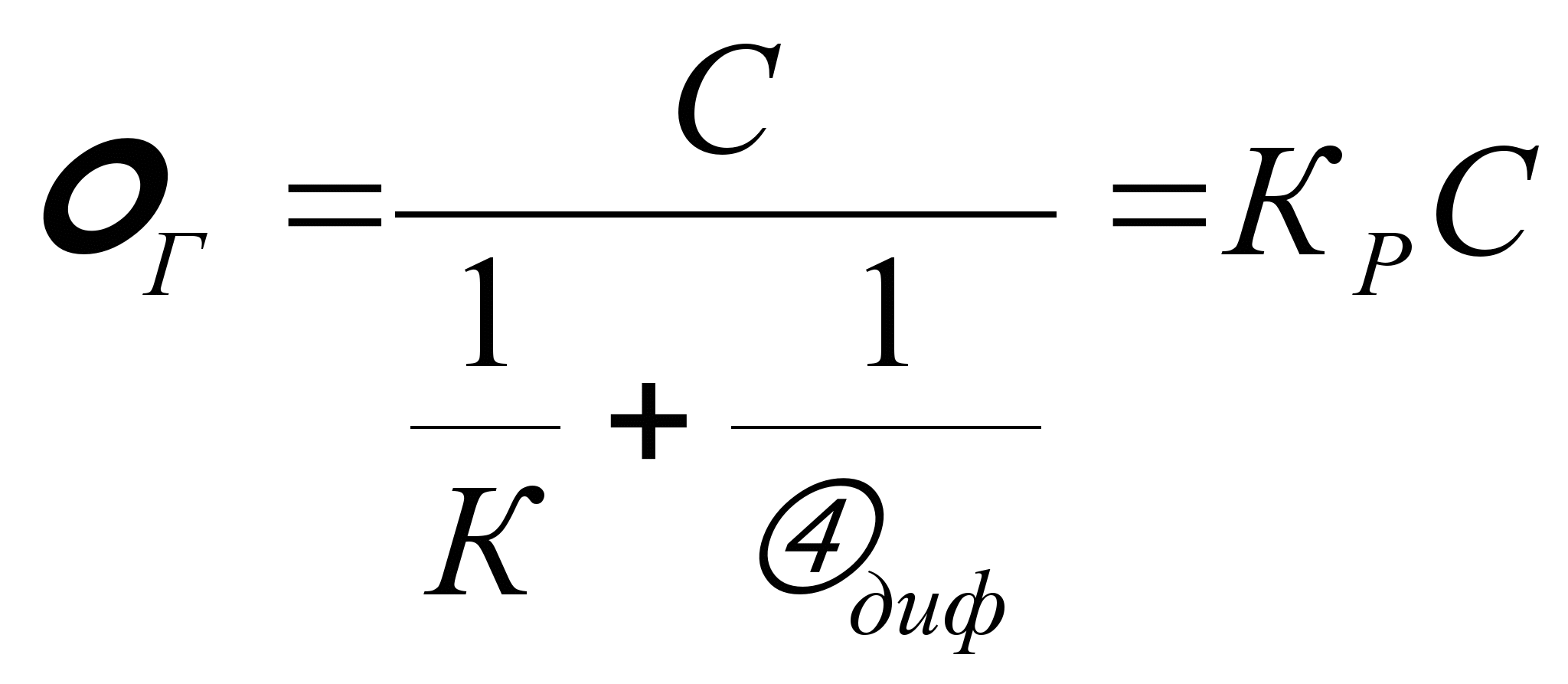 , ,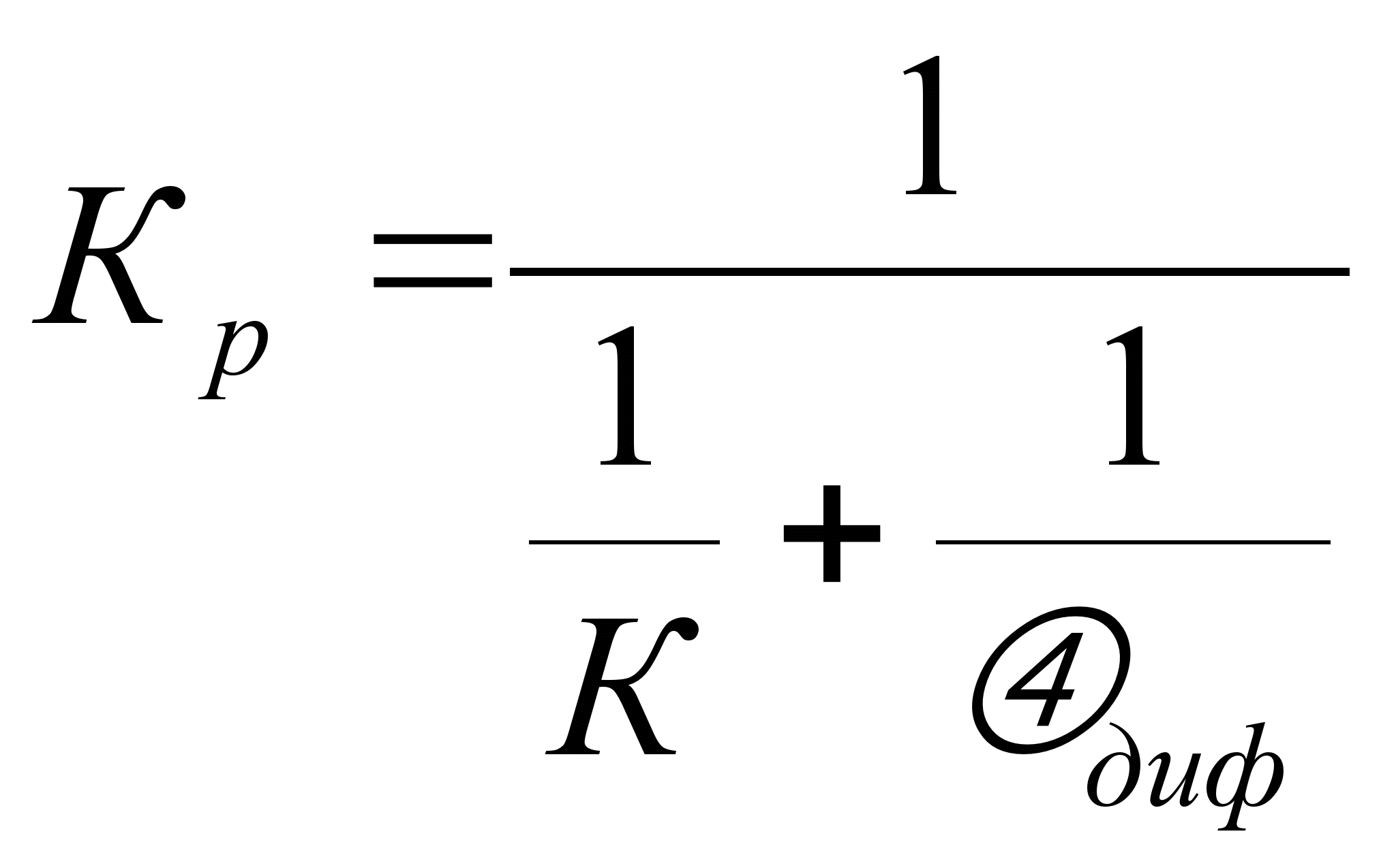 , ,где Кр – результирующая константа скорости горения, учитывающая химические и физические свойства реагирования. В данном уравнении 1/К и 1/αдиф являются химическими и физическими сопротивлениями процесса горения. Если сопротивление 1/К >> 1/αдиф, то => реакции будут протекать в кинетической области. Если 1/К << 1/αдиф, то область диффузионная. В реальных условиях горение твёрдых веществ значительно сложнее, поскольку в частицах твёрдого топлива имеются поры, и процесс горения не осуществляется на поверхности, а проникает внутрь частиц. Кроме того, частица имеет влажность, которая при нагревании частицы испаряется и образует область водяных паров. Так же из твёрдых частиц при сгорании выделяются летучие вещества, которые образуют вокруг частицы облако. Именно летучие вещества начинают гореть. Выделение влаги из частицы материала начинается при подогреве топлива до температуры около 100ОС. Начало выделения летучих веществ зависит от возраста топлива и от его химического состава ( чем больше возраст, тем меньшая температура приводит к началу выделения летучих веществ). Процесс горения твёрдого топлива заканчивается образованием золы, в которую входят минеральные негорючие примеси ^ |
