Токс. Юданова Т.О_56-1фип_к.р.№2. Контрольная работа 2 по дисциплине токсикологическая химия для подготовки специальности 33. 05. 01 Фармация вариант 8 семестр 9
 Скачать 114.59 Kb. Скачать 114.59 Kb.
|
ОКСАЗЕПАМ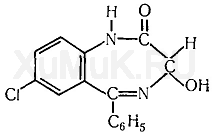 Оксазепам (тазепам, адумбран, нозепам, пракситен, серакс, серенал и др.) является производным 1,4-бензодиазепина. Он представляет собой кристаллический порошок, почти не растворимый в воде, растворимый в этиловом спирте и хлороформе. Этот препарат экстрагируется органическими растворителями, из щелочных водных растворов. Применение. Действие на организм. По фармакологическим свойствам оксазепам близкий к хлордиазепоксиду и диазепаму. Он менее токсичен, чем диазепам, обладает слабым противосудорожным действием и менее выраженным, чем диазепам, миорелаксантным эффектом. Применяется в медицине при неврозах, депрессивных состояниях, при бессоннице на почве нервного растройства. Метаболизм. Оксазепам явдяется одним из метаболитов диазепама. После приема оксазепама максимальный уровень его в плазме достигается через 4 ч, а через 48 ч он исчезает из плазмы. Оксазепам находится в плазме в виде глюкуронида. В виде глюкуронида он выделяется с мочой, а с калом он выделяется в неизмененном виде. Выделение оксазепама из биологического материала (по Λ. Φ. Фартушному с сотрудниками). К 25 г исследуемого объекта (желудок и тонкая кишка с содержимым, печень, почки) прибавляют 3 мл насыщенного водного раствора гидрофосфата натрия и эту смесь подвергают гомогенизированию. Гомогенат переносят в колбу с притертой пробкой вместимостью 500 мл, прибавляют 100 мл диэтилового эфира, содержимое колбы взбалтывают с помощью аппарата для встряхивания жидкостей в течение 10 мин, а затем отделяют эфирную вытяжку. Оставшийся в колбе гомогенат еще дважды взбалтывают с новыми порциями диэтилового эфира (по 100 и 50 мл) в течение 10 мин. Эфирные вытяжки соединяют, фильтруют через бумажный фильтр. Объединенные профильтрованные эфирные вытяжки используют для обнаружения и количественного определения оксазепама, выделенного из биологического материада. Выделение оксазепама из крови и мочи. В колбу с притертой пробкой вместимостью 250 мл вносят 10 мл крови или мочи, а затем прибавляют 100 мл диэтилового эфира. Содержимое колбы взбалтывают при помощи аппарата для встряхивания жидкостей в течение 10 мин. Затем отделяют эфирную вытяжку. Оставшуюся в колбе жидкость еще раз взбалтывают со 100 мл диэтилового эфира. Эфирные вытяжки соединяют и фильтруют через бумажный фильтр. Объединенные эфирные вытяжки используют для идентификации и количественного определения оксазепама. Обнаружение оксазепама Для обнаружения оксазепама применяют цветные реакции, метод хроматографии в тонком слое сорбента, методы УФ- и ИК-спектроскопии и др. Цветная реакция на оксазепам. 25—50 мл объединенной эфирной вытяжки, полученной после изолирования исследуемого вещества из биологического материала (см. выше), выпаривают досуха. Сухой остаток растворяют в 5 мл 6 н. раствора соляной кислоты и фильтруют. 1 мл фильтрата вносят в колбу вместимостью 25 мл и кипятят 5—10 мин. Жидкость охлаждают и помещают в холодильник на 15 мин. К охлажденной жидкости прибавляют 1 мл смеси (0,3 г бромида калия, 0,3 г нитрита натрия в 6 мл воды). Жидкость взбалтывают и помещают в холодильник на 30 мин. Затем к охлажденной жидкости прибавляют 0,5 мл 10%-го раствора мочевины. Через 15 мин прибавляют 1 мл 1 %-го спиртового раствора α-нафтола и 1 мл 40 %-го водного раствора гидроксида натрия. При наличии оксазепама появляется красная окраска, которую дает и хлордиазепоксид. Приведенная выше реакция может быть использована для фотоколориметрического определения оксазепама (А. Ф. Фартушный с сотр.). Обнаружение оксазепама методом хроматографии. 5—10 мл объединенной эфирной вытяжки (см. выше) выпаривают досуха. Сухой остаток растворяют в 0,5 мл этилового спирта. Каплю полученного раствора наносят на линию старта на пластинке «силуфол». Правее через 2—3 см на линию старта наносят каплю раствора «свидетеля» (0,5 %-й спиртовой раствор оксазепама). Пятна нанесенных растворов подсушивают на воздухе, а затем пластинку вносят в камеру для хроматографирования, насыщенную парами системы растворителей (хлороформ — пропиловый спирт — ацетон (9:0,4:1). Пластинку вынимают из камеры после того, как система растворителей поднимется на пластинке на 10 см выше линии старта, подсушивают на воздухе и опрыскивают насыщенным раствором тиосульфата натрия. При налички оксазепама на пластинке появляются оранжевые или желтоватые пятна. Обнаружение оксазепама по УФ- и ИК-спектрам. Растворы оксазепама в этиловом спирте имеют максимумы полос поглощения при 230 и 315 нм. В ИК-области спектра оксазепам (диск с бромидом калия) имеет основные пики при 1687, 1706, 693 и 830 см -1. 5.Химико-токсикологический анализ новокаина. 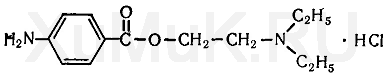 Новокаин (прокаин, аллокаин, синкаин и др.) — гидрохлорид β -диэтиламиноэтилового эфира п -аминобензойной кислоты. Он представляет собой белый кристаллический порошок без запаха. Растворяется в воде (1:1), этиловом спирте (1 : 15), слабо растворяется в диэтиловом эфире и хлороформе. Новокаин экстрагируется органическими растворителями из щелочных водных растворов. Применение. Действие на организм. Новокаин широко используется в медицине как анестетик. Он менее активен, чем кокаин. После всасывания в кровь новокаин понижает возбудимость периферических холинореактивных систем, уменьшает спазмы гладкой мускулатуры, понижает возбудимость мышцы сердца и некоторых отделов головного мозга. В токсических дозах новокаин вызывает возбуждение, а затем паралич центральной нервной системы. Метаболизм. Новокаин является нестойким препаратом. В организме он распадается на п -аминобензойную кислоту и диэтиламиноэтанол. В течение 24 ч после введения новокаина около 2 % этого препарата выделяется с мочой в неизмененном виде. Указанные выше метаболиты новокаина тоже выделяются с мочой. Часть п -аминобензойной кислоты выделяется с мочой в неизмененном виде и в виде глюкуронида. Обнаружение новокаина Для обнаружения новокаина применяют реакцию диазотиро-вания, реакцию с реактивом Драгендорфа и физико-химические методы. Реакциядиазотирования. К исследуемому раствору прибавляют 1 %-й раствор соляной кислоты, а затем по каплям прибавляют 1 %-й раствор нитрита натрия до тех пор, пока не начнет окрашиваться в синий цвет иодкрахмальная бумажка. Через 5 мин жидкость подщелачивают 2%-м раствором гидроксида натрия до щелочной реакции и прибавляют щелочной раствор β-нафтола. При наличии новокаина раствор приобретает красно-оранжевую окраску. Приготовление иод крахмальной бумажки (см. Приложение 1, реактив 4). Реакция с реактивом Драгендорфа. От прибавления к сухому остатку исследуемого вещества капли реактива Драгендорфа образуется осадок, состоящий из прямоугольных пластинок красно-бурого цвета. Обнаружение новокаина методом хроматографии. Раствор исследуемого вещества в этиловом спирте или спиртовой раствор остатка вещества, выделенного из биологического материала, наносят на хроматографическую пластинку, покрытую тонким слоем силикагеля. Пятна нанесенных растворов подсушивают на воздухе, а затем пластинку вносят в камеру, насыщенную парами системы растворителей (циклогексан — бензол — диэтиламин (75 : 15 : 10). Пластинку выдерживают в камере для хроматографирования до тех пор, пока жидкость поднимается на 10 см выше линии старта. После этого пластинку вынимают из камеры, высушивают на воздухе и опрыскивают реактивом Дра-гендорфа, модифицированным по Мунье. При наличии новокаина на пластинке появляются оранжево-коричневого цвета пятна (Rf = 0,16...0,18). Дикаин в этих условиях имеет Rf = 0,33...0,35, а кокаин —Rf = 0,60...0,63. Приготовление хроматографических пластинок (см. Приложение 2, способ 6). Обнаружение новокаина по УФ- и ИК-спектрам. Водный раствор новокаина имеет максимум поглощения при 290 нм. Новокаин в 0,2 н. растворе серной кислоты имеет максимумы поглощения при 228, 272 и 279 нм. В ИК-области спектра новокаин (диск с бромидом калия) имеет основные пики при 1274, 1690, и 1605 см 1. 6.Морфин. Структурная формула. Токсикологическое значение. Изолирование. Методы определения. Морфин является одним из главных алкалоидов опия, в котором содержится 3—20 % этого алкалоида. В молекуле морфина содержится атом азота, ОН-группа фенольного-и ОН-группа спиртового характера. Наличие атома азота и указанных ОН-групп обусловливает химические свойства морфина, используемые для аналитических целей. Осно вание морфина слабо растворяется в воде (в холодной 1 :5000, в кипящей — 1 :500) и диэтиловом эфире (1:7630). Еще хуже основание морфина растворяется в диэтиловом эфире, насыщенном водой (1 : 10 600). Основание морфина слабо растворяется в бензоле (1 : 1600) и хлороформе (1 : 1500), лучше — в этиловом спирте (в холодном 1 : 250, в кипящем — 1:13). 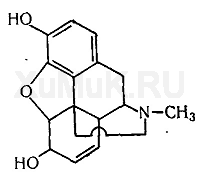 Ацетат морфина растворяется в этиловом спирте (1: 100), лучше — в воде (1 : 2,5), почти не растворяется в диэтиловом эфире. Гидрохлорид морфина растворяется в этиловом спирте (1 : 100), воде (1 : 23), почти не растворяется в диэтиловом эфире и хлороформе. Сульфат морфина слабо растворяется в этиловом спирте (1 : 1000), лучше — в воде (1 :21), практически не растворяется в диэтиловом эфире и хлороформе. Тартрат морфина растворяется в воде (1 : 10), хуже — в этиловом спирте (1 : 1000), почти не растворяется в диэтиловом эфире и хлороформе. Морфин экстрагируется органическими растворителями из щелочных водных растворов. Максимальные количества морфина экстрагируются хлороформом при рН = 8,6...10,2. Применение. Действие на организм. В медицине применяется гидрохлорид морфина. Этот препарат является основным представителем группы наркотических анальгетиков. Морфин оказывает сильное болеутоляющее действие, понижает возбудимость болевых центров, оказывает противошоковое действие при травмах и т. д. Морфин вызывает эйфорию. При повторном применении морфина к нему быстро развивается болезненное пристрастие (морфинизм). Слабо всасывается в кровь через пищеварительную систему. После парентерального введения морфина в организм максимальный уровень его в крови достигается примерно через 1 ч. Метаболизм. В организме основное количество морфина связывается с глюкуроновой кислотой и в виде глюкуронида выделяется с мочой. За первые 8 ч после введения морфина 50 % его выделяется с мочой в виде глюкуронида, а за 24 ч выделяется из организма примерно 90 % глюкуронида морфина. В организме незначительная часть морфина подвергается N-деметилированию (образуется норморфин) и О-метилированию (образуется кодеин). В органах трупов морфин постепенно превращается в псевдоморфин (оксидиморфин, дегидроморфин), по которому определяют отравление морфином. Выделение морфина из биологического материала. Для выделения морфина из биологического материала рекомендованы методы, основанные на изолировании этого алкалоида спиртом, подкисленным щавелевой кислотой, или водой, подкисленной щавелевой или серной кислотой. Большие количества морфина выделяются с помощью метода, основанного на изолировании его водой, подкисленной серной кислотой. Обнаружение морфина Реакции с реактивами группового осажденияалкалоидов. Морфин дает осадки с реактивами группового осаждения алкалоидов (реактивы Бушарда, Драгендорфа, Майера, Зонненшейна и др.). Цветные реакции. Морфин дает окраску с концентрированной азотной кислотой, реактивами Манделина, Марки, Фреде и Эрдмана. Эти реакции описаны выше (см. гл. V, § 7). Реакция Пеллагри. При нагревании морфина с концентрированными соляной и серной кислотами он превращается в апоморфин, который дает положительную реакцию Пеллагри. Выполнение реакции Пеллагри на морфин несколько отличается от способа выполнения этой реакции на апоморфин. При выполнении реакции Пеллагри на морфин и кодеин их переводят в апоморфин путем нагревания с концентрированными соляной и серной кислотами, а затем прибавляют остальные реактивы, необходимые для протекания этой реакции. Выполнение реакции. В пробирку вносят несколько капель хлороформной вытяжки, которую выпаривают досуха. К сухому остатку прибавляют 1—2 капли концентрированной соляной кислоты. После растворения сухого остатка в этой кислоте в пробирку вносят 1—2 капли концентрированной серной кислоты и смесь нагревают на водяной бане до полного выпаривания соляной кислоты. После этого жидкость еще нагревают в течение 15 мин, потом охлаждают и прибавляют 2—3 мл воды. Если при этом образуется осадок, то его растворяют в нескольких миллилитрах разбавленной соляной кислоты. Полученный раствор нейтрализуют 10 %-м раствором карбоната натрия и прибавляют 2—3 капли спиртового раствора иода. При этом появляется зеленая окраска. После прибавления 0,5—1,0 мл диэтилового эфира и взбалтывания водный слой сохраняет зеленую окраску, а зфирный приобретает пурпурно-красную. Избыток иода мешает этой реакции, так как его окраска маскирует окраску конечного продукта реакции. Реакцию Пеллагри дают и другие вещества (кодеин, этилморфин, диацетил морфин, апоморфин и др.). Реакция с хлоридом железа (Ш). В фарфоровую чашку вносят несколько капель хлороформной вытяжки, которую при комнатной температуре выпаривают досуха. К сухому остатку прибавляют 1—2 капли свежеприготовленного 2 %-го раствора хлорида железа (Ш). При наличии морфина появляется синяя окраска. Реакция с йодноватой кислотой (НIO 3 ). При взбалтывании раствора морфина, слабо подкисленного серной кислотой, с раствором йодноватой кислоты или раствором иодата калия (KIO 3 ), не содержащего иодидов, выделяется свободный иод, который при взбалтывании с хлороформом переходит в хлороформный слой, окрашивая его в фиолетовый цвет. Эту реакцию дают и некоторые примеси, которые переходят в хлороформную вытяжку при выделении морфина из биологического материала. Поэтому реакцию с HIO 3 можно применить для обнаружения морфина в препарате и смесях лекарственных веществ, а также в хорошо очищенных вытяжках из биологического материала. Реакция с гексацианоферратом (Ш) калия и хлоридом железа (Ш). Эта реакция основана на том, что гексацианоферрат (III) калия окисляет морфин и превращается в гексацианоферрат (II) калия, который взаимодействует с хлоридом железа (III). При этом образуется берлинская лазурь, имеющая синюю окраску. Реакцию с гексацианоферратом (III) калия выполняют так: к водному раствору исследуемого вещества прибавляют несколько капель смеси растворов гексацианоферрата (III) калия и хлорида железа (III). При наличии морфина появляется синяя окраска или такого же цвета осадок. Эту реакцию дают и некоторые примеси, которые из биологического материала переходят в алкалоидные вытяжки. Поэтому реакцию с гексацианоферратом (III) калия применяют для обнаружения морфина в лекарственных смесях и в хорошо очищенных вытяжках из биологического материала. Метод хроматографии. На линию старта на хроматографической пластинке наносят 1—2 капли хлороформной вытяжки. Правее на расстоянии 2—3 см на линию старта наносят каплю раствора «свидетеля» (0,01 %-й раствор морфина в хлороформе). Пятна на пластинке подсушивают на воздухе. Затем пластинку вносят в камеру для хроматографирования, насыщенную парами растворителей (эфир — ацетон — 25 %-ый аммиак в соотношении 40 : 20 : 2). Камеру плотно закрывают крышкой. После того как система растворителей поднимется на 10 см выше линии старта, пластинку вынимают из камеры, подсушивают на воздухе и опрыскивают реактивом Драгендорфа, модифицированным по Мунье. При наличии морфина пятна этого алкалоида на хроматографической пластинке приобретают розовато-бурую окраску (Rf = 0,18±0,01). Приготовление реактива Драгендорфа, модифицированного по Мунье (см. Приложение 1, реактив 33). Приготовление хроматографической пластинки (см. Приложение 2, способ 1). Обнаружение морфина по УФ- и ИК-спектрам. Раствор морфина в этиловом спирте имеет максимум поглощения при 287 нм. В 0,1 н. растворе гидроксида натрия максимумы поглощения морфина наблюдаются при длинах волн, равных 250 и 296 нм. В 0,1 н. растворе серной кислоты морфин имеет максимум поглощения при 284 нм. Водные растворы гидрохлорида и сульфата морфина имеют максимум поглощения при 285 нм. В ИК-области спектра основание морфина (диск с бромидом калия) имеет основные пики при 805, 1243, 1448, и 945 см -1. Фотоколориметрический метод определения морфина Для фотоколориметрического определения морфина применяют метод, основанный на реакции этого алкалоида с кремне-молибденовой кислотой, в результате которой возникает синяя окраска (по В. Ф. Крамаренко). Техника определения. В мерную колбу вместимостью 25 мл вносят 3 мл 0,11 %-го раствора силиката калия K 2 SiO 3, 4 мл воды, 2 мл 0,5 н. раствора соляной кислоты и 2 мл 5 %-го раствора молибдата аммония. Через 3 мин прибавляют 2 мл исследуемого раствора и 5 мл 6 %-го раствора аммиака. Через 10 мин объем жидкости доводят водой до метки и измеряют оптическую плотность окрашенного в синий цвет раствора с помощью фотоэлектроколориметра ФЭК-М (светофильтр красный, кювета 3 мм). В качестве раствора сравнения берут смесь, состоящую из 3 мл 0,11 %-го раствора силиката калия, 2 мл 0,5 н. раствора соляной кислоты, 2 мл 5 %-го раствора молибдата аммония, 5 мл 6 %-го раствора аммиака и 13 мл. воды. Расчет содержания морфина в пробах производят по калибровочному графику. Для построения калибровочного графика в 6 мерных колб вместимостью по 25 мл каждая вносят по 3 мл 0,11 %-го раствора силиката калия, 4 мл воды, 2 мл 0,5 н. раствора соляной кислоты и 2 мл 5 %-го раствора молибдата аммония. Через 3 мин в колбы вносят соответственно по 0,1; 0,5; 0,8; 1,0; 1,5 и 2,0 мл стандартного раствора (в 1 мл стандартного раствора содержится 2 мг гидрохлорида морфина), а далее поступают, как указано выше. Этот метод позволяет определять от 0,2 до 4 мг морфина в пробе. Пестициды. Классификации по назначению, химическая, токсикологическая. По объектам применения пестициды подразделяют на следующие группы: инсектициды {insectum - насекомое) - для борьбы с насекомыми; акарициды {acarus - клещ) - для борьбы с клещами; инсектоакарициды - для защиты растений одновременно от вредных насекомых и клещей; овициды (ovum - яйцо) - для уничтожения яиц вредных насекомых и клещей; ларвициды (larva - личинка) - для уничтожения личинок насекомых и клещей; моллюскициды - для борьбы с моллюсками; нематоциды {nematodes - круглые черви, фитогельминты) - для борьбы с вредными нематодами; родентициды (зооциды) - для борьбы с вредными грызунами; фунгициды {fungus - гриб) - для борьбы с грибными заболеваниями; бактерициды {bacteria - бактерия) - для борьбы с бактериями; антисептики (ant - против, septicos - вызывающий гниение) - для борьбы с гнилями древесины; гербициды {herbum, herbi - трава) - для уничтожения нежелательной травянистой (сорной, ядовитой) растительности; арборициды - для уничтожения нежелательной древесно-кустарниковой растительности; альгициды - для уничтожения водорослей; афициды - для борьбы с тлями; вермициды - для борьбы с червями; вирусоциды - для борьбы с вирусами; хемостерилянты - для половой стерилизации насекомых. Классификация по объектам применения в известной степени условна, так как многие пестициды обладают универсальностью действия, способностью поражать разные группы вредных организмов. По химическому составу выделяют три основные группы: пестицидов неорганические соединения (соединения ртути, меди, серы, фтора, бария и т. д.); органические соединения (хлорорганические, фосфорорганические соединения, синтетические пиретроиды, производные карбаминовой, тио- и дитиокарбаминовой кислот, нитрофенолы и др.), препараты растительного, бактериального и грибного происхождения (пиретрины, антибиотики). Инсектициды поступают в организм насекомых через дыхательные органы, кожные покровы, пищеварительный тракт, что вызывает нарушение их жизнедеятельности и гибель. Проникнув в живые клетки, они изменяют физико-химические свойства цитоплазмы, разрушают мембраны органелл, нарушают реакцию среды и условия нормального функционирования клеточных белков, вызывают гибель клеток. Особенно чувствительны к действию инсектицидов ферменты. Отравление какого-либо фермента, участвующего в важном метаболическом процессе, оказывает угнетающее, а иногда и летальное действие на организм насекомого. По характеру действия все инсектициды подразделяют на группы кишечного, контактного, системного действия и фумиганты. Кишечные действуют, попадая в пищеварительные органы насекомых с пищей, к контактным – относят вещества, вызывающие гибель насекомых при контакте с ними, проникая через кожные покровы; системные способны проникать в растения, перемещаться в их тканях и вызывать гибель вредителей при питании соками и тканями растений, фумиганты вызывают гибель вредителей, проникая через дыхательные пути в виде газа или пара. Многие инсектициды обладают всеми или несколькими типами действия одновременно. При кишечном отравлении насекомых инсектицид поступает в организм с пищей, вызывая определенное отмирание эпителиального слоя средней кишки и нарушение работы ферментативных систем. Затем яд поступает в гемолимфу и вызывает общее отравление организма. Контактное отравление насекомых происходит различными путями. Чаще всего инсектицид, проникая через кожные покровы, ассимилируется жировой тканью и распространяется далее с током гемолимфы, достигая нервной системы. Поступая в организм, инсектицид может подвергаться различным изменениям и превращаться в еще более токсичные продукты или терять ядовитость. При этом продукты метаболизма инсектицидов выделяются через мальпигиевы сосуды, обезвоживаются в жировом теле и откладываются в клетках с последующим отделением при линьке насекомых. Скорость отравления бывает различной и сопровождается нарушением обмена веществ. В организме уменьшается количество воды, жиров, белковых веществ, происходит деформация жирового тела, разрушаются форменные элементы гемолимфы. Под действием инсектицидов может меняться окраска насекомых; их гибели иногда предшествует потеря в весе. Инсектицид при небольших дозах не вызывает смерти насекомого, но он нарушает физиологические функции отдельных органов и их дальнейшее нормальное развитие: у выживших после обработки особей появляется дегенеративное потомство, уменьшаются размеры и масса насекомых, снижается их плодовитость, увеличивается смертность в ближайших поколениях. Существует избирательность токсического действия инсектицидов по отношению различных видов насекомых, одни действуют на многих, другие—на ограниченное число видов. Иногда у насекомых наблюдается привыкание к яду. Оно может быть результатом применения слишком малой дозы инсектицида или действия других факторов. В этом случае обычные смертельные дозы уже не действуют и их нужно значительно увеличивать. Особенно быстро развивается устойчивость к органическим веществам (7-20 поколений). Привыкание к яду — явление временное и при смене ядов быстро исчезает. Однако в процессе естественного отбора могут появляться особи с повышенной индивидуальной устойчивостью к отдельным ядам, она может закрепиться в поколениях и стать устойчивым наследственным признаком. Способность пестицидов оказывать токсическое (отравляющее) воздействие на растение называют фитотоксичностью. Она проявляется при неправильном применении пестицидов, когда завышаются допустимые концентрации или нарушается технология обработки растений. При этом пестициды могут вызвать повреждение защищаемых древесных пород, а также соседних с ними деревьев и подлеска. Действие пестицидов на растения начинается с момента контакта и проникновения через листья, стебли или корни. При быстром распространении по растению пестициды вызывают общее отравляющее действие, оказывающее влияние на весь организм. Если пестицид распространяется медленно и локализуется в местах проникновения в растения, он оказывает местное действие. Оно чаще всего проявляется в виде ожогов листьев, на которых появляются бурые и коричневые пятна. Ожигающее действие пестицидов обусловлено ионами водорода в рабочем растворе и зависит от степени электролитической диссоциации соединений. При общем повреждении растений происходят глубокие физиологические изменения в транспирации, фотосинтезе, водном обмене, ферментативных реакциях. При сильном отравлении растение может погибнуть. Пестициды могут оказывать на растения и стимулирующее влияние, что приводит к усилению роста, увеличению плодоношения, их большей устойчивости. При подборе и испытании пестицидов проверяют их действие на растения. Пестицид по возможности должен быть малотоксичным для растений, но сильно действующим на вредный организм. Пригодность препарата характеризуется хемотерапевтическим коэффициентом (ХК), который выражается отношением минимальной дозы пестицида, убивающей вредный организм (Д1), к максимальной дозе, переносимой защищаемым растением (Д2): |
