ким. ким химия. Контрольная работа 2 по теме Хлор. Кислород. Сера. Вариант 1 Напишите уравнения реакций а между хлором и водородом
 Скачать 79.95 Kb. Скачать 79.95 Kb.
|
|
9класс Контрольная работа №2 по теме «Хлор. Кислород. Сера». Вариант 1 1. Напишите уравнения реакций: 2.С какими из перечисленных веществ будет реагировать раствор серной кислоты: гидроксид натрия, оксид меди (II), золото, магний, хлорид бария, серебро, гидроксид алюминия? Напишите уравнения осуществимых реакций. 3.Вычислите массовую долю примесей, содержащихся в образце пирита (FeS2), если при обжиге такого образца массой 32 г образовался оксид серы (IV) массой 25,6 г. Контрольная работа №2 по теме «Хлор. Кислород. Сера». Вариант 2 1. Напишите уравнения реакций: а) между хлором и медью; б) между хлором и алюминием; в) серы с водородом; г) серы с натрием 2.С какими из перечисленных веществ будет реагировать раствор серной кислоты: гидроксид кальция, медь, оксид цинка, железо, оксид кремния (IV), нитрат бария, гидроксид меди (II)? Напишите уравнения осуществимых реакций. 3.Вычислите массу оксида серы (IV), который можно получить при обжиге пирита (FeS2) массой 32 г, если массовая доля примесей в образце пирита, взятого для реакции, составляет 25%. Контрольная работа №4№3 по теме «Металлы». Вариант 1. 1.Составьте уравнения реакций, соответствующих приведенным схемам: А) H2SO4(р-р) + Zn → Б) Li + O2 → В) Cu + AgNO3 → Г) Ca + P → 2.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Fe(NO3)3 → Fe(OH)3 → Fe2O3 → Fe → FeCl2. 3.Расставьте коэффициенты в уравнении реакции методом электронного баланса: CuS + O2 → CuO + SO2. 4.При взаимодействии 5,4 г Al с соляной кислотой было получено 6,384 л водорода (н.у.). Сколько это составляет процентов от теоретически возможного? Контрольная работа №4 по теме «Металлы».№3 Вариант 2. 1.Составьте уравнения реакций, соответствующих приведенным схемам: А) HCl(р-р) + Mg → Б) Al + O2 → В) Zn + FeSO4 → Г) Na + S → 2.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → FeCl3. 3.Расставьте коэффициенты в уравнении реакции методом электронного баланса: Fe2O3 + CO → Fe + CO2. 4. Определите объем водорода, который может быть получен при взаимодействии с водой 5 г Са, если выход водорода составляет 90% от теоретически возможного? Итоговая контрольная работа Вариант 1
Итоговая контрольная работа Вариант 2
Инструкция по проверке заданий итоговой контрольной работы. Максимальное число баллов за тест- 26, из них за задания части А – 10 (по 1 баллу за задание), части В -10 (по 2 балла за задание). Часть А
Часть В
Перевод баллов в отметки:
8класс Контрольно-измерительные материалы Контрольная работа №1 по теме «Первоначальные химические понятия». Вариант 1. Выберите один верный ответ. 1.Только сложные вещества перечислены в ряду 1) воздух, вода, кислород 2) серная кислота, водород, озон 3) кислород, азот, хлор 4) поваренная соль, вода, сероводород 2.Какая запись обозначает, что молекула азота состоит из двух атомов? 1) 2N 2) N2 3) N2O 4) N2O3 Выполните задания. 3.Перепишите приведенные ниже формулы веществ и обозначьте римскими цифрами валентность элементов: CaO, H2S, Fe2O3, Na2O, NH3. 4.Вычислите массовую долю кислорода в железной окалине Fe3O4. Контрольная работа №1 по теме «Первоначальные химические понятия». Вариант 2. Выберите один верный ответ. 1.Только простые вещества перечислены в ряду 1) воздух, вода, кислород 2) серная кислота, водород, озон 3) кислород, азот, хлор 4) поваренная соль, вода, сероводород 2.Запись 2О2 обозначает 1) четыре атома кислорода 2) два атома кислорода 3) две молекулы кислорода 4) четыре молекулы кислорода Выполните задания. 3.Перепишите приведенные ниже формулы веществ и обозначьте римскими цифрами валентность элементов: Ag2O, NH3, FeCl3, P2O5, CH4. 4.Вычислите массовую долю водорода в молекуле метана СН4. Контрольная работа №4 по теме «Основные классы неорганических соединений». Вариант 1 1.Даны формулы веществ: FeO, K2O, CO2, MgO, CrO, CrO3, SO2, P2O5. Выпишите формулы только основных оксидов и дайте им названия. 2.Допишите уравнения химических реакций: 1) LiOH + SO3 → 2) Ba(OH)2 + SO2 → 3) Mg(OH)2 → 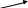 3.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Ca(OH)2 3.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Ca(OH)2 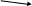 Ca → CaO ↓ Ca → CaO ↓CaCl2 4.В реакцию с соляной кислотой вступило 12 г магния. Рассчитайте массу и количество вещества образующегося водорода. Уравнение реакции: Mg + HCl → MgCl2 + H2↑ Контрольная работа №4 по теме «Основные классы неорганических соединений». Вариант 2 1.Даны формулы веществ: CO2, Na2O, CaO, MnO, Mn2O7, Cl2O7, Li2O, P2O5. Выпишите формулы только кислотных оксидов и дайте им названия. 2.Допишите уравнения химических реакций: 1) Ca(OH)2 + CO2 → 2) NaOH + P2O5 → 3) Al(OH)3 →   3.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: NaOH 3.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: NaOH 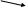 Na2O Na2CO3 Na2O Na2CO3NaNO3 4.В реакции цинка с соляной кислотой образовалось 68 г хлорида цинка. Рассчитайте массу и количество вещества цинка, вступившего в реакцию. Уравнение реакции: Zn + HCl → ZnCl2 + H2↑ Ответы к контрольной работе №1 по теме «Первоначальные химические понятия». Вариант 1. 1.4 (1 б) 2.2 (1 б) 3. CaIIOII, HI 2SII , FeIII 2OII 3, NaI 2OII , NIII HI 3. (2,5 б)  4.Дано: Решение: 4.Дано: Решение:Fe3O4 n • Ar(O)  Ѡ (О) = ----------- (3 б) Ѡ (О) = ----------- (3 б)Ѡ (O) - ? Mr(Fe3O4) Mr(Fe3O4)= 3• Ar(Fe) + 4•Ar(O) = 3 • 56 + 4 • 16 = 168 + 64 = 232 4 • 16 64 Ѡ (О) = ---------- = -------- = 0.275 или 27,5% 232 232 Ответ: 0.275 или 27,5% 5. А) 3H2O + P2O5 → 2H3PO4 реакция присоединения (1.5 б) Б) 2H2O → 2H2↑ + O2↑ реакция разложения (1.5 б) В) CuO + H2 → H2O + Cu реакция замещения (1.5 б) Ответы к контрольной работе №1 по теме «Первоначальные химические понятия». Вариант 2. 1.3 (1 б) 2.3 (1 б) 3. AgI2 OII, NIIIHI3, FeIIIClI3, PV2OII5, CIVHI4. (2,5 б)  4.Дано: Решение: 4.Дано: Решение:СН4 n • Ar(Н)  Ѡ (Н) = ----------- (3 б) Ѡ (Н) = ----------- (3 б)Ѡ (Н) - ? Mr(СН4) Mr(СН4)= 1• Ar(С) + 4•Ar(Н) = 1 • 12 + 4 • 1 = 12 + 4 = 16 4 • 1 4 Ѡ (Н) = ---------- = -------- = 0.25 или 25% 16 16 Ответ: 0.25 или 25% 5. А) 2NH3 → N2↑ + 3H2↑ реакция разложения (4.5 б) Б) 2Na + Cl2 → 2NaCl реакция присоединения В) 2Al + 6HCl → 2AlCl3 + 3H2↑ реакция замещения Критерии оценивания: «5» - 10 – 12 баллов «4» - 7 – 9 баллов «3» - 4 – 6 баллов «2» - 0 – 3 балла Контрольная работа №2 по темам «Кислород», «Водород». Вариант 1. 1.Напишите формулы следующих оксидов: А) оксида хлора (III) Б) оксида кальция 2.Допишите уравнения реакций горения, расставьте коэффициенты : А) P + O2 → Б) Li + O2 → В) Ca + O2 → 4.Определите массовую долю водорода в аммиаке NH3. 1.Рассчитайте массы сахара и воды, которые нужно взять для приготовления 250 г раствора с массовой долей сахара 15%. 2.Какое количество вещества (моль) соответствует 320 г оксида меди CuO? Контрольная работа №2 по темам «Кислород», «Водород». Вариант 2. 1.Напишите формулы следующих оксидов: А) оксида натрия Б) оксида азота (V) 2.Допишите уравнения реакций горения, расставьте коэффициенты : А) Al + O2 → Б) C + O2 → В) Cu + O2 → 4. Определите массовую долю водорода в сероводороде H2S. 1. Рассчитайте массы сахара и воды, которые нужно взять для приготовления 500 г раствора с массовой долей сахара 0,05. 2.Какое количество вещества (моль) соответствует 54 г воды Н2О? 2020-2021 учебный год | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

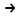 S
S  ,8
,8