ФизическаяХимия вар 9. Контрольная работа дисциплина (мдк)
 Скачать 0.92 Mb. Скачать 0.92 Mb.
|
|
Одной из движущих силхимической реакции является рассмотренное нами ранееуменьшение энтальпии системы,т.е. экзотермический тепловой эффект реакции. Как показывает опыт, большинство экзотермических реакций (?Н <0) протекают самопроизвольно. – Почему? Однако условие ?Н <0 не может быть критерием! Самопроизвольного течения реакций, так как существуют самопроизвольные эндотермические химические реакции, у которых ?Н >0, например, взаимодействие метана с водяным паром при высокой температуре. Следовательно, кроме уменьшение энтальпии системы (энтальпийного фактора) имеется другая движущая сила самопроизвольного процесса. Такой силой является стремление частиц (молекул, ионов, атомов) к хаотичному движению, а системы – к переходу от более упорядоченного состояния к менее упорядоченному. Например, представим пространство, в которое помещено вещество, в виде шахматной доски, а само вещество – в виде зерен. Каждая клетка доски соответствует определенному положению и уровню энергии частиц. Если частицы распределяются по всему пространству, то вещество находится в газовом состоянии; если частицы займут только небольшую часть пространства, то вещество перейдет в конденсированное состояние. Все высыпанные зерна распределяются на доске более или менее равномерно. На каждой клетке доски окажется определенное число зерен. Положение зерен после каждого рассыпания соответствуетмикросостоянию системы, которое можно определить как мгновенный снимок, фиксирующий расположение частиц в пространстве. Каждый раз мы получаем систему в одном и том же макросостоянии.Число подобных микросостояний, удовлетворяющих ожидаемому макросостоянию (при достаточно большом количестве частиц) очень велико. Например, коробка с ячейками, в которой находятся шары: так в 9 ячейках находятся 4 шара – это модель макросистемы. Шары по ячейкам можно разложить 126 различными способами, каждый из которых является микросостоянием. Число микросостояний, посредством которых реализуется данное макро состояние, связано стермодинамической вероятностью W. Энтропия определяется термодинамической вероятностью: она тем выше, чем больше способов реализации макросостояния. Поэтому считают, что энтропия – мера неупорядоченности системы. Математически связь энтропии с числом микросостояний установил Л. Больцман в конце 19 века, выразив ее уравнением: S=k*lnW, где W- термодинамическая вероятность данного состояния системы при определенном запасе внутренней энергии U и объеме V; k–постоянная Больцмана, равная 1,38*10-23Дж/К. Пример с шарами , конечно, очень нагляден, но он коварен, так как на основании его интуитивно под упорядоченностью системы иногда понимают расположение частиц в пространстве. Однако, в действительности под термодинамическим состоянием подразумевается, главным образом, расположение частиц (например, молекул) по возможным уровням энергии (каждый вид движения –колебательное, вращательное, поступательное- характеризуется своим уровнем энергии). Энтропия также зависит от массы частиц и их геометрического строения. Кристаллы имеют наименьшую энтропию (так их частицы могут колебаться только около некоторого состояния равновесия), а газы – наибольшую, так как для их частиц возможны все три вида движения. ST Всякому веществу можно приписать определенное абсолютное значение энтропии. Конечно, энтропии веществ обычно не рассчитывают на основании уравнения Больцмана. Их определяют по уравнению классической термодинамики с учетом теплоемкости данного вещества и теплот фазовых переходов. Значение энтропии различных веществ при 298 К и давлении 1 атм. (S0298)являются табличными данными. На основании данных о стандартной энтропии веществ можно рассчитать изменение энтропии различных химических процессов. Поскольку энтропия является функцией состояния, то ее изменение не зависит от пути процесса и равно разности энтропий продуктов реакций иисходных веществ: ?S0реакц.=??i S0- ??jS0 Во многих случаях изменение энтропии процесса можно оценить качественно: · Так, энтропия всегда увеличивается при переходе из конденсированного состояния (твердого или жидкого) в парообразное. · Энтропия всегда возрастает при растворении твердого или жидкого вещества, причем, чем больше степень диссоциации, тем заметнее увеличивается энтропия. При растворении газов, напротив, энтропия уменьшается. · Чем сложнее состав вещества, тем больше энтропия. Например, для оксидов марганца МnO,Mn2O3, Mn3O4 энтропия равна соответственно 61,50; 110,5; 154,8 кДЖ/моль*К. · В химических реакциях энтропия возрастает, если в результате их увеличивается количество газообразных веществ. Например, в реакции термического разложения карбоната кальция: СаСО3(т)= СаО(т) + СО2(г) Второе начало (закон) термодинамикирегламентирует принципиальную возможность протекания различных процессов. В середине 19 века этот закон был сформулирован в виде нескольких постулатов. Наиболее известные из них следующие: · Невозможно осуществить перенос тепла от более холодного тела к более горячему, не затрачивая на это работу. (Р. Клаузиус) и с использованием понятия энтропии: · В изолированных системах самопроизвольно идут процессы, при которых происходит увеличение энтропии. (?Sизолир.>0) или Всякая изолированная система самопроизвольно стремиться принять состояние, характеризующееся максимальной термодинамической вероятностью. На основании уравнения Больцмана можно показать, что любой необратимый процесс, самопроизвольно протекающий в изолированной системе, характеризуется увеличением энтропии. Пусть в изолированной системе находятся два химически не взаимодействующих газа, например гелий и неон, при одинаковых условиях, разделенные перегородкой. В этом состоянии термодинамическая вероятность системы w1. При удалении перегородки газы начинают самопроизвольно диффундировать друг в друга до тех пор, пока молекулы каждого газа равномерно не распределятся по всему объему. В конечном состоянии термодинамическая вероятность w2. Система самопроизвольно перешла из менее вероятного состояния в более вероятное (w2> w1). Энергетический обмен системы с внешней средой отсутствует, следовательно, единственная причина протекания этого процесса - увеличение энтропии. Другими словами, процессы протекают самопроизвольно лишь в сторону менее упорядоченного состояния, т.е. нарастания беспорядка. Именно поэтому испарение жидкости, растворение соли в воде или смешение газов происходит самопроизвольно, а вместе с тем обратные процессы без обмена энергией с окружающей средой невозможны. Следовательно, увеличение энтропии является критерием самопроизвольного протекания процессов только в изолированных системах, т.е. не обменивающихся энергией с внешней средой, а это довольно редкий случай. В открытых и замкнутых системах, кроме изменения энтропии, на направление процесса влияет еще и изменение энтальпии. Энергия Гиббса и Гельмгольца. Критерий самопроизвольного протекания процессов. Какие же процессы идут самопроизвольно в неизолированных системах? При взаимодействии водорода с кислородом самопроизвольно образуется вода: 2Н2(г) +О2(г)= 2Н2О(г) В этой реакции энтропия уменьшается, но выделяется большое количество теплоты (?S<0, ?Н <0), т.е. самопроизвольному протеканию процесса способствует уменьшение энтальпии. Самопроизвольно происходит и растворение хлорида аммония в воде: NH4Cl(тв) + aq = NH4+(р) + Cl-(р) Этот процесс сопровождается понижением температуры (поглощение теплоты) и увеличением энтропии (?S>0, ?Н >0), причем главную роль играет последний фактор. В термодинамике вводится новая функция, связывающая две предыдущие величины –энергия Гиббса.(G) G=H–TS Основная ценность этой функции заключается в том, что ее изменение при постоянной температуре и давлении определяет самопроизвольность процессов. ?G =(?H – T?S) <0 · В классической термодинамике под энтропией понимают такое свойство системы, изменение которого при обратимом процессе численно равно отношению теплоты к температуре протекания процесса: ?S=Q/T;T?S=Q · В термодинамике обратимым называют такой процесс, который проводится бесконечно медленно и так, чтобы система находилась все время практически в состоянии равновесия. Таким образом, величина?Gхарактеризует ту часть изменения внутренней энергии, которая может быть превращена в полезную работу. При условии постоянства объема пользуются термодинамической функцией, которая называется Энергией Гельмгольца (F): F=U–T?S В изохорном процессе полезная работа определяется изменением энергии Гельмгольца, а условием самопроизвольности процесса является ее уменьшение ?F<0. В химии обычно пользуются энергией Гиббса, поскольку чаще всего химические реакции проводят при постоянном (атмосферном) давлении. Итак, в неизолированной системе процесс преимущественно происходит самопроизвольно, если ему соответствует уменьшение энергии Гиббса.(?G<0.) При ?G=0 состояние системы соответствует равновесию. При ?G>0 -процесс преимущественно не протекает в прямом направлении Анализ уравнения ?G=(?H–T?S)показывает, что знак величины ?G,а значит, термодинамическая возможность самопроизвольного протекания реакции зависят от двух факторов: энтальпийного (энергетического) и энтропийного. С одной стороны, система стремится занять прийти к минимальному уровню энергии, выделив часть ее в виде теплоты или работы (?H<0). С другой стороны, система стремится занять наиболее вероятное состояние, характеризующееся максимумом молекулярного беспорядка, т.е. максимумом энтропии (?S>0).В этом случае энтальпийный и энтропийный факторы действуют в направлении, благоприятствующему протеканию реакции. Рассмотрим варианты: а) ?H<0;?S>0;в этом случае?G<0 при всех значениях температуры, процесс термодинамически возможен при любой температуре. б) ?H<0;?S<0;в этом случае?G<0 при Т<,т.е.при реакция термодинамически возможна при при сравнительно низкотемпературном режиме; в) ?H>0;?S>0;в этом случае?G<0 при Т>,процесс возможен при высоких температурах; г) ?H>0;?S<0;в этом случае?G<0 - оба фактора действуют в неблагоприятном направлении, реакция термодинамически невозможна при любых значениях температур. - Как рассчитать изменение энергии Гиббса? Первый способ расчета аналогичен методу оценки изменения энтальпии реакции по табулированным энтальпиям образования различных веществ. В таблицах сведены и величины ?G0обр.298 и точно также принято, что для простых веществ ?G0обр.298=0 ?G0реакц.=?? i ?G0обр.прод.- ??j?G0обр.исх. ij Второй способ основан на расчете сначала величин ? Hреакц..и ?Sреакц.для данного процесса, а потом исходя из них – величины ?G0реакц по формуле: ?G0реакц=?H0реакц.– 298?S0реакц. Данный способ хорош тем, что позволяет оценить, как изменится знак ?G0реакцпри изменении температуры. Хотя энтальпия и энтропия веществ зависят от температуры, но для реакции изменение этих величин незначительно, поэтому приближенно считают, что в некотором интервале температур ? Hреакц..и ?Sреакц величины практически постоянные. Для простых веществ, находящихся в термодинамически устойчивых состояниях ?G0=0. 39. Особенности химического равновесия в гетерогенных системах. Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. При равенстве скоростей прямой и обратной реакции наступает химическое равновесие в гетерогенной системе. С(к) + 2Н2О = СО2 + 2Н2 , МеО(к) + Н2 = Ме(к) + Н2 О. Как и для любого равновесия, условием гетерогенного химического равновесия является равенство энергии Гиббса нулю, ΔG = 0. Как и в случае гомогенной химической реакции, константа гетерогенного равновесия равна отношению произведения равновесных концентраций (активностей) или парциальных давлений продуктов реакций к произведению равновесных концентраций (активностей) или парциальных давлений исходных веществ в степенях, равных стехиометрическим коэффициентам в уравнении. Для реакции пароводяной конверсии углерода константа равновесия имеет вид: Кр = (рСО2)р (рН2)2р/(рН2О)2р, для восстановления металла Кр = (рН2O)р/(рН2)р. В уравнения констант гетерогенного химического равновесия не входят концентрации твердых веществ, участвующих в прямой и обратной реакциях. Это особенность гетерогенного химического равновесия. Так как прямая и обратная реакции протекают на одной и той же поверхности раздела фаз, то площадь поверхности раздела фаз также не входит в уравнение константы химического равновесия. Константа гетерогенного химического равновесия зависит от температуры. Она возрастает с увеличением температуры для эндотермической прямой реакции и уменьшается с увеличением температуры в случае экзотермической прямой реакции. Расчеты проводятся по тем же формулам, что и для гомогенных реакций. Смещение равновесия гетерогенных реакций подчиняется принципу Ле Шателье. При повышении температуры оно смещается в сторону эндотермической реакции. При повышении давления или концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции, при повышении концентрации или давления продуктов реакции равновесие смещается в сторону обратной реакции. При повышении общего давления равновесие сдвигается в направлении уменьшения числа молекул газообразных веществ. Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия. 49. Сущность эвтектической кристаллизации. Характеристика понятий «эвтектика», «эвтектическая точка», «эвтектическая температура». Эвтектическая кристаллизация – типичное превращение для высокоуглеродистых сплавов на основе железа – чугунов. Эвтектическая кристаллизация происходит как в стабильной, так и в метастабильной системе железо углеродов. Наиболее полно описывает механизм и кинетику эвтектического превращения кристаллизация ледебурита, которая в чистом виде происходит в эвтектическом белом чугуне при содержании углерода 4,3 %. Температура эвтектической кристаллизации 1 147 °С, что соответствует эвтектической точке С. Эвтектическая кристаллизация заключается в одновременном выделении из переохлажденной жидкой фазы двух разнородных твердых фаз в изотермических условиях. В результате эвтектической кристаллизации образуется специфичная структурная составляющая – эвтектика, представляющая собой смесь регулярно чередующихся высокодисперсных частиц двух (или более) фаз, образовавшихся в результате диффузионного разделения переохлажденной жидкости. В составе ледебурита такими составляющими являются аустенит состава точки Е и цементит состава точки F. В соответствии с диаграммой железо углерод эвтектика образуется при кристаллизации сплавов, ограниченных протяженностью эвтектической линии ECF (E'C'F' – в стабильной системе). Эвтектическое превращение в двухфазной системе является одним из случаев трехфазного равновесия. Число степеней свободы, отвечающее этому превращению, равно нулю. Это означает, что на термических кривых охлаждения и нагрева сплавов должна выявляться изотермическая ступенька, связанная с выделением (поглощением) скрытой теплоты эвтектической реакции. Эти ступеньки, соответствующие изотермическим условиям развития превращения, можно наблюдать на термических кривых, отвечающих лишь двойным железоуглеродистым сплавам. В реальных чугунах, содержащих дополнительно, кроме основных компонентов, постоянные примеси: кремний и марганец, эвтектическая кристаллизация происходит в интервале температур. Рассмотрим кристаллизацию ледебурита. Жидкий сплав эвтектического состава при температуре эвтектической точки С получает значение термодинамического потенциала, отвечающее равновесию этой жидкости с аустенитом и цементитом. Прямая, соединяющая значения минимума свободной энергии аустенита и цементита, одновременно является и касательной к линии изменения свободной энергии жидкости. При переохлаждении до температуры точки а термодинамический потенциал жидкости увеличивается более значительно, чем смеси γ + Fe3C, в связи с чем появляется термодинамический стимул превращения ΔF. Для развития эвтектической кристаллизации, кроме того, необходимы флуктуации концентраций, которые также появляются в жидкости, поскольку в этих условиях жидкость оказывается пересыщенной как железом, так и углеродом. Таким образом, в условиях переохлаждения оказывается возможным одновременное выделение и фазы, обогащенной железом (аустенита состава точки Е), и фазы, богатой углеродом (цементита состава точки F). Переохлаждение сплава ниже 1 147 °С вызывает развитие эвтектической кристаллизации жидкости по реакции LС ⇔ (γЕ + Fe3C)э. Степень переохлаждения жидкости должна быть такой, чтобы возникающая разница термодинамических потенциалов жидкости и смеси твердых фаз была бы достаточной для образования поверхностей раздела формирующихся фаз с жидкостью. Причем чем больше величина термодинамического стимула кристаллизации (больше степень переохлаждения), тем интенсивнее развивается эвтектическая кристаллизация. При малых степенях переохлаждения кристаллы аустенита и цементита могут зарождаться и расти раздельно. В результате будет образовываться структура грубого конгломерата, не являющаяся, по существу, типичной структурой эвтектического чугуна. Наиболее характерным признаком эвтектической кристаллизации является одновременный рост аустенитных и цементитных кристаллов, образующих в большинстве случаев своеобразную колонию сотового строения. В общем случае зарождение эвтектических фаз неодновременное, однако зарождение частицы одной из фаз (цементита) приводит к быстрому обеднению C и обогащению Fe жидкости, окружающей эту частицу. Это способствует появлению на границе растущего кристалла (цементита) зародыша новой фазы (аустенита). Кристаллы новой фазы (аустенита), образовавшись, приостанавливают рост первой фазы (цементита) и растут сами, обогащая приграничную область жидкости компонентом (углеродом), необходимым для зарождения нового слоя первой фазы (цементита). Таким образом, процесс повторяется, способствуя образованию пакета тонких цементитных пластин, разделенных аустенитом. Такой пластинчатый ледебурит является типичным зародышем, на котором формируются колонии сотового ледебурита. Зарождение сотового ледебурита связано с появлением неровностей на поверхности пластины аустенита. В результате чего в жидкости перед фронтом кристаллизации начинается перераспределение углерода, который скапливается преимущественно в ямках неровностей на поверхности аустенитной пластины. При росте сотового ледебурита создается двухфазный фронт кристаллизации, продвижение которого в жидкость происходит благодаря диффузионному разделению жидкости перед фронтом растущей колонии . Диффузионное разделение жидкости оказывается возможным, в связи с установлением перед фронтом растущей двухфазной колонии не одинаковой равновесной концентрации жидкости в контакте с различными частицами кристаллизующихся фаз. Равновесные концентрации жидкости на межфазных границах L + γ и L + Fe3C в условиях переохлаждения описываются точками пересечения продолжений линий ликвидус с изотермой, соответствую- щей данной степени переохлаждения, соответственно, Сγ и Сц, где Сγ > Сц. В связи с этим в жидкости происходит разделительная диффузия, приводящая к установлению равновесных концентраций на всех межфазных границах перед фронтом растущей колонии. Такое установление равновесных концентраций происходит в результате взаимодействия растущих кристаллов с при- лежащими к ним тонкими слоями жидкости. При этом жидкость около аустенитного выступа получает равновесное содержание углерода Сγ более высокое по сравнению с жидкостью на межфазной границе с цементитом Сц (рис. 5.5). Направление диффузии железа перед фронтом растущей колонии Направление диффузии углерода перед фронтом растущей колонии Распределение равновесной концентрации углерода перед фронтом растущей колонии сотового ледебурита Аустенит Цементит Аустенит. Описание диффузионного разделения жидкости при росте сотовой колонии ледебурита Наличие градиентного распределение железа и углерода в жидкости является движущим фактором выравнивающей диффузии. В результате разницы концентраций углерод в жидкости непрерывно перемещается от аустенитных выступов к цементитным, обеспечивая рост последних. Железо же, наоборот, устремляется от цементитных выступов к аустенитным, также обеспечивая продольный рост аустенитных стержней. Колонии сотового ледебурита растут описанным образом в продольном и поперечном направлениях до столкновения с другими растущими колониями. Увеличение степени переохлаждения при кристаллизации эвтектики увеличивает термодинамический стимул превращения, в связи с чем образование зародышей той или иной фаз облегчается. Кроме того, исследуя диффузионные процессы, развитие которых при- водит к перемещению межфазных границ и зарождению чередующихся слоев разных фаз, составляющих эвтектику, при образовании эвтектических колоний, можно показать, что эти процессы зависят от интенсивности обмен- ной диффузии на межфазных границах и гомогенизирующей диффузии в жидкости. Первый процесс, например, при росте аустенитного зародыша приводит к перераспределению избыточного углерода, появляющегося при замене жидкого раствора, имеющего состав 4,3 % С, на аустенит, содержащий всего 2,14 % С, к границе раздела фаз γ-L, непрерывно обогащая жидкость в тон- ком слое около растущей аустенитной пластинки, создает в жидкости градиент концентрации между этим слоем и остальным объемом жидкости. Этот градиент концентрации углерода становится стимулом развития гомогенизирующей диффузии, стремящейся уменьшить концентрацию углерода в слое вблизи межфазной границы за счет перераспределения его в удаленные от границы объемы исходной жидкости, уменьшая вероятность образования цементитной пластинки на рассматриваемой границе. Интенсивность обменной диффузии на границе раздела фаз в связи с малой протяженностью диффузионных путей очень велика и практически не зависит от степени переохлаждения. Выравнивающая же диффузия есть диффузия на большие расстояния, в связи с чем она протекает тем интенсивнее, чем выше температура превращения (чем меньше степень переохлаждения). Поэтому длительность периода достижения флуктуации концентраций на межфазной границе γ–L, необходимой для появления зародыша частицы новой фазы (цементита), будет зависеть практически только от интенсивности выравнивающей диффузии в жидкости и, следовательно, от степени переохлаждения. При малой степени переохлаждения этот период оказывается значительным, и толщина первично растущей аустенитной частицы увеличивается. С увеличением степени переохлаждения длительность периода образования необходимой флуктуации уменьшается, что приводит к появлению зародыша новой (цементитной) пластинки в тот момент, когда растущая аусте- нитная пластинка имеет еще малую толщину. Чем больше степень переохла- ждения, тем более тонкими оказываются частицы в составе колонии, тем выше степень дисперсности образующейся эвтектической колонии. В доэвтектических и заэвтектических сплавах зарождение эвтектических колоний может начинаться на выпавших ранее из жидкости первичных кристаллах аустенита или цементита. В том и другом случае продолжение роста первичных кристаллов в условиях переохлаждения ниже эвтектической температуры приводит к появлению вокруг растущих кристаллов избыточных фаз тонкого слоя жидкости, обогащенной (или обедненной) по содержанию углерода, в которой в следующий момент времени формируется зародыш цементита (или, соответственно, аустенита), окружающий по всей поверхности первичные кристаллы. Первичные кристаллы теперь уже не могут далее расти, а образовавшийся слой новой фазы становится своеобразным зародышем эвтектических колоний. Зарождение и рост эвтектических колоний сотового ледебурита на этом слое происходит аналогично вышеописанному механизму при зарождении таких колоний на кристаллах пластинчатого ледебурита. Эвтектика. В сплавах нередко образуется структурная составляющая, получившая название эвтектика. Структуру, состоящую из определенного сочетания двух (или более) твердых фаз, одновременно кристаллизовавшихся из жидкого сплава, называется эвтектикой. Эвтектика состоит из двух и более фаз (твердых растворов α и β или твердого раствора α и химического соединения), имеющих форму пластинок, равномерно чередующихся между собой, которые образуют колонии. Иногда обе фазы в колониях непрерывно разветвлены одна в другой. Наряду с этой структурой в эвтектике могут присутствовать обособленные кристаллы α- и β-твердых растворов. Рассмотрим на примере сплавов системы свинец-сурьма (Pb-Sb). 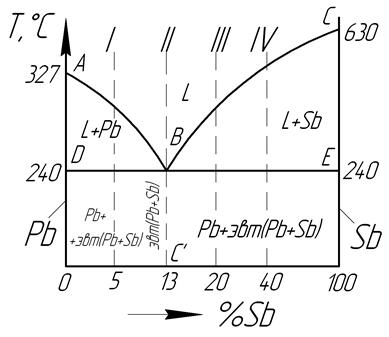 Характерной точкой этой диаграммы является тройная точка В, которой соответствует наиболее легкоплавкий (эвтектический сплав этой системы, имеющий в своем составе 13% Sb). Сплавы, содержащие менее 13% Sb, называются доэвтектическими, а содержащие более 13 % Sb –заэвтектическими сплавами. Структурными составляющими сплавов системы свинец–сурьма являются: 1) кристаллы Рb; 2) кристаллыSb; 3) кристаллы эвтектики эвт (Pb+Sb). В соответствии с диаграммой состояния структуры сплавов: I – Pb+эвт(Pb+Sb); II – эвт(Pb+Sb); III –Sb+эвт(Pb+Sb); IV – Sb+эвт(Pb+Sb). Различие структур III и IV сплавов состоит в том, что в IV сплаве больше кристаллов Sb, т. к. в этом сплаве избыток сурьмы над эвтектическим составом больше, чем в III сплаве. Пользуясь диаграммой состояния, можно для любой температуры определить не только число фаз, но и их состав и количественное соотношение. Для этого следует применить правило отрезков (правило рычага). Это правило может быть использовано для диаграмм, в которых сплавы находятся в двухфазном состоянии. Первое правило отрезков – определение состава фаз. Фазовое строение сплавов на диаграмме зависит от температуры. При термодинамическом воздействии компонентов друг на друга снижается температура их перехода в жидкое состояние, достигая некоторого минимума при определенном для каждой пары компонентов составе. Состав сплава можно определить, спроецировав точку С на ось абсцисс (точка В 3). Сплав двух компонентов, который плавится при минимальной температуре, называется эвтектическим или эвтектикой. Эвтектика является равномерной смесью одновременно закристаллизовавшихся мелких зерен обоих компонентов. Температура, при которой одновременно плавятся оба компонента, называется эвтектической температурой На диаграмме состояния температуры, выше которых сплавы находятся в жидком состоянии, лежат на линии АСВ, называемой линией ликвидуса. Переход сплавов из жидкого состояния в твердое при кристаллизации происходит в интервале температур, лежащих между линией ликвидуса и эвтектической температурой, которой соответствует линия солидуса DCE. При этом из каждого сплава по мере снижения температуры в твердую фазу переходит вначале тот компонент, количество которого превышает эвтектическую концентрацию. У доэвтектических сплавов двухфазная область АСD содержит избыточный компонент А и жидкую фазу Ж, а в заэвтектической области ВСЕ находятся соответственно твердая В и жидкая Ж фазы. В обоих случаях фаза Ж является жидким раствором обоих компонентов. По мере снижения температуры и приближения ее к составу не закристаллизовавшейся фазы приближается к эвтектическому При этом чем меньше сплав отличается по составу от эвтектического, тем ниже его точка ликвидуса, и тем больше в нем затвердевает эвтектики. Количественные изменения в сплавах данной системы компонентов при кристаллизации подчиняются правилу отрезков. Количество каждой структурной составляющей, от которого зависят свойства, может быть вычислено по правилу отрезков применительно к эвтектической температуре. При оценке прочностных свойств следует иметь в виду, что та часть сплава, которая представлена эвтектикой, имеет более высокую прочность, чем часть, представленная более крупными зернами избыточной фазы. Для определения состава фаз для сплава при различных температурах в точке п. Для этого через точку п, характеризующую состояние данного сплава при температуре tn, надо провести горизонтальную линию (коноду) 24б до пересечения с линиями диаграммы состояния, ограничивающими данную двухфазную область. Точки пересечения l2 и s2проектируют на ось концентраций. Проекция точки l2 точка l2 покажет состав жидкой фазы, а точки s2 – точка s2 – твердой фазы. Чтобы определить состав фаз при любой температуре, нужно через эту точку провести коноду и спроектировать точки пересечения с ликвидусом и солидусом на ось концентраций. Состав жидкой фазы изменяется по линии ликвидуса, а твердой – по линии солидуса. При температурах ниже линии солидуса фазовый состав всех сплавов рассматриваемой системы состоит из зерен обоих компонентов: А+В. Различают присутствующие в любом сплаве мелкие зерна А и В, составляющие эвтектику, и крупные зерна избыточных фаз – компонентов А или В соответственно в доэвтектических и заэвтектических сплавах. Пользуясь вторым положением правила отрезков, определяют количественное соотношение фаз для любой температуры. Количество (масса) фаз обратно пропорционально отрезкам проведенной коноды. Правило отрезков (рычага) позволяет определить состав и количество твердой и жидкой фаз сплава, находящегося в интервале кристаллизации. По диаграмме состояния можно определить не только число фаз конкретного сплава при данной температуре, но и относительное количество каждой фазы. Для определения количества фаз, например, сплава Pb – Sb, содержащего 72 % Sb, при заданной температуре необходимо провести перпендикуляр из точки на оси концентрации, соответствующей содержанию 72 % Sb, и горизонтальную линию, соответствующую заданной температуре tзад. В результате пересечения линий получим точку К. Горизонтальную линию, проходящую через точку К, продолжим до пересечения с линиями диаграммы, получим точки l и S. Точка l соответствует жидкой фазе сплава (лежит на линии ликвидуса), точка S-твердой фазе (лежит на оси температур чистой сурьмы). Эвтектическая точка Магнитные свойства направленно-закристаллизованной эвтектики зависят не только от физической природы фаз, но и от степени дисперсности магнитной составляющей, ее кристаллографической ориентации, формы и степени упорядоченности. Включения волокнистой эвтектики в силу небольшого их диаметра по сравнению с длиной можно рассматривать как одномерные, чего нельзя сказать о пластинчатых включениях, которые следует рассматривать как двумерные. Поэтому если для волокнистых эвтектик понятия вдоль и поперек волокон идентичны понятиям вдоль и поперек направления кристаллизации, то для пластинчатых эвтектик они будут идентичны только в том случае, если получается «эвтектический монокристалл», т. е. когда все пластины обеих фаз по всему объему образца будут параллельны друг другу, а образец в магнитном поле при снятии характеристик будет ориентирован так, что вектор поля будет перпендикулярен одновременно плоскостям всех пластин. В реальном же случае образец состоит из отдельных, хотя и очень крупных зерен. Пластины параллельны друг другу и направлению кристаллизации в пределах одного зерна, но не параллельны пластинам соседних зерен, как это хорошо видно на рис. 1, г. При снятии магнитных характеристик поперек направления кристаллизации могут встречаться зерна, в которых плоскости пластин как параллельны, так и перпендикулярны вектору поля. Этим, видимо, можно объяснить разброс экспериментальных данных при снятии характеристик в случае перпендикулярности магнитного поля направлению кристаллизации и более высокую анизотропию магнитных свойств волокнистых эвтектик. |
