ФизическаяХимия вар 9. Контрольная работа дисциплина (мдк)
 Скачать 0.92 Mb. Скачать 0.92 Mb.
|
|
Эвтектическая температура, температура эвтектики — температура, при которой эвтектический сплав в условиях стабильного равновесия затвердевает или плавится. Задача № 59 В баллоне со сжатым водородом вместимостью 10 л вследствие неисправного вентиля вытекает газ. При температуре 7 0С манометр показывает 50 атм. Через некоторое время, при температуре 17 0С манометр показывает такое же давление. Какая масса газа вытекает из баллона? 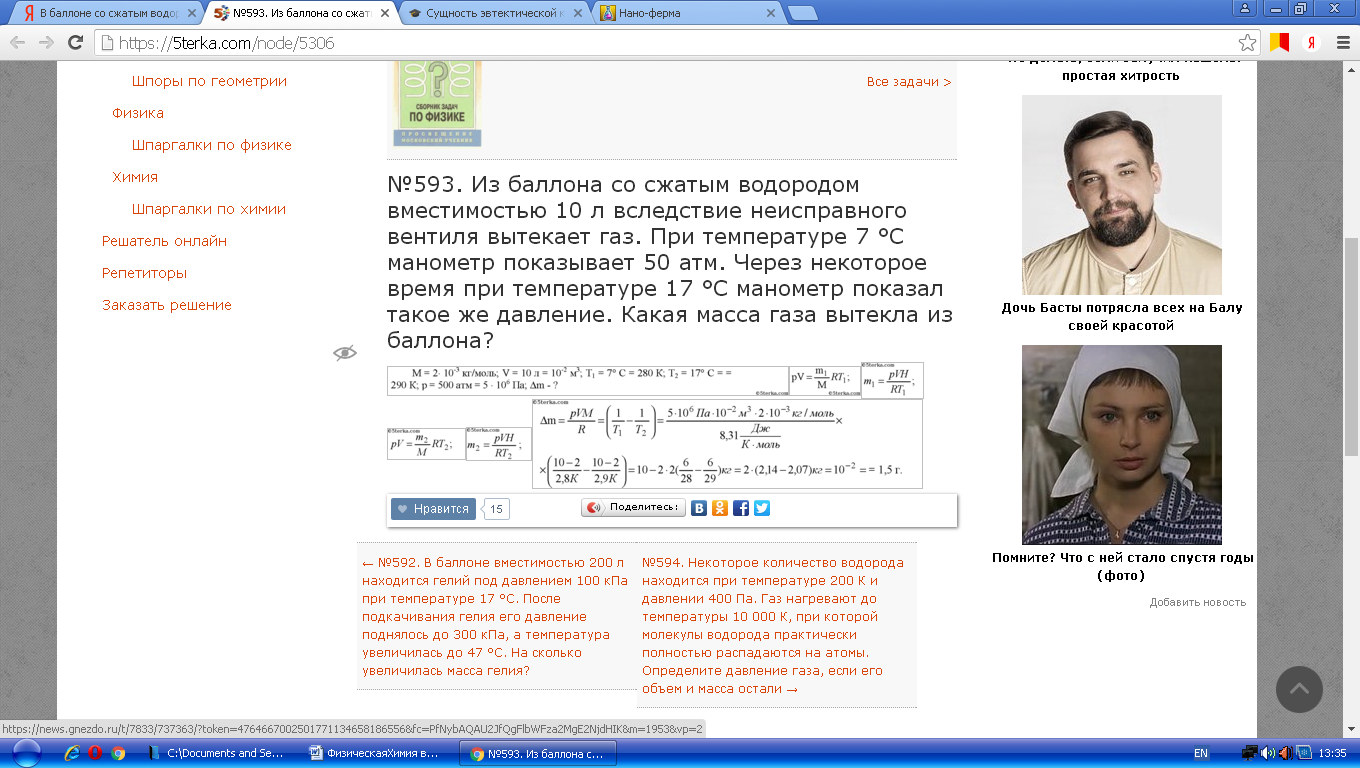 Задача № 69 Вычислите стандартное изменение энергии Гиббса химической реакции при 2500 С по стандартным значениям энтальпий образования и абсолютных энтропий, воспользовавшись таблицами стандартных величин. 69. PbS+2PbO = 3Pb+SO2 Исходя из значений стандартных теплот абразования и абсолютных стандартныз энтропий соответствующих веществ, вычислите энергию Гиббса реакции 2PbS(k) +302(r)=2PbO(k)+2SO2(r) Сделайте вывод о возможности протекания. Дополнен 6 лет назад Дельта Н Рb -94,28, G -92,68, S 91,2 PbO. Дельты H -217,86, G -188,49, S 67,4 O2 0, 0 S 205,3 SO2 дельта Н -296,9, дельта G -300,37, S 248,1 Задача 7. Вычислить изменение энергии Гиббса при 250С по стандартным значениям энтальпий образования и абсолютных энтропий для данной реакции: СО + 2Н2 = СН3ОН DН0обрСН3ОН = -293 кДж/моль S0(СН3ОН) = 127 Дж/моль×К DН0обрСО = - 110 кДж/моль. S0(CO) = 198 Дж/моль×К S0(H2) = 131 Дж/моль×К Решение: DG0 = DH0 - TDS0 DH0 = ånDH0обр. пр. реак. - ånDН0обр. исх. веществ DН0 = - 293 - (-110) = - 183 кДж/моль DS0 = å n S0 прод. р - å n S0 исход. веществ DS0 = 127 - (198 + 2(131) = - 333 Дж/моль×К DG0 = - 183,5 кДж/моль - (298К × 0,333 кДж/моль×К) = - 83,8 кДж/моль Ответ: DG0 = - 83,8 кДж/моль
Задача № 79 Найдите удельную теплоемкость: 79. алюминия Задача № 89 При нагревании оксида азота (IV) в закрытом сосуде до конкретной температуры, равновесия реакции 2NO2 = 2NO+O2 установилось при следующих условиях: [NО2]=0,06 моль/л, [NO]=0,24 моль/л; [O2]=0,12 моль/л. Вычислите константу равновесия при этой температуре и исходную концентрацию NO2. 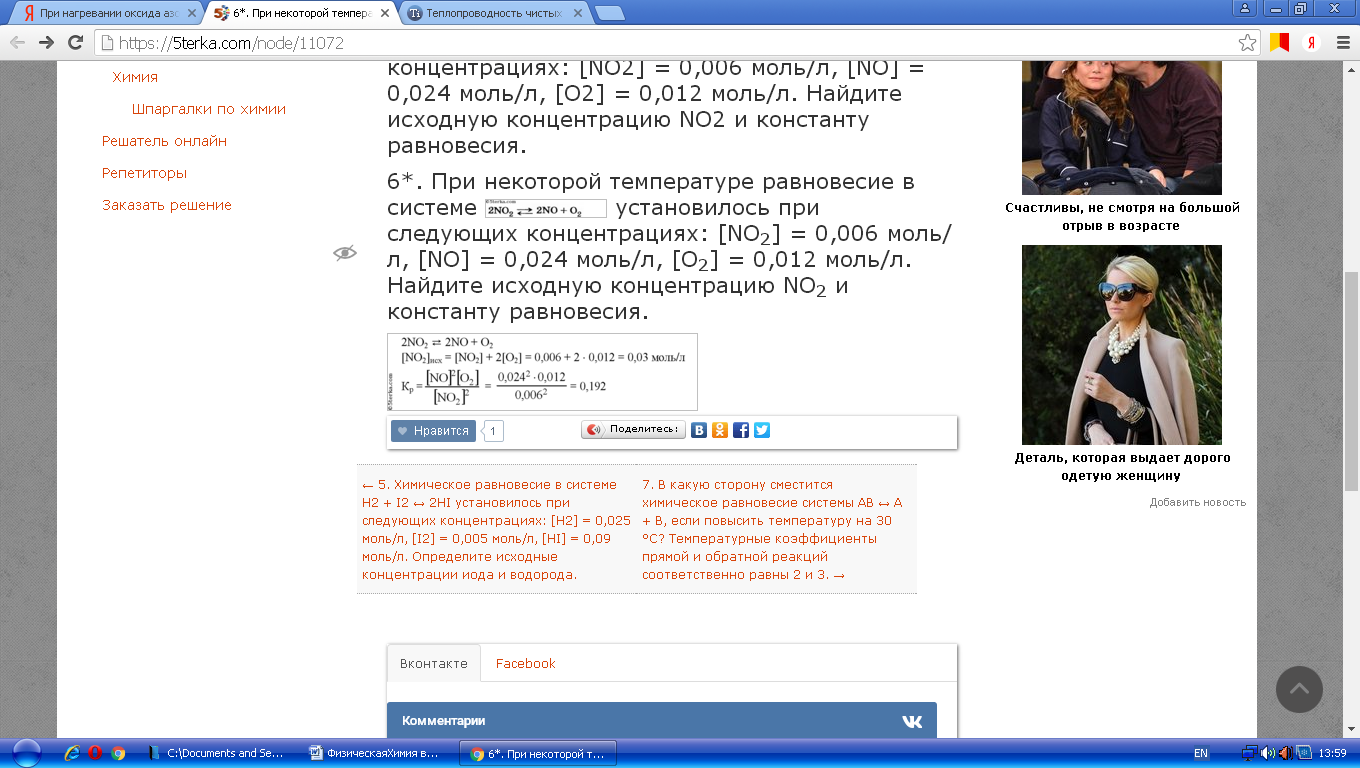 Задача № 99 Провести анализ предложенной диаграммы по плану:
99 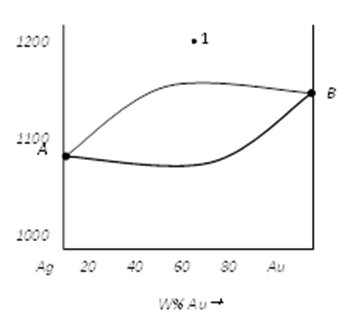 |
