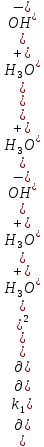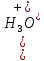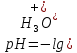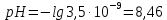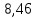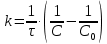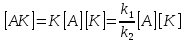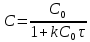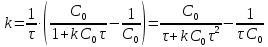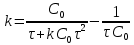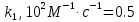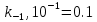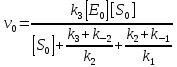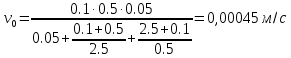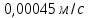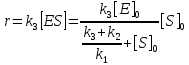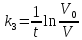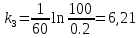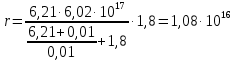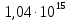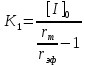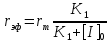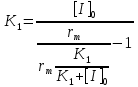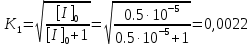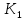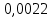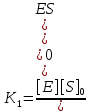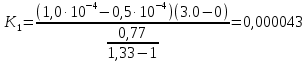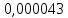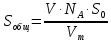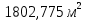Масленкова 9020. Контрольная работа по дисциплине "физическая химия" студент группы 9020 Масленкова Д. А. Проверил
 Скачать 81.19 Kb. Скачать 81.19 Kb.
|
|
РЯЗАНСКИЙ ГОСУДАРСТВЕННЫЙ РАДИОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ИМ. В.Ф. УТКИНА Кафедра химической технологии Контрольная работа по дисциплине "ФИЗИЧЕСКАЯ ХИМИЯ" Выполнил: студент группы 9020 Масленкова Д. А. Проверил: Логинов В. С. РЯЗАНЬ 2022 8 вариант Контрольная работа 1- Гомогенный катализ Задача 1. Кислотно-каталитическая реакция В Р протекает согласно механизму 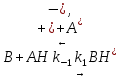 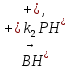 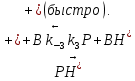 Определите зависимость наблюдаемой константы скорости реакции (kнабл) от кислотности среды h0, если скорость депротонизации вещества ВН+ больше, чем скорость его превращения в продукт. Рассчитайте значение kнабл.
Задача 2. Гидролиз уксусного ангидрида (CH3CO)2O катализируется как гидроксил-анионом OH–: (CH3CO)2O + OH– CH3COOH + CH3COO–, k1 M-1c-1, так и ионом гидроксония H3O+: (CH3CO)2O+H3O+→[(CH3CO)2H3O]+→ 2CH3COOH+H3O+. Эффективная константа кислотного гидролиза равна kэф M-1c-1. При каком рН водного раствора уксусный ангидрид будет наиболее устойчив?
Задача 3. Каталитическая реакция идёт по схеме 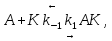 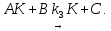 В двух опытах при следующих начальных концентрациях реагентов были получены приведённые в таблице значения времён превращения А на 50 % и 75 %. Найдите константы скорости k1, k2, k3. Концентрацию AK считать стационарной
Задача 4. (4.2.2.). Каталитическая реакция S1 + S2 →P1 + P2 протекает в присутствии слабой кислоты НА по механизму: 1) 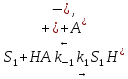 2) 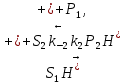 3) 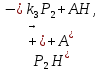 4) 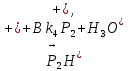 5) 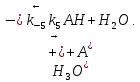 Известно, что реакция лимитируется стадиями депротонирования продукта реакции, а стадии (1), (2) и (5) являются быстрыми и равновесными. Каким общим или специфическим является катализ данной реакции кислотой HA, если: а) стадия (3) протекает значительно быстрее, чем стадия (4); б) стадия (4) протекает значительно быстрее, чем стадия (3). Ответ обоснуйте для обоих случаев. Решение: а) В данном случае, катализ будет специфическим основным, т.к. катализатором являются основания Аррениуса и лимитирующей стадией является вторая стадия распада S-. б) В данном случае, катализ будет специфическим кислотным, т.к. катализатором является кислоты Аррениуса и лимитирующей стадией является вторая стадия распада SH+. Контрольная работа 2 – Ферментативный катализ Часть 1 Задача 1. Получите кинетическое уравнение для процесса ферментативного катализа, в котором участвуют два промежуточных компонента: 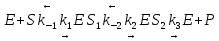 Решение: 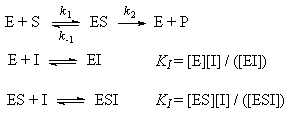 Задача 2. Каталитический процесс S P осуществляется по механизму: 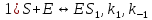 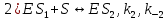 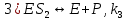 Определите скорость реакции в начальный момент времени (r0) при концентрации субстрата и фермента [S]0 и [E]0.
Задача 3. Реакция выделения водорода из воды под воздействием сильного восстановителя катионрадикала метилвиологена (S) катализируется ферментом гидрогеназой по схеме: 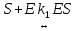 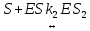 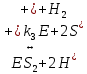 Напишите выражение для скорости выделения водорода и рассчитайте значение, найдите порядок реакции по S, E и Н+ при условии, что K1=K2, M-1, pHисх; [Е]0 мол-л*см–3; [S]0 М. Оцените константу k3, зная, что из 100 мл раствора за час выделилось V мл H2 (P = 760 мм рт. ст.).
Часть II. 1. При добавлении ингибитора в ферментативную систему, подчиняющуюся схеме Михаэлиса–Ментен, максимальная скорость реакции уменьшилась в x раз, а КМ не изменилась. Предложите схему ингибирования и рассчитайте К1, если концентрация ингибитора равнялась C моль⋅л-1.
2. Определить тип ингибирования, константу Михаэлиса, константу диссоциации комплекса фермент – ингибитор и величину предельной скорости в реакции окисления N-метилглутамата, катализируемой N─метилглутаматдегидрогеназой в присутствии ингибитора α-кетоглутарата по следующим данным: [I]0 = 0 и [I]0 = 3 ммоль⋅л-1.
3. Пара─нитроанилид N─бензоил─N─аргинина является одновременно и субстратом и ингибитором гидролиза, катализируемого протеалитическим ферментом бактериального происхождения. При избыточных концентрациях субстрата образуется неактивный комплекс фермента с двумя молекулами субстрата ES2. Используя экспериментальные данные, определите значения КМ, kкат и KS2.
Контрольная работа 3 – Гетерогенный катализ Задача 1. Вычислите площадь поверхности катализатора, 1 г которого при образовании монослоя адсорбирует V см3 газа А (при 1,01*105 Па и 273 К). Адсорбция измеряется при T К, эффективная площадь, занятая молекулой газа А равна S0.
Задача 2. Рассчитайте удельную поверхность катализатора, если адсорбция криптона при 77,5 К характеризуется следующими данными:
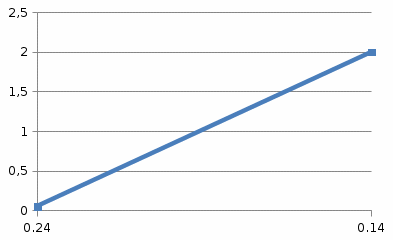
Масса катализатора 13,03 г. Площадь, занимаемая одной молекулой криптона, S0 = 19,2*10-20 м2, плотность криптона dо°с = = 3,739 г/л, давление насыщенного пара криптона Рs — 2,57 мм рт. ст. = 342,65 Па. Решение: Согласно уравнению изотермы адсорбции БЭТ, прямолинейная зависимость получается в координатах 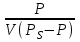 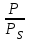 . .
На основании полученных данных строим график. Из графика находим тангенс угла наклона прямой: 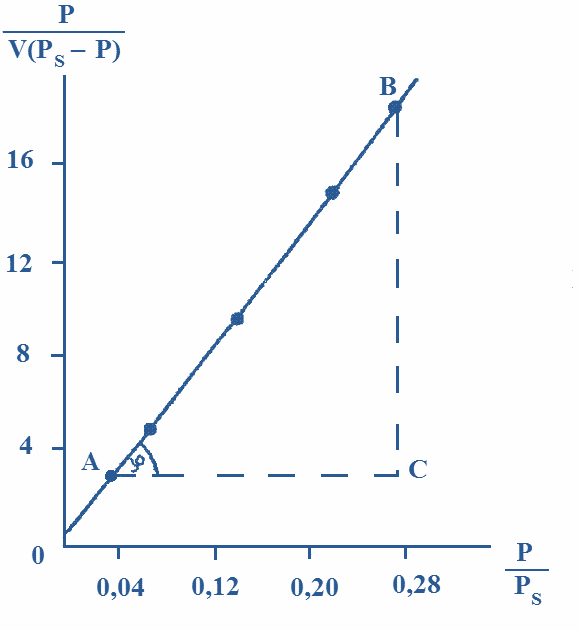 tg = 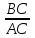 = = 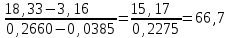 . (а) . (а)Отрезок, отсекаемый на оси ординат, равен 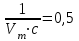 . (б) . (б)Решая совместно уравнения (а) и (б), получаем значения с = 134,4 и Vm = 0,0149 см3/г. Для пересчета Vm на Г воспользуемся формулой: Г = 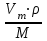 = = 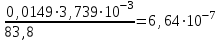 моль/г. моль/г.Удельную поверхность катализатора рассчитывают по уравнению: Sуд = ГNAS0 = 6,64 107 6,02 102319,2 1020 = 0,078 м2 Задача 3. При 77,5 К на платиновом катализаторе была снята изотерма адсорбции криптона. Получены данные:
Рассчитайте постоянные в уравнении БЭТ и удельную поверхность катализатора, если площадь, занимаемая одной молекулой криптона, SKr = 19,2*10-20 м2, плотность криптона dо°с = 3,739 г/л, давление насыщенного пара криптона Рs — 2,57 мм рт. ст. = 342,65 Па. Решение: Согласно уравнению изотермы адсорбции БЭТ, прямолинейная зависимость получается в координатах 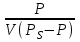 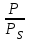 . .
На основании полученных данных строим график. Из графика находим тангенс угла наклона прямой:  tg = 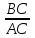 = = 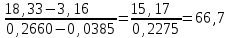 . (а) . (а)Отрезок, отсекаемый на оси ординат, равен 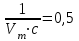 . (б) . (б)Решая совместно уравнения (а) и (б), получаем значения с = 134,4 и Vm = 0,0149 см3/г. Для пересчета Vm на Г воспользуемся формулой: Г = 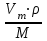 = = 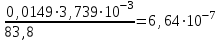 моль/г. моль/г.Удельную поверхность катализатора рассчитывают по уравнению: Sуд = ГNAS0 = 6,62 107 6,02 102319,2 1020 = 0,075 м2 задача 4. Каталитическое окисление CO на однородной поверхности Pd протекает следующим образом: 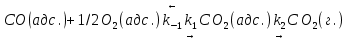 Равновесие на поверхности устанавливается быстро. Вторая стадия – медленная. Используя уравнение Ленгмюра для многокомпонентной адсорбции (23.22), выведите формулу для зависимости скорости реакции образования газообразного CO2 от парциальных давлений всех участников реакции. Решение: Скорость реакции образования газообразного CO2 равна скорости самой медленной, последней ее стадии: 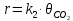 На первой стадии – обратимого окисления CO – скорость прямой реакции равна скорости обратной: 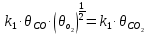 Отсюда можно найти долю центров, занятых CO2, и подставить в уравнение (1): 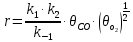 Осталось выразить доли занятых центров через парциальные давления. В случае смеси газов доля адсорбционных центров, занятых молекулами i-го газа, описывается модифицированным уравнением Лэнгмюра: 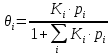 (суммирование в знаменателе проводится по всем газам, находящимся в смеси). Записав соответствующие уравнения для CO и O2 и подставив их в формулу (2), находим зависимость скорости реакции от парциальных давлений всех участников реакции (в том числе и CO2): 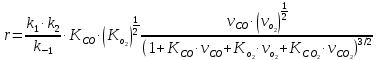 Ответ: 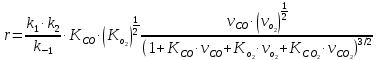 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

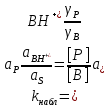
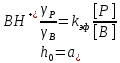
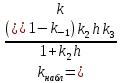
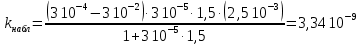
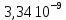
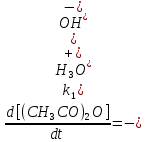 Минимум скорости гидролиза, как легко видеть, соответствует минимуму выражения:
Минимум скорости гидролиза, как легко видеть, соответствует минимуму выражения: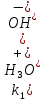 Продифференцируем его по
Продифференцируем его по 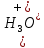 , учитывая, что
, учитывая, что 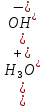 :
: