КР Физиология растений. Контрольная работа по дисциплине Физиология растений
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования Новосибирский государственный аграрный университет Томский сельскохозяйственный институт – филиал Кафедра агрономии, технологии производства и переработки сельскохозяйственной продукции Направление подготовки: 06.03.01 Биология Контрольная работа по дисциплине «Физиология растений»
Томск 2022 СодержаниеВопрос № 4 Физиологическая роль основных клеточных органелл 3 Вопрос № 23 Классификация ферментов. Ферменты класса гидролаз 5 Вопрос № 36 Условия, необходимые растению для нормального водообмена. Физиологические особенности засухоустойчивых растений 11 Вопрос № 51 Причины движения устьичных клеток. Фотоактивная, гидроактивная и гидропассивпая реакция устьиц 13 Вопрос № 68 Биосинтез углеводов, ферменты углеводного обмена. Различия между ассимиляционным и запасным крахмалом 16 Вопрос № 83 Современное учение о химизме дыхания. Суть анаэробной фазы дыхания 21 Вопрос № 100 Зависимость дыхания растительных тканей от температуры, влажности, газового состава воздуха и других факторов среды 24 Список использованных источников 28 Вопрос № 4 Физиологическая роль основных клеточных органеллПомимо репликации генетического материала, ядро выполняет ещё одну важную функцию — контроль за синтезом белка в клетке. У большинства растительных клеток имеется одно ядро диаметром около 10 мкм. Внутреннее содержимое ядра (нуклеоплазма) ограничено двумя элементарными мембранами — внутренней и наружной, между которыми находится перинуклеарное пространство. Ядерная оболочка пронизана порами, через которые транспортируются нуклеиновые кислоты и белки. Ядерная пора не является простым отверстием, а представляет собой сложную структуру, проницаемую только для определённых веществ. Обе мембраны ядерной оболочки отличаются по структуре, свойствам и функциям. К внутренней мембране на всем её протяжении примыкает слой конденсированного хроматина (гетерохроматина). Наружная мембрана связана с элементами эндоплазматического ретикулума, и сторона её, обращённая к цитоплазме, несёт рибосомы [3, с. 24]. В нуклеоплазме находится хроматин, представляющий собой комплекс нуклеиновых кислот и белков, весь набор ферментов и кофакторов, необходимый для экспрессии генов и репликации ДНК, а также различные РНК. В делящихся клетках хроматин организуется в хромосомы, число которых специфично для каждого вида растений. В некоторых растительных клетках может происходить многократная репликация ДНК, в результате чего образуется полиплоидный набор хромосом. У многих диплоидных видов растений ядро содержит два ядрышка – по одному на каждый гаплоидный набор хромосом. Ядрышко не имеет ограничивающей мембраны. Это плотное тельце, состоящее из рибонуклеопротеинов — предшественников рибосом. Оно формируется на участке хроматина, кодирующем рРНК, который называется ядрышковым организатором. Рибосомы – место синтеза (трансляции) белков из отдельных аминокислот. Рибосомы (и комплекс Гольджи) были открыты с помощью метода электронной микроскопии Нобелевским лауреатом Джорджем Пал аде (G. Palade). Они содержат почти одинаковое количество белков и РНК. Каждая рибосома состоит из двух нуклеопротеиновых субъединиц, которые удерживаются вместе ионами Mg2+. Рибосомы и их субъединицы обозначают по величине константы седиментации, которую выражают в сведбергах (1 S = 10-13с). Две субъединицы рибосом (малая – 40 S и большая – 60 S), образованные в ядрышке, поступают в цитоплазму, где происходит их сборка на молекуле мРНК. Большая субъединица содержит по одной молекуле 25 S РНК, 5,8 S РНК, 5 S РНК и 44 - 45 молекул белков. Малая субъединица состоит из одной 18 S РНК и 32-40 молекул белков [5, с. 43]. Имеются рибосомы цитоплазмы и, отличные от них, рибосомы органелл. В цитоплазме растительных клеток находятся 80 S рибосомы, в хлоропластах — 70 S рибосомы, а в митохондриях 78-80 S рибосомы. При синтезе белка рибосомы часто объединяются в полирибосомы (полисомы). Полисомы могут находиться в свободном состоянии в цитоплазме и быть связанными мембранами эндоплазматического ретикулума или наружной ядерной мембраной. Аминокислоты, из которых синтезируются белки, переносятся к полирибосомам растворимой, или транспортной, РНК. Вопрос № 23 Классификация ферментов. Ферменты класса гидролазНа собрании V Международного биохимического союза, прошедшем в Москве в 1961 году, была принята современная классификация ферментов. Данная классификация подразумевает их деление на классы, в зависимости от типа реакции, в которой энзим выступает катализатором. Кроме того, каждый класс ферментов делится на подклассы. Для их обозначения используется код из четырех чисел, разделенных точками [1, с. 18]: – первое число обозначает механизм реакции, в которой фермент выступает катализатором; – второе число указывает на подкласс, к которому принадлежит данный энзим; – третье число – подкласс описываемого фермента; – четвертое – порядковый номер энзима в подклассе, к которому он принадлежит. Всего в современной классификации ферментов выделяют шесть их классов (рис. 1).  Рисунок 1 – Классификация ферментов 1. Оксидоредуктазы – энзимы, выступающие катализаторами в различных окислительно-восстановительных реакциях, происходящих в клетках. В данный класс входит 22 подкласса. 2. Трансферазы – класс ферментов с 9 подклассами. В него входят энзимы, обеспечивающие реакции транспорта между разными субстратами, ферменты, принимающие участие в реакциях взаимопревращения веществ, а также обезвреживания различных органических соединений. 3. Гидролазы – энзимы, разрывающие внутримолекулярные связи субстрата посредством присоединения к нему молекул воды. В данном классе насчитывается 13 подклассов. 4. Лиазы – класс, в составе которого находятся только сложные ферменты. В нем насчитывается семь подклассов. Энзимы, относящиеся к данному классу, выступают катализаторами в реакциях разрыва С-О, С-С, С-N и прочих типов органических связей. Также ферменты класса лиазы участвуют в обратимых биохимических реакциях отщепления негидролитическим путем. 5. Изомеразы – энзимы, выступающие катализаторами в химических процессах изомерных превращений, происходящих в одной молекуле. Как и к предыдущему классу к ним относятся только сложные ферменты. 6. Лигазы, иначе именуемые синтетазами – класс, включающий шесть подклассов и представляющий энзимы, катализирующие процесс соединения двух молекул под воздействием АТФ. Гидролазы – класс объединяющий ферменты микробов и других живых организмов, являющихся катализаторами реакций расщепления и синтеза белков, жиров и полисахаридов с участие воды [5, с. 37]. Гидролазы, как и другие ферменты микроорганизмов, синтезируются бактериальной клеткой. Многие гидролазы способны действовать в изолированном от клетки положении. Это имеет огромное практическое значение. Как и другие ферменты, гидролазы, неустойчивы к тепловому воздействию и характеризуются высокой специфичностью действия. К классу гидролаз относят [6, с. 19]: – протеолитические ферменты (пептидгидролазы) – действуют на белки или пептиды; – гидролазы глюкозидов – осуществляют каталитическое расщепление углеводов и глюкозидов; – липотические эстразы – катализируют расщепление и синтез сложных эфиров (липазы, фосфатазы). Идентификацию бактерий проводят путем изучения ферментов, катализирующих расщепление углеводов и белков. Способность бактерий расщеплять углеводы называют сахаролитическойактивностью. Способность бактерий расщеплять белки называют протеолитическойактивностью. Оба признака выявляют по конечным продуктам расщепления субстратов после посева культуры на питательные среды. При ферментации сахаров выявляется образование различных кислот: молочной, уксусной, муравьиной, или кислоты и газа (водорода или углекислоты). При распаде белков – образование сероводорода, щелочей, аммиака, индола. Гликозидазы выявляют с помощью жидких и полужидких сред Гисса (рис. 2). Жидкие среды Гисса – это пептонная вода, содержащая один из углеводородов (лактоза, глюкоза, мальтоза, сахароза) и индикатор Андреде (кислый фуксин (солянокислый розанилин) C20H20N3Cl, обесцвеченный щелочью). Для улавливания газов в пробирке размещают поплавок (микропробирка вверх дном). Поплавок при стерилизации заполняется средой. Исходный цвет среды является соломенно-желтым. При расщеплении углеводорода до кислоты наблюдается изменение цвета среды на красный. Одновременное образование газа приводит к его накоплению в поплавке. При отсутствии реакции расщепления углеводорода цвет среды не меняется. 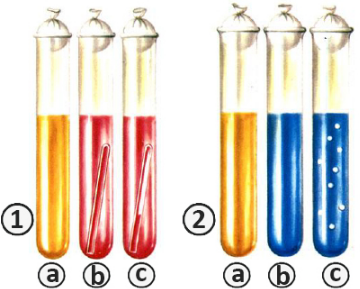 Рисунок 2 – Выявления гликозидаз с помощью сред Гисса 1. Жидкая среда Гисса: a. Исходная среда; b. Разложение углевода до кислоты; c. Разложение углевода до кислоты и газа. 2. Полужидкая среда Гисса: a. Исходная среда; b. Разложение углевода до кислоты; c. Разложение углевода до кислоты и газа Полужидкие среды Гисса содержат 0,2%–0,5% мясо-пептонного агара, 1% углеводов и индикатоа ВР (вводно-голубая краска, рзоловая кислота). Исходный цвет среды – розово-серый. При расщеплении углевода среда меняет цвет на голубой. Образование газа приводит к разрывам в среде или появлению пузырьков газа. Установлено, что каждый вид бактерий ферментирует только определенный спектр углеводов. В связи с этим в одних пробирках среда меняет свой цвет, а в других остается не изменой. В результате наблюдается так называемый «пестрый ряд». Таким образом, для каждого вида бактерии характерен свой «пестрый ряд». Это позволяет отличать виды бактерий друг от друга [3, с. 36]. Выявление протеаз Протеазы бактерий выявляют посевом чистой культуры на питательные среды: МПЖ (мясопептонный желатин), молочный агар, МПБ (мясопептонный бульон). Результат оценивают исходя из разжижения желатина, разложения козеина молока вокруг колоний или по конечным продуктам распада белков (рис. 3).  Рисунок 3 – Реакция питательных сред на воздействие протеаз бактерий 1. Формы разжижения желатина; 2. Разложение козеина молока; 3. Тест на индол с помощью индикаторных полосок (а) и при помощи реактива Ковача (б); 4. Тест на сероводород: а – положительный тест; б – контроль Отмечается, что различные виды бактерий характеризуются разной формой разжижения желатина. В частности, золотистый стафилококк разжижает желатин в форме воронки, а холерный вибрион – в форме гвоздя [2, с. 29]. Протеолиз казеина проявляется образованием зон просветления, из-за разложения последнего, вокруг бактериальных колоний. Конечные продукты распада белков различны. В зависимости от вида бактерий это может быть идол, сероводород, аммиак. Обнаружение данных продуктов производят при помощи индикаторных бумажек. Их помещают внутрь пробирки между стенкой и ватно-марлевой пробкой. Индикатор на идол – щавелевая кислота. Пропитанная щавелевой кислотой бумажка при выделении идола становится розовой. Часто тестирование бактериальных культур на образование идола проводиться при помощи реактива Ковача или реактива Эрлиха. Сероводород обнаруживают при помощи ацетата свинца. При выделении сероводорода белый цвет бумажки меняется на черный из-за образования сульфита свинца. Аммиак обнаруживают при помощи лакмусовой бумаги. При выделении аммиака она приобретает синий цвет. Вопрос № 36 Условия, необходимые растению для нормального водообмена. Физиологические особенности засухоустойчивых растенийДля растений необходимо, чтобы осадки относительно равномерно распределялись в период активного роста. Под засухой понимают режим погоды, характеризующийся отсутствием осадков, повышением температуры воздуха и падением относительной влажности воздуха. Различают два типа засухи - атмосферную и почвенную. Следует подчеркнуть, что засуха, за очень редким исключением, всегда начинается как атмосферная засуха, переходя затем в почвенную. В то же время атмосферная засуха может быть и при отсутствии почвенной, когда она проявляется в виде горячего ветра-суховея. Вред от суховея наблюдается и тогда, когда в почве еще имеются значительные запасы воды [1, с. 15]. Если в почве имеется недостаточное количество доступной для растения воды, то отрицательное влияние перегрева становится особенно сильным. Перегрев вызывает повреждение растения, называемое запалом. Запал обнаруживается через некоторое время в виде различно окрашенных некротических пятен на листьях. На пшенице появляются желтые пятна, на овсе - красные, у большинства растений - коричневые. Встречается и другой вид повреждений от атмосферной засухи - захват. Он наблюдается реже, чем запал, и проявляется в том случае, когда при сравнительно не очень высоких температурах наблюдаются сильный ветер и большая сухость воздуха. Недостаток воды в тканях растений (водный дефицит) может возникнуть в жаркую солнечную погоду к середине дня, при этом увеличивается сосущая сила листьев, что активирует поступление воды из почвы. Растение регулирует уровень водного дефицита открытием или закрытием устьиц. В этот период происходит временное завядание листьев. Обычно в вечерние и утренние часы это явление устраняется. Отсутствие в почве доступной для растения воды приводит к глубокому завяданию. Это завядание чаще всего приводит к гибели растения. Характерным признаком устойчивого водного дефицита является сохранение его в тканях утром, прекращение выделения пасоки из срезанного стебля. Действие засухи приводит в первую очередь к уменьшению в клетках свободной воды, что нарушает гидратные оболочки белков цитоплазмы и сказывается на функции белков-ферментов. Приспособление растений к засухе. Известно, что растения неодинаково реагируют на перегрев и обезвоживание в разные периоды онтогенеза. У каждого вида в онтогенезе имеется такой период, когда недостаток воды резко сказывается на течении всех физиологических процессов, этот период называется критическим периодом. Из этого, однако, не следует, что остальные периоды своего развития растение не нуждается в воде и не страдает от ее недостатка. Установлено, что вязкость цитоплазмы, ее эластичность в критический период резко падают, что и является одним из условий высокой чувствительности растений к перегреву и обезвоживанию в этот период развития. В критический период происходят интенсивные ростовые процессы и образование новых органов – цветков [3, с. 56]. Засухоустойчивые сорта при значительном водном дефиците характеризуются синтетической направленностью в работе своих ферментов, тогда как у менее засухоустойчивых преобладает гидролитическая направленность. Засухоустойчивые сорта озимой пшеницы характеризуются большим содержанием связанной воды, которая трудно обменивается во время засухи, повышенной концентрацией клеточного сока в период цветения и налива зерна, высшим порогом коагуляции белков, более интенсивным накоплением сухого вещества зерна, более стойкой к неблагоприятным условиям пигментной системой. Этим и характеризуется физиологическая природа засухоустойчивости растений. Вопрос № 51 Причины движения устьичных клеток. Фотоактивная, гидроактивная и гидропассивпая реакция устьицРазличают три типа реакций устьичного аппарата на условия среды [4, с. 11]: 1. Гидропассивная реакция — это закрывание устьичных щелей, вызванное тем, что окружающие паренхимные клетки переполнены водой и механически сдавливают замыкающие клетки. В результате сдавливания устьица не могут открыться и устьичная щель не образуется. Гидропассивные движения обычно наблюдаются после сильных поливов и могут служить причиной торможения процесса фотосинтеза. 2. Гидроактивная реакция открывания и закрывания – это движения, вызванные изменением в содержании воды в замыкающих клетках устьиц. 3. Фотоактивная реакция. Фотоактивные движения проявляются в открывании устьиц на свету и закрывании в темноте. Особенное значение имеют красные и синие лучи, которые наиболее эффективны в процессе фотосинтеза. Это имеет большое приспособительное значение, т. к. благодаря открытию устьиц на свету к хлоропластам диффундирует С02, необходимый для фотосинтеза. Механизм фотоактивных движений устьиц не является вполне ясным. Свет оказывает косвенное влияние через изменение концентрации С02 в замыкающих клетках устьиц. Если концентрация С02 в межклетниках падает ниже определенной величины (эта величина зависит от вида растений), устьица открываются. При повышении концентрации С02 устьица закрываются. В замыкающих клетках устьиц всегда имеются хлоропласты и происходит фотосинтез. На свету С02 ассимилируется в процессе фотосинтеза, содержание ее падает. Согласно гипотезе канадского физиолога У. Скарса, С02 оказывает влияние на степень открытости устьиц через изменение рН в замыкающих клетках. Уменьшение содержания С02 приводит к повышению значения рН (сдвигу в щелочную сторону). Напротив, темнота вызывает повышение содержания С02 (вследствие того, что С02 выделяется при дыхании и не используется в процессе фотосинтеза) и снижение значения рН (сдвиг в кислую сторону). Изменение значения рН приводит к изменению активности ферментных систем. В частности, смещение значения рН в щелочную сторону увеличивает активность ферментов, участвующих в распаде крахмала, тогда как сдвиг в кислую сторону повышает активность ферментов, участвующих в синтезе крахмала [6, с. 24]. Распад крахмала на сахара вызывает увеличение концентрации растворенных веществ, в связи с этим осмотический потенциал и, как следствие, водный потенциал становятся более отрицательными. В замыкающие клетки начинает интенсивно поступать вода из окружающих паренхимных клеток. Устьица открываются. Противоположные изменения происходят, когда процессы сдвигаются в сторону синтеза крахмала. Однако это не единственное объяснение. Показано, что замыкающие клетки устьиц содержат значительно больше калия на свету по сравнению с темнотой. Установлено, что количество калия в замыкающих клетках при открытии устьиц повышается в 4-20 раз при одновременном уменьшении этого показателя в сопутствующих клетках. Происходит как бы перераспределение калия. При открытии устьиц возникает значительный градиент мембранного потенциала между замыкающими и сопутствующими клетками. Добавление АТФ к эпидермису, плавающему на растворе КСI, увеличивает скорость открытия устьиц на свету. Показано также возрастание содержания АТФ в замыкающих клетках устьиц в процессе их открывания. Можно полагать, что АТФ, образованная в процессе фотосинтетического фосфорилирования в замыкающих клетках, используется для усиления поступления калия. Это связано с деятельностью Н+-АТФазы. Активизация Н+-насоса способствует выходу Н+ из замыкающих клеток. Это приводит к транспорту по электрическому градиенту К+ в цитоплазму, а затем в вакуоль. Усиленное поступление К+, в свою очередь, способствует транспорту Сl- по электрохимическому градиенту. Осмотическая концентрация возрастает. В других случаях поступление К+ уравновешивается не Сl-, а солями яблочной кислоты (манатами), которые образуются в клетке в ответ на снижение значения рН в результате выхода Н+. Накопление осмотически активных веществ в вакуоли (К+,Сl-, малаты) снижает осмотический, а затем и водный потенциал замыкающих клеток устьиц. Вода поступает в вакуоль, и устьица открываются. В темноте К+ транспортируется из замыкающих в окружающие клетки и устьяца закрываются. Указанные процессы представленны в виде схем: Движения устьиц регулируются гормонами растений (фитогормонами). Открывание устьиц предупреждается, а закрывание стимулируется фитогормоном – абсцизовой кислотой (АБК). Интересно в связи с этим, что АБК тормозит синтез ферментов, участвующих в распаде крахмала. Имеются данные, что под влиянием абсцизовой кислоты содержание АТФ падает. Вместе с тем АБК уменьшает поступление К+, возможно, за счет уменьшения выхода ионов Н+ (торможение Н+-помпы). Обсуждается роль других фитогормонов – цитокининов в регуляции открывания устьиц путем усиления транспорта К+ в замыкающие клетки устьиц и активизации Н+-АТ Фазы. Движение устьичных клеток оказалось зависимым от температуры [5, с. 13]. При исследовании ряда растений показано, что при температуре ниже 0°С устьица не открываются. Повышение температуры выше 30°С вызывает закрытие устьиц. Возможно, это связано с повышением концентрации С02 в результате увеличения интенсивности дыхания. Вместе с тем имеются наблюдения, что у разных сортов пшеницы реакция устьиц на повышенную температуру различна. Вопрос № 68 Биосинтез углеводов, ферменты углеводного обмена. Различия между ассимиляционным и запасным крахмаломВ растениях в процессе фотосинтеза образуются не только фосфорные эфиры сахаров или простые сахара, но и более сложные формы углеводов – сахароза, крахмал, клетчатка. Распад сложных форм углеводов до простых протекает тоже очень быстро. Это наблюдается, например, при прорастании семян, старении вегетативных органов и др. Образующиеся при распаде простые сахара или их фосфорные эфиры оттекают в репродуктивные органы, где из них вновь синтезируются сложные углеводы. И, наконец, в растениях очень легко идут процессы взаимных превращений углеводов [6, с. 24]. Взаимопревращение моносахаридов проходит через фосфорные эфиры сахаров или их уридиндифосфатпроизводные (УДФ-производные). УДФ-производные сахаров представляют собой тот или иной сахар, соединенный через два остатка фосфорной кислоты с уридином, например: 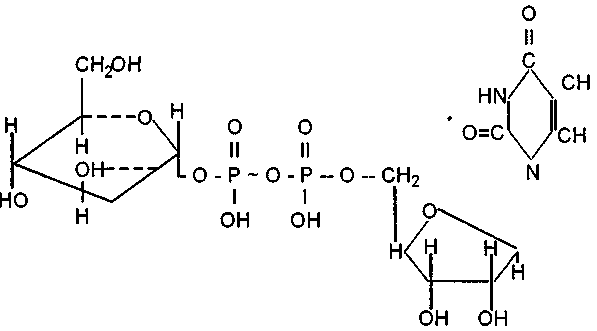 Рисунок 4 – Уридиндифосфатглюкоза Примеры взаимных превращений сахаров могут быть представлены в виде следующей схемы. Схема взаимопревращений сахаров
Синтез сахарозы. Сахароза наиболее распространенный дисахарид. В растениях он образуется из глюкозы и фруктозы. На первом этапе идетфосфорилирование глюкозы: Глюкоза + АТФ → глюкоза-6-фосфат + АДФ, затем глюкозо-6-фосфат изолируется в глюкозо-1-фосфат. Глюкозо-1-фосфат соединяется с УТФ, в результате чего отщепляется пирофосфатная кислота и образуется соединение глюкозы с уридиндифосфорной кислотой (УДФ) – уридиндифосфатглюкоза. Одновременно идет фосфорилирование фруктозы под действием фермента фруктокиназы с участием АТФ: фруктоза + АТФ → фруктозо-6-фосфат + АДФ. После этого происходит взаимодействие УДФ-глюкозы с фруктозо-6-фосфатом с участием фермента сахарозофосфат-УДФ-глюкозилтрансферазы. Наконец, образовавшийся сахарозо-6-фосфат под действием фермента фосфатазы гидролизуется с образованием свободной сахарозы. Таким образом, для биосинтеза одной молекулы сахарозы необходимы 3 макроэргические фосфатные связи, эта реакция необратима. В нефотосинтезирующих тканях некоторых растений, например, в корнеплодах сахарной свеклы, клубнях картофеля и других сахароза может образоваться из свободной фруктозы: УДФ-глюкоза + фруктоза ↔ сахароза + УДФ. Реакция катализируется ферментом сахарозо-УДФ-глюкозилтрансферазой и в зависимости от условий может быть направлена как в сторону синтеза, так и в сторону расщепления сахарозы. Синтез крахмала. Крахмал состоит из амилозы, представляющей собой неразветвленную цепь остатков ос-глюкозы, соединенных α(1-4)-связями, и амилопектина — разветвленной молекулы, в которой наряду с α(1-4)- имеются и α(1-6)-связи. В строении этих двух сахаров, входящих в крахмал, имеются существенные различия, поэтому механизмы их биосинтеза различны. Донором глюкозных остатков при биосинтезе амилозы может служить уридиндифосфатглюкоза-(УДФК). Для ее образования в реакционной среде необходимо наличие затравки, в качестве которой могут служить полисахариды, построенные всего лишь из 3—4 остатков глюкозы, соединенных α(1-4)-связями. Остатки глюкозы переносятся на акцептор (затравку), где и происходит удлинение цепи. Реакция идет по схеме: УДФГ + акцептор (Г)к —— УДФ + акцептор (Г)к + 1, где Г — остатки глюкозы. Фермент, катализирующий эту реакцию, называется УДФГ-крахмалглюкозилтрансферазой. У большинства растений активным донором глюкозы является не УДФ-глюкоза, а аденозиндифосфатглкжозα(АДФГ). Реакция присоединения глюкозных остатков от АДФГ к низкомолекулярному акцептору идет аналогичным путем и катализируется ферментом АДФГ-крахмал-глюкозилтрансферазой. Синтез разветвленной молекулы амилопектина, имеющей α (1-6)-связи, происходит при помощи фермента α-глюкантрансферазы (Q-фермент). В синтезе крахмала участвуют и Д-фермент или глюкозилтрансфераза, образующий α(1-4)-связи и участвующий в образовании затравки. Распад крахмала происходит при участии двух процессов - гидролиза и фосфоролиза. Гидролитический распад крахмала осуществляется под действием четырех ферментов класса гидролиз α-амилаза, катализирует расщепление α(1-4)-связи, причем связи разрываются беспорядочно. Конечный продукт такого распада – мальтоза, глюкоза, декстрины. Под действием β-амилазы происходит расщепление α (1-4)-связей с образованием остатков мальтозы. Фермент глюкоамилазы катализирует последовательное отщепление остатков глюкозы от молекулы крахмала. Фосфоролиз – это присоединение фосфорной кислоты по месту разрыва глюкозидной связи между остатками моносахаридов в цепи полисахарида, при этом происходит образование глюкозо-1-фосфата. Эта реакция катализируется ферментомаглюконфосфорилазой, относящимся к классу трансфераз. Крахмал в растении может подвергаться очень быстрому распаду, так как ферменты распада находятся во всех органах растения. Синтез целлюлозы. Целлюлоза построена из остатков β-глюкозы. В биосинтезе целлюлозы принимает участие не свободная глюкоза. ГДФ — глюкоза + (глюкоза) к→ ГДФ + (глюкоза)к + 1 Распад целлюлозы идет преимущественно гидролитическим путем под действием фермента целлюлазы до дисахарида целлобиозы. Транспорт углеводов осуществляется в виде сахарозы. В процессе фотосинтеза образуется много углеводов, и в этой связи большое значение имеет отток ассимилятов в другие части клетки из хлоропластов. Проникновение через мембрану хлоропластов фосфорилированных гексоз и сахарозы затруднено, наиболее легко через мембраны хлоропластов проникают триозофосфаты (ФГА и ФДА). Предполагается, что образующиеся сложные углеводы распадаются на триозофосфаты и в таком виде передвигаются в цитоплазму, где могут служить материалом для ресинтеза гексоз, сахарозы, крахмала [1, с. 43]. Межклеточный паренхимный транспорт осуществляется двумя путями – по плазмодесмам (симпласту) или по свободному пространству (аппопласту). Сахароза, образовавшаяся в клетках мезофилла листа, десорбируется в аппопласт. Выходя из паренхимных клеток в аппопласт, сахароза расщепляется инвертазой на гексозы. Гексозы передвигаются по аппопласту к передаточным клеткам проводящих пучков по градиенту концентраций. При соприкосновении с передаточными клетками флоэмы они снова превращаются в сахарозу. Далее происходит загрузка ситовидных трубок, сахароза поступает против градиента концентраций, и требуется расход энергии (АТФ). Предполагается, что сахароза преодолевает мембрану с помощью переносчика в комплексе с протоном. При этом благодаря работе Н+-АТФ-азы ионы Н+ выкачиваются из клеток флоэмы, а затем поступают обратно по градиенту рН, увлекая за собой сахарозу против градиента ее концентрации. Основной транспортной формой углеводов по флоэме служит сахароза (С12Н22О11). У некоторых видов наряду с сахарозой транспортной формой углеводов служат олигосахара (рафиноза, стахиоза), а также некоторые спирты. Вопрос № 83 Современное учение о химизме дыхания. Суть анаэробной фазы дыханияНа основании современных представлений общую схему дыхания можно представить в следующищем виде: Процесс дыхания состоит из двух этапов. Первый – анаэробный (гликолиз), в результате которого углеводы распадаются до ПВК. Второй этап может протекать двумя путями: при аэробных условиях – до СО2 и Н2О и при анаэробных условиях до спирта или др. соединений. Гликолиз – процесс анаэробного распада глюкозы, идущий с освобождением энергии, конечным продуктом является ПВК. Гликолиз - общий начальный этап аэробного типа дыхания и всех видов брожений. Реакции гликолиза протекают в растворимой части цитоплазмы и хлоропластах. Гликолиз расшифровали полностью в середине 30-х годов немецкие биохимики Г. Эмбден, О.Ф. Мейергоф и советский биохимик Я.О. Парнас (цикл Эмбдена-Мейергофа-Парнаса)- анаэробный этап дыхания, представлен во всех формах жизни, и предшествует всем типам дыхания, что свидетельствует о его раннем происхождении в процессе эволюции жизни. Гликолиз называют также дихотомическим окислением, так как происходит распад гексозы на две триоды [2, с. 15]. Слово «гликолиз» означает расщепление сахара. Пул гексоз (гексозофосфатов) находится в цитозоле и представлен гл.-6-фос, гл.-1-фос, фр.-6-фос. Гексозы поступают в зону локализации «своего» фермента путем диффузии. Анаэробный этап дыхания можно разделить на 3 фазы: 1. Подготовительная, в результате которой происходят фосфорилирование гексозы и ее активация с использованием энергии АТФ и при этом образуются 2 триозы (ФГА, ФДОА). 2. Окисление в результате которой происходит окисление триозы до ФГК и восстановление НАД-зависимой дегидрогеназы. 3. Первого и второго субстратного фосфорилирования в результате которого синтезируется АТФ. Анаэробный этап включает 11 последовательно протекающих ферментативных реакций: 1. Глюкоза + АТФ - гексокиназа = Глюкозо-6-фосфат; 2. Глюкоза-6-фосфат - гексозофосфатизомераза = фруктоза-6-фосфат; 3. Фруктоза-6-фосфат + АТФ - фосфофруктокиназа = фруктозо-1,6-дифосфат; 4. Фруктозо-1,6-дифосфат - альдолаза = ФГА + ФДОА; 5. ФДОА - триозофосфатизомераза - 2ФГА; 6. 2 ФГА + 2 Н3РО4 + 2 Н2О + НАД+ триозофосфатдегидрогеназа = 2 1,3-ФГК + 2 НАДН + Н+; 7. 2 1,3-ФГК + 2 АДФ - фосфогликолаткиназа = 2 3-ФГК + 2 АТФ (1-е субстратное фосфорилирование); 8. 2 3-ФГК - фосфоглицератмутаза = 2 2-ФГК; 9. 2 2-ФГК - Н2О - фосфопируватгидротаза = 2 ФЕПК; 10. 2 ФЕПК + 2 АДФ - пируваткиназа = 2 ЕПВК + 2 АТФ (2-е субстратное фосфорилирование); 11. 2 ЕПВК = 2 ПВК. Энергетика гликолиза. На преобразование 1 молекулы глюкозы в 2 молекулы ПВК затрачивается 2 молекулы АТФ (подготовительная фаза). При окислении ФГА до ФГК восстанавливается 2 молекулы НАД (2 х 3 = 6 АТФ). При 1 и 2 субстратном фосфорилировании образуется 4 АТФ. Итого 4 + 6 = 10 - 2 = 8 АТФ х 40 кДж (10 ккал) = 335 кДж/моль (80 ккал). Значение гликолиза: 1. Источник энергии. 2. Источник соединений (промежуточных продуктов окисления) необходимых для биосинтеза других сложных органических соединений (АК, ЖК, фенольных соединений, лигнина). 3. В ходе гликолиза из крахмала в хлоропластах образуются экспортные продукты - триозы. Регуляция гликолиза. Гликолиз менее саморегулирующий процесс по сравнению с циклом Кребса. Однако он находится под контролем регуляторной системы клетки. Если энергетические потребности клетки возрастают, увеличивается концентрация неорганического фосфата в результате гидролиза АТФ. Это активирует ферменты гликолиза и одновременно ингибирует активность ферментов пентозофосфатного цикла. Гликолиз – процесс генерации энергии в клетке, происходящий без поглощения кислорода и выделения СО2, поэтому его скорость трудно измерить. Регуляция скорости гликолиза осуществляется в зависимости от концентрации неорганического фосфата. При интенсивном потреблении энергии (гидролиз АТФ) количество неорганического фосфата возрастает, что повышает активность ферментов гликолиза. Вопрос № 100 Зависимость дыхания растительных тканей от температуры, влажности, газового состава воздуха и других факторов средыРастения, как все живые организмы, в процессе дыхания поглощают кислород и выделяют углекислый газ. Газообмен у них происходит через устьица на листьях, а также через чечевички на стеблях и трещины в коре. Внутри тканей кислород следует по межклетникам, потом проникает в клетки. Доступ кислорода ко всем органам растения – одно из основных условий жизни [1, с. 24]. При плохой обработке почвы или на переувлажненных почвах корням растений не хватает воздуха и, следовательно, кислорода. Поэтому при застое воды на отдельных участках поля большинство растений погибает. Ведь растения, так же как люди или животные, умирают без кислорода. Но у них потребность в кислороде меньше, чем у животных, и у них нет таких сложных органов дыхания. Дыхание – это поступление в организм кислорода и удаление углекислого газа, а также использование кислорода для окисления органических веществ с освобождением энергии (Рис.5). 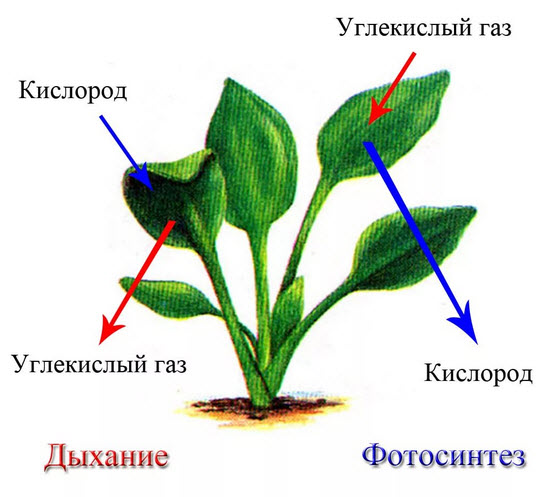 Рисунок 5 – Дыхание растений Таблица 1 – Сравнение дыхания и фотосинтеза растений
Во время дыхания часть органических веществ расходуется. Например, прорастающее зерно теряет 3-10% сухого вещества. Чем более неблагоприятна oкружающая среда для прорастания, тем больше требуется питательных веществ и тем интенсивнее дыхание проростка. Энергия, выделяемая во время дыхания, затрачивается на рост и развитие органов растений. Температура. Дыхание у ряда растений осуществляется и при температуре ниже 0°С. Так, у хвои ели процесс дыхания идет даже при температуре —25°С. Как всякая ферментативная реакция с повышением температуры интенсивность дыхания возрастает. Однако это происходит до определенного предела, выше которого начинается инактивация ферментов и интенсивность дыхания снижается. При этом надо учитывать длительность выдерживания растения при данной температуре. При кратковременной экспозиции интенсивность дыхания возрастает при повышении температуры до 35°С и даже 40°С. При длительном выдерживании в такой температуре интенсивность дыхания уменьшается [4, с. 28]. Снабжениекислородом. Кислород необходим для протекания дыхания, поскольку является конечным акцептором электронов, движущихся по дыхательной цепи. Увеличение содержания кислорода до 5-8% сопровождается повышением интенсивности дыхания. Дальнейшее возрастание концентрации 02 обычно уже не сказывается на интенсивности дыхания. Однако из этого общего положения имеются исключения. Снабжение растительных тканей и клеток кислородом зависит не только от его содержания во внешней среде, но и от скорости его поступления. Между тем часто проникновение кислорода к тем или иным тканям затруднено. Необходимо также отметить, что кислород оказывает стимулирующее влияние на процесс фотодыхания. Содержание углекислого газа.С02 является конечным продуктом как брожения, так и аэробного дыхания. При довольно высоких концентрациях С02, значительно превышающих те, которые обычно окружают растительный организм (выше 40%), процесс дыхания тормозится. Торможение вызывается несколькими причинами: 1) высокая концентрация СО2 может оказывать общее анестезирующее влияние на растительный организм; 2) СО2 тормозит активность ряда дыхательных ферментов; 3) повышение содержания СО2 вызывает закрытие устьиц, что затрудняет доступ кислорода и косвенно тормозит процесс дыхания. Содержание воды.Небольшой водный дефицит растущих тканей увеличивает интенсивность дыхания. Это связано с тем, что водный дефицит и даже подвядание листьев усиливают процессы распада сложных углеводов (крахмала) на более простые (сахара). Увеличение содержания Сахаров (основного субстрата дыхания) усиливает сам процесс. Вместе с тем при водном дефиците нарушается сопряжение окисления и фосфорилирования. Дыхание в этих условиях представляет в основном бесполезную трату сухого вещества. При длительном завядании растение расходует сахара, и интенсивность дыхания падает [5, с. 44]. Свет. Вопрос о влиянии света на интенсивность дыхания изучался многими физиологами. Решение этого вопроса осложнено методическими трудностями, поскольку на свету трудно разграничить процессы фотосинтеза и дыхания, прямое и косвенное влияние света. В свою очередь, влияние фотосинтеза на дыхание может быть различным и даже противоположным. Так, в процессе фотосинтеза образуются основные субстраты дыхания — углеводы. Вместе с тем промежуточные продукты, образовавшиеся при дыхании, могут вовлекаться в фотосинтетический цикл. Установлено, что свет стимулирует процесс фотодыхания. В настоящее время полагают, что влияние света на процесс дыхания многообразно. Возможно также, что свет активирует дыхательные ферменты (оксидазы). Питательные соли. Интенсивность дыхания сильно зависит от снабжения растения элементами минерального питания. Такие элементы, как фосфор, сера, железо, медь, марганец, принимают непосредственное участие в процессе дыхания, входя в промежуточные продукты (фосфор) или являясь составной частью дыхательных ферментов. Поранение. Поранение органов и тканей растения усиливает интенсивность дыхания. Это связано с разрушением клеток, из-за чего повышается соприкосновение дыхательных субстратов и ферментов. Частично поранение может вызывать переход клеток в меристематическую фазу роста. Интенсивность дыхания делящихся клеток всегда выше по сравнению с клетками, закончившими рост. Список использованных источниковВеретенников, А.В. Физиология растений / А.В. Веретенников. - М.: Академический проект, 2017. - 480 c. Косулина, Л.Г. Физиология устойчивости растений к неблагоприятным факторам среды: Учебное пособие / Л.Г. Косулина, Э.К. Луценко, В.А. Аксенова. - Рн/Д: РГУ, 2019. - 236 c. Кузнецов, В.В. Физиология растений в 2 т. том 1: Учебник для академического бакалавриата / В.В. Кузнецов, Г.А. Дмитриева. - Люберцы: Юрайт, 2016. - 437 c. Кузнецов, В.В. Физиология растений в 2 т. том 2: Учебник для академического бакалавриата / В.В. Кузнецов, Г.А. Дмитриева. - Люберцы: Юрайт, 2016. - 459 c. Медведев, С.С. Физиология растений: Учебник / С.С. Медведев. - СПб.: БХВ-Петербург, 2013. - 512 c. Скопичев, В.Г. Физиология растений и животных: Учебное пособие / В.Г. Скопичев. - СПб.: Просп. Науки, 2013. - 368 с. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 глюкозо-6-фосфат
глюкозо-6-фосфат