бх билеты. 1. Что такое пептиды, олигопептиды, белки Биологическая роль белков, их функции
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
|
1. Что такое пептиды, олигопептиды, белки? Биологическая роль белков, их функции. Белки — высокомолекулярные природные полимеры, состоящие из аминокислотных остатков, соединенных пептидной связью; являются главной составной частью живых орга- низмов и молекулярной основой процессов жизнедеятельности. Олигопептиды-это короткие белковые цепочки состоящие из 10-20 АК. Пептиды-это соединения,вкоторыхостаткиаминокислотсвяза- ны друг с другом амидной (пептидной) связью за счет карбо- ксильной группы одной и аминогруппы другой аминокислоты. пептиды–до 100 аминокислотныхостатков (олигопептиды – до 10); — белки–свыше100аминокислотныхостатков Каждый из белков обладает уникальной структурой и содержит активные центры, способные узнавать среди множества других определенную молекулу и избирательно с ней взаимодействовать. Благодаря этому белками обеспечивается структурная организация веществ в живой клетке, направленность и последовательность химических превращений и физико-химических процессов. Белки в организме выполняют ряд важнейших функций, основными из которых являются: 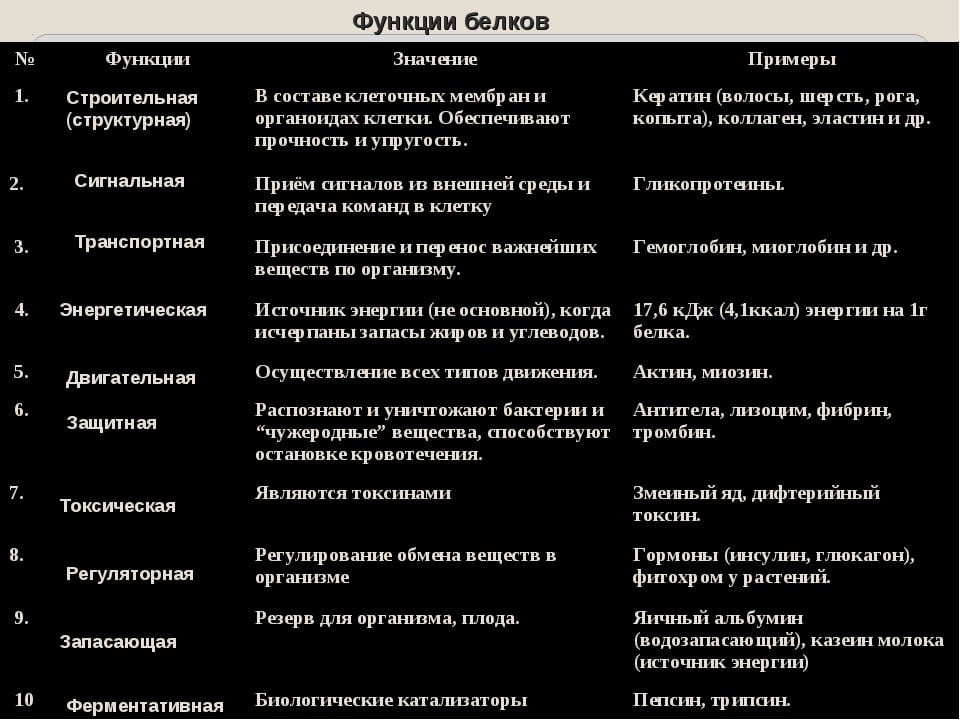 2. Протеиногенные и непротеиногенные, заменимые и незаменимые аминокислоты. Зависимость свойств пептидов и белков от их аминокислотного состава: кислотно-основные свойства, растворимость, изоэлектрическая точка. вся альфа-АК можно разделить на 2 группы: Протеиногенные-альфа-аминокислоты белкового происхождения,всего их 20(1.первичные(генетически кодируемые;2.вторичные(образ-ся в рез-те посттрансляционных процессов) Непротеиногенные-АК,выделенные из живых организмов,40 АК.токсичны для многих организмов,тк имитируют протеиногенные АК. Незаменимые – не синтезируются в организме, поэтому должны поступать в него с пищей Заменимые – синтезируются в организме Условно-заменимые – синтезируются в организме, но в недостаточных количествах Заменимыми аминокислотами являются: тирозин, глутаминовая кислота, глутамин, аспарагин, аспарагиновая кислота, цистеин, серин, пролин, аланин, глицин. Незаменимыми аминокислотами для взрослого здорового человека являются аминокислоты фенилаланин, триптофан, треонин, метионин, лизин, лейцин, изолейцин и валин; Для детей, дополнительно, гистидин и аргинин. Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы. Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.АК хорошо растворимы в воде.с увеличением R-группы растворимость в воде снижается,а в спирте увеличивается. ИЭТ-это значение ph раствора,по котором заряд белка равен 0.ИЭТ кислых белков находится в кислой среде,щелочные белки- в щелочной. 3. Уровни организации белковых молекул. Первичная, вторичная, третичная и четвертичная структуры белка и их характеристика. Связи, их стабилизирующие. Выделяют 4 уровня пространственной организации белков. Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная. Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия. Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия). Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны. Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо. Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток. 8. Коллаген. Особенности строения, основные этапы синтеза и созревания. Коллаген — основной структурный белок межклеточного матрикса. Он составляет от 25 до 33% общего количества белка в организме.Он объединяет семейство близкородственных фибриллярных белков, которые являются основным белковым элементом кожи, костей, сухожилий, хряща, кровеносных сосудов, зубов. В разных тканях преобладают разные типы коллагена. Этапы синтеза и созревания коллагена Синтез и созревание коллагена — сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе. Синтез и созревание коллагена включают в себя целый ряд посттрансляционных изменений (рис. 15-1): ✵ гидроксилирование пролина и лизина с образованием гидроксипролина (Нур) и гидроксилизина (Нуl); ✵ гликозилирование гидроксилизина; ✵ частичный протеолиз — отщепление «сигнального» пептида, а также N- и С-концевых пропептидов; ✵ образование тройной спирали. 10. Денатурация и ренативация белков. Факторы, вызывающие денатурацию. ДЕНАТУРАЦИЯ - это лишение белка его природных, нативных свойств, сопровождающееся разрушением четвертичной (если она была), третичной, а иногда и вторичной структуры белковой молекулы, которое возникает при разрушении дисульфидных и слабых типов связей, участвующих в образовании этих структур. Факторы, которые вызывают денатурацию белков, можно разделить на физические и химические. Физические факторы: высокие температуры, ультрафиолетовое облучение, рентгеновское и радиоактивное облучение, ультразвук, механическое воздействие (например, вибрация). Химические факторы: концентрированные кислоты и щелочи, соли тяжелых металлов, органические растворители, мочевина в высоких концентрациях. Обратимость осаждения белков обусловлена сохранением первичной структуры белка. Восстановление физико-химических и биологических свойств белка называется ренативация (ренатурация) 11. Четвертичная структура белков, связи, ее стабилизирующие. Особенности строения и функционирования олигомерных белков на примере гемоглобина. Четвертичная структура- совместное объединение нескольких близких по строению третьичных белковых структур в единую молекулу. Это надмолекулярная структура. Ее называют мултимер, а субъединицы-протомераими. Связи: электростатические, ионные, гидрофобные, редко дисульфидные. Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности,молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер. Молекула гемоглобина содержит четыре полипептидные цепи, каждая из которых окружает группу гема – пигмента, придающего крови ее характерный красный цвет. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. 12. Хромопротеины, важнейшие представители, строение и роль в организме. Типы гемоглобинов человека, различия в их строении и свойствах. Они имеют белковую и небелковую (простетическую) части. Белковую часть составляет полипептид, построенный из АК-остатков. В состав небелковой части может входить: гем, металл, остаток фосфорной кислоты, углеводы, липиды и т.д. К хромопротеинам относятся гемоглобин, миоглобин, каталаза, пероксидаза, ряд флавинсодержащих ферментов (сукцинатдегидрогеназа, альдегидоксидаза, ксантиноксидаза), цитохромы (гемсодержащие белки) и т.д. Биологическая роль этих белков – участвуют в физиологических процессах: дыхание клетки, транспорте кислорода и углекислого газа, окислительно-восстановительных процессах. Различают:- HbO2 – оксигемоглобин (связан с молекулой O2); - HbCO – карбоксигемоглобин; - HbCO2 – карбгемоглобин; - HbOH – метгемоглобин (образуется при соединении с нитросоединениями, не способен связывать кислород). Миоглобин по сравнению с гемоглобином имеет третичную структуру, одну полипептидную цепь, один гем может связывать одну молекулу кислорода. Гемоглобин и миоглобин функционируют вместе. Гемоглобин доставляет кислород из легких к тканям, а миоглобин перераспределяет его внутри клетки (доставляет к митохондриям). Оба белка – гемопротеины, т.е. гемсодержащие белки. 17. Вторичная структура ДНК и РНК. Комплементарность азотистых оснований Вторичная структура ДНК представляет собой двухцепочечную спираль, из двух длинных полинуклеотидных цепей, закрученных относительно общей оси. Сахарофосфатный скелет обеих цепей обращён наружу от оси спирали, а азотистые основания обращены внутрь спирали. Две цепи удерживаются вместе с помощью водородных связей между азотистыми основаниями (аденин образует две связи с тимином, а гуанин — три связи с цитозином), гидрофобных связей, стэкинг-взаимодействий и ионных связей. Одна цепь ДНК комплементарна другой, при этом цепи антипараллельны. Структурные особенности двойной спирали ДНК: 1. Две антипараллельные цепи являются правозакрученными вдоль общей оси 2. Плоскости, в которых лежат азотистые основания, образующие водородные связи, почти перпендикулярны оси спирали. В B-ДНК основания занимают центральную часть спирали, а сахарофосфатный скелет закручен и обращён наружу. Только края оснований контактируют с растворителем. 3. Каждое основание имеет приблизительно одну ширину, что придает спирали ДНК практически полную симметрию независимо от состава самих оснований. Основания в парах можно поменять местами без каких-либо последствий для спирали: Г ≡ Ц можно изменить на Ц ≡ Г или А = Т на Т = А. 4. Каноническая (идеальная) форма B- ДНК имеет 10 пар оснований в одном шаге (в одном повороте спирале). При этом на каждую пару приходится 36° Химические связи, стабилизирующие вторичную структуру ДНК: 1.Стэкинг-взаимодействия: пары оснований, уложенные в спирали «стопками» удерживаются силами Ван-дер-Ваальса. И несмотря на то, что связи между 2 парами оснований крайне слабые, их большое количество во всей молекуле ДНК является важным фактором её стабилизации. 2.Гидрофобные связи: гидрофобные азотистые основания «погружены» внутрь спирали и взаимодействуют друг с другом, это придаёт спирали дополнительную стабильность. 3.Водородные связи образуются между азотистыми основаниями цепей. Между аденином и тимином — 2 водородных связи, а между гуанином и цитозином — 3 (см. Рис. 52 ). 4.Электростатические взаимодействия: электростатическое отталкивание между отрицательно заряженными остатками фосфорной кислоты дестабилизирует спираль ДНК, однако эти эффекты минимизированы присутствием ионов Mg2+ и катионных белков (богатых лизином и аргинином) Вторичная структура РНК: 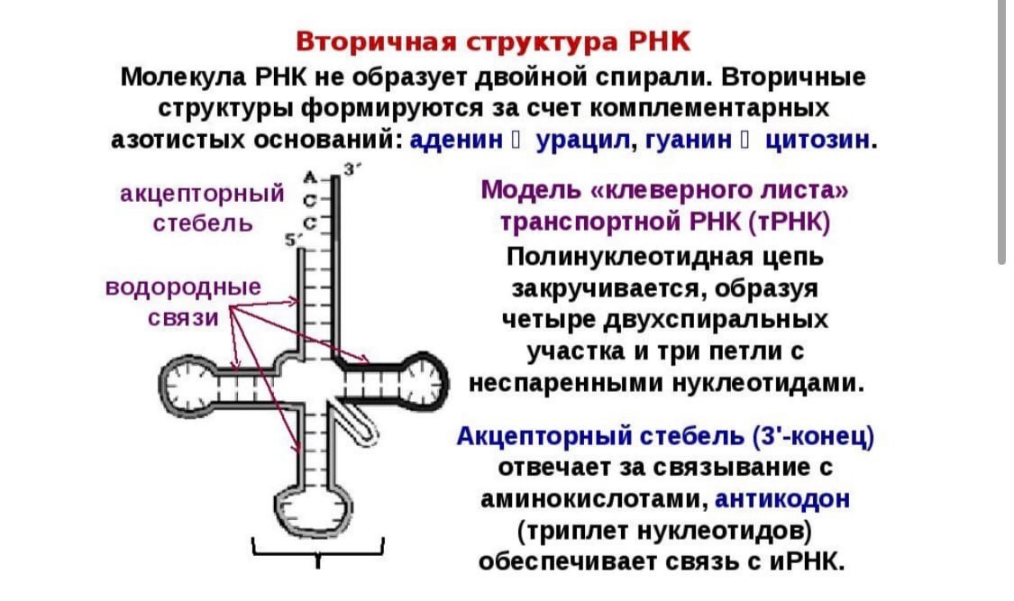 18. Третичная структура ДНК, строение нуклеосом. 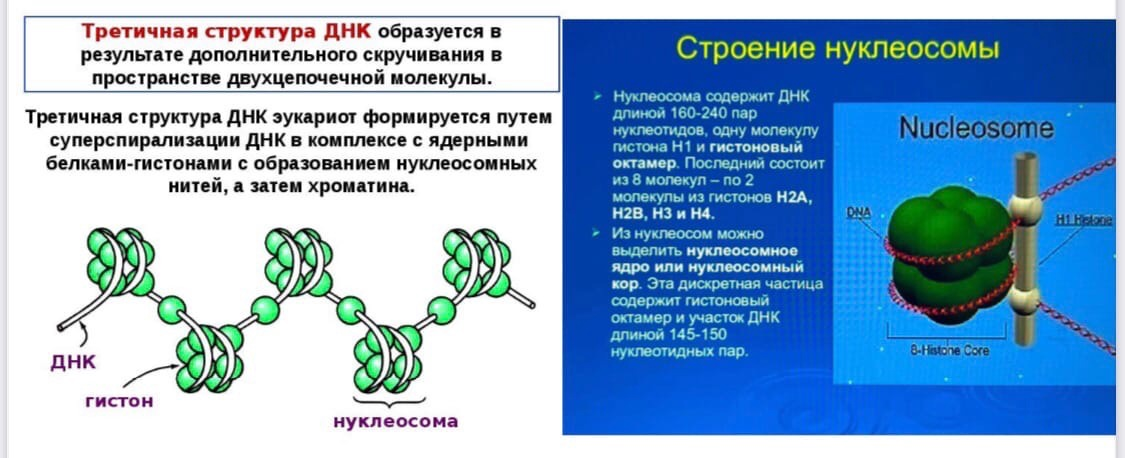 19. Сходство и различия ДНК и РНК. 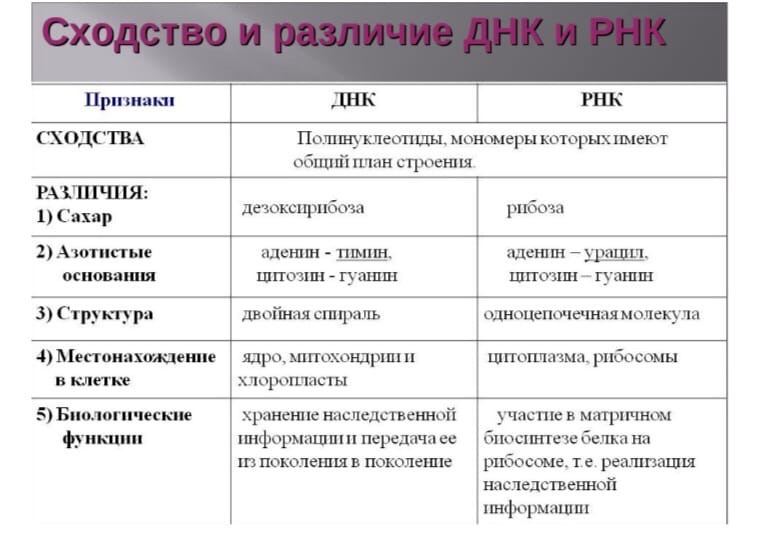 Между ДНК и РНК есть три основных отличия: — ДНК содержит сахар дезоксирибозу, РНК — рибозу, у которой есть дополнительная, по сравнению с дезоксирибозой, гидроксильная группа. Эта группа увеличивает вероятность гидролиза молекулы, то есть уменьшает стабильность молекулы РНК. — Нуклеотид, комплементарный аденину, в РНК не тимин, как в ДНК, а урацил — неметилированная форма тимина. — ДНК существует в форме двойной спирали, состоящей из двух отдельных молекул. Молекулы РНК, в среднем, гораздо короче и преимущественно одноцепочечные. |
