химсопромат. Контрольная работа по дисциплине Химическое сопротивление материалов
 Скачать 76.75 Kb. Скачать 76.75 Kb.
|
|
ФГБОУ ВПО «БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» ИНЖЕНЕРНЫЙ ФАКУЛЬТЕТ КАФЕДРА «ТЕХНОЛОГИЧЕСКИЕ МАШИНЫ И ОБОРУДОВАНИЕ» КОНТРОЛЬНАЯ РАБОТА По дисциплине «Химическое сопротивление материалов» Вариант – 3
Уфа-2018 Содержание
1.Химическая коррозия и защита металлов от газовой коррозии. При газовой коррозии происходит непосредственное взаимодействие атомов металла и кислорода с образованием пленки оксида данного металла. Молекулы кислорода, достигшие поверхности металла, адсорбируются на ней. Различают два типа адсорбции: − физическую, осуществляемую за счет Ван-дер-Ваальсовых сил; − химическую, или хемосорбцию, осуществляемую за счет сил химического взаимодействия. Обычно кислород хемосорбируется на поверхности металла с высоким тепловым эффектом, близким к тепловому эффекту образования оксида. Поэтому адсорбцию кислорода можно рассматривать как химическое взаимодействие, приводящее к образованию зародышей новой фазы – оксида металла. Следовательно, адсорбция кислорода является начальной стадией окисления металла. Процесс окисления протекает следующим образом. Вначале на чистой поверхности металла происходит физическая адсорбция кислорода, которая приводит к ослаблению связей между атомами в молекуле кислорода. Молекулы диссоциируют, и атомы кислорода оттягивают электроны от атомов металла. Наступает стадия химической адсорбции, когда смещение электронов к кислороду с образованием О2− равносильно образованию зародышей оксида. Таким образом, при взаимодействии кислорода с металлом образуется оксидная пленка. Образование оксида может происходить на поверхности металла, на поверхности или внутри оксидной пленки. Первый случай имеет место, если превалирует скорость диффузии кислорода, второй – если превалирует скорость диффузии ионов металла. В большинстве случаев скорости диффузии ионов (или атомов) кислорода и ионов металла соизмеримы и зона роста оксидной пленки находится внутри. В соответствии с ионно-электронной теорией окисления Вагнера, в оксидной пленке протекает встречная диффузия ионов металла и кислорода. При этом поверхность металла является анодом и на ней протекает реакция ионизации атомов металла. Положительные ионы металла и освободившиеся электроны перемещаются в пленке раздельно (рис. 1). 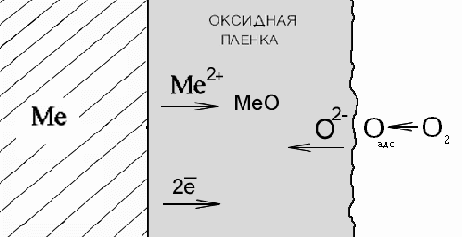 Рис. 1 Схема процесса химического окисления металла Электроны перемещаются со значительно большей скоростью, диффузия ионов металла протекает по дефектным местам кристаллической решетки или по ее междоузлиям. На скорость перемещения электронов и ионов оказывают влияние удельная электропроводность оксидной пленки и размеры ионов металла, атомов и ионов кислорода. Адсорбировавшиеся из газовой фазы молекулы кислорода диссоциируют на внешней поверхности оксида. Атомы кислорода диффундируют внутрь оксидной пленки, где, принимая электроны, превращаются в ионы О2− . Ионы кислорода продолжают диффундировать вглубь навстречу ионам металла. Таким образом, внешняя поверхность пленки, на которой кислород принимает электроны, является катодом. Следовательно, встречная диффузия ионов металла и кислорода протекает в электрическом поле. Скорость газовой коррозии принято выражать через скорость роста оксидной пленки: Uок = dy/dττ, где Uок – скорость газовой коррозии; y – толщина оксидной пленки; ττ – время окисления металла. В одних случаях пленки могут расти до заметных толщин, в других они будут чрезвычайно тонкими, порядка нескольких молекулярных слоев. Одним из основных условий, определяющих способность образованного первичного слоя оксида тормозить дальнейшее окисление металла, является сплошность получаемой пленки. Если объем получаемого оксида Voк меньше объема металла VMe , то образуется несплошная пористая пленка, обладающая низкими защитными свойствами. Наоборот, если объём пленки больше объема окислившегося металла (Voк/VMe>1), то можно ожидать образования сплошных пленок, обладающих способностью защищать металл от коррозии. Защита от газовой коррозииЗначительное увеличение скорости окисления металлов наблюдается при повышении концентрации кислорода в атмосфере инертных газов, содержащих небольшие примеси кислорода. При переходе же от атмосферы воздуха к атмосфере чистого кислорода не наблюдается увеличения скорости коррозии пропорционально увеличению парциального давления кислорода. Скорость движения газа заметно влияет на скорость коррозии в начальной стадии окисления. Однако при очень больших скоростях движения газовой среды возникает опасность эрозионного разрушения оксидных пленок, что может сильно увеличить скорость коррозии. Наличие резких колебаний температуры в процессе нагревания может привести к разрушению защитных оксидных пленок. Коэффициент термического расширения оксида, как правило, значительно ниже, чем для чистого металла. Вследствие этого резкие колебания температуры способствуют возникновению добавочных внутренних напряжений и механическому разрушению оксидной защитной пленки. Для защиты металлов от наиболее распространенного и вредного вида химической коррозии – газовой коррозии существуют следующие основные методы: 1) жаростойкое легирование, т.е. введение в сплав компонентов, повышающих жаростойкость; 2) защитные покрытия, т.е. нанесение на поверхность металлических конструкций защитного металлического или неметаллического слоя; 3) защитные или контролируемые атмосферы, т.е. искусственно создаваемые газовые атмосферы. Этот метод применяется главным образом при термообработке металлов; 4) уменьшение окисления металлов, достигаемое различными путями. 1. Для повышения жаростойкости металлы легируют элементами, которые, окисляясь, образуют на поверхности сплава или свой защитный оксид (например Al2O3, SiO2 и др.) или двойной с основным металлом оксид типа шпинели 2. Для защиты металлов от газовой коррозии применяют: а) металлические покрытия (для стали –Al ,Cr, Si и некоторые жаростойкие сплавы), наносимые термодиффузионным методом, наплавкой, плакированием и напылением; б) неметаллические покрытия – жаростойкие эмали, тугоплавкие соединения (карбиды, нитриды, бориды, силициды), металлокерамические покрытия (получаемые введением в оксиды и другие тугоплавкие соединения металлических добавок); в) защитные термостойкие краски и обмазки (ингибированные смазки) – для временной защиты деталей при их нагреве. 3. Изменение газовой среды до состава, исключающего возможность протекания коррозионного процесса, применяется при термообработке металлов в виде защитных (или контролируемых) атмосфер. В качестве защитных атмосфер применяют, помимо баллонных газов (N2, H2, углеводороды), диссоциированный аммиак, очищенный от кислорода технический азот и очищенные и осушенные продукты частичного сжигания топлива, главным образом газа. Уменьшение агрессивности нагревающих металл газов может быть достигнуто введением в них паров лития, а частичное устранение ванадиевой коррозии (ускоренного окисления сталей под влиянием золы топлива, содержащего V2O5) введением в топливо, содержащего ванадий, присадок CaO, MqO, SiO2 и др., образующих с V2O5 тугоплавкие соединения. Введение в газовую атмосферу SO2 и CO2 сильно снижают скорость окисления магния за счет образования на нем защитных пленок MqSO4 и MqCO3. 4. Малоокислительный нагрев является во многих случаях достаточно эффективным и более экономичным чем полное прекращение окисления металлов при применении защитных атмосфер. 5. Рациональное конструирование: а) рациональное решение конструктивных форм и элементов аппаратуры, устраняющие возможность ускорения коррозии металла и удлиняющие срок службы конструкции: герметичность устройств при приме- нении защитных атмосфер; отсутствие в печах элементов соприкасающихся с защитной атмосферой и вызывающих нежелательное изменение ее состава (кладка, окисленные металлы, водяной затвор и т.д.); надежное отделение продуктов сжигания топлива от защитной атмосферы (применение муфелей); отсутствие в печах конструкционных элементов, разрушающихся при взаимодействии с защитной атмосферой; равномерное распределение теплового потока на нагреваемой металлической поверхности для устранения перегрева; закатка концов теплообменных труб валиком для защиты их от обгорания; нейтрализация влияния высоких температур холодным газовым слоем и др. б) специальные предохраняющие устройства: тепловые защитные экраны, защита концов теплообменных труб от обгорания керамическими втулками. Ингибиторы атмосферной коррозии подразделяются на нелетучие – контактные, и летучие – парофазные. Нелетучие ингибиторы применяют в основном при хранении изделий на складе. Их наносят либо на поверхность изделий, при этом их действие ограничено местом контакта. Примером нелетучего ингибитора атмосферной коррозии может служить NaNO2 (стальное изделие сначала погружают в горячий 25…30% водный раствор NaNO2, затем извлекают и сушат). При этом на поверхности изделия образуется пассивная пленка, обладающая высокими защитными свойствами, а также слой сухого NaNO2, непрерывно возобновляющий пассивную пленку в случае ее механического повреждения. Летучие ингибиторы применяют для защиты как в сухой, так и во влажной атмосфере. Как правило, это нетоксичные вещества с невысоким, но достаточным для защиты давлением паров. Испаряясь, они быстро заполняют окружающую изделие воздушную среду. Последующая адсорбция их паров на поверхности металла приводит к образованию пленок с анодным и катодным механизмами защитного действия, а также обладающими гидрофобными свойствами. К летучим ингибиторам относятся нитриты и карбонаты замещенных аминов, сложные эфиры карбоновых кислот и др. соединения. Особенно эффективен среди них нитрит дициклогексиламмония, одним граммом которого можно насытить около 550 м3 воздуха, сделав его мало агрессивным по отношению к стали. При правильной упаковке и надлежащей концентрации ингибитора изделия могут храниться, не подвергаясь коррозии, более 10 лет. 2. Электрохимическая коррозия и защита металлов от электрохимической коррозии. Электрохимическая коррозия металлов представляет собой самопроизвольное разрушение металла вследствие электрохимического взаимодействия его с электролитом. Это гетерогенная реакция, протекающая на поверхности металла. Причиной электрохимической коррозии является термодинамическая неустойчивость металла в данных коррозионных условиях. На границе двух соприкасающихся фаз при определенных условиях может возникнуть разность потенциалов или, например электродный потенциал – на границе металл – раствор; контактный потенциал – на границе двух различных металлов; контактный потенциал второго рода – на границе металл – газ. Электрохимическая коррозия может иметь место только в электропроводных системах материал – среда, т.е. для металлических материалов – в растворах и расплавах электролитов. Причиной ее возникновения является химическая, энергетическая и другие виды неоднородности поверхности любого металла или сплава, т.е. разделение на катодные и анодные участки. Последние, имея очень малые размеры и чередуясь друг с другом, в токопроводящей среде представляют собой совокупность огромного числа короткозамкнутых микрогальванических элементов, поэтому электрохимическую коррозию часто называют гальванической коррозией. Процессы электрохимической коррозии протекают в водных растворах. При соприкосновении металлической поверхности с раствором электролита происходит взаимодействие металла с заряженными частицами раствора и 3 переход ионов металла в раствор. При взаимодействии металла и раствора протекают два сопряженных процесса: 1. Переход ионов из металла в раствор с образованием гидратированных ионов (анодный процесс): Me + mН2O = Меn+ mН2O + ne 2. Переход ионов из раствора с выделением их на поверхности металла в виде нейтральных атомов, входящих в состав кристаллической решетки металла (катодный процесс): Меn+mН2O + ne = Ме + mН2O Поверхность любого металла состоит из множества короткозамкнутых через сам металл микроэлектродов. Контактируя с коррозионной средой образующиеся гальванические элементы способствуют его электрохимическому разрушению. Отличительными особенностями электрохимического процесса коррозии являются следующие: – одновременное протекание двух раздельных процессов − окислительного (растворение металла) и восстановительного (выделение водорода, восстановление кислорода, выделение металла из раствора и др.); – процесс растворения металла сопровождается направленным перемещением электронов в металле и ионов в электролите, т.е. возникновением электрического тока; – продукты коррозии образуются в результате вторичных реакций. Окислительно−восстановительные процессы, протекающие при электрохимической коррозии, могут быть представлены в виде следующих реакций: Ме − nē→ Меn+ (анодный процесс) R(ox) + nē → R n- (катодный процесс), где R(ox) – окислитель; R n - (red) – восстановленная форма окислителя; nē – количество переданных электронов. В качестве примера электрохимической коррозии можно привести процесс окисления (ржавления) железа под воздействием воды: 4 А(–) Fe − 2ē → Fе 2+ (анодный процесс – растворение железа) К(+) H2O + ½О2 +2ē → 2OH- (катодный процесс – восстановление кислорода) Fe2+ + 2OH- → Fe(OH)2 (образование продуктов коррозии) Методы защиты металлов от коррозии. При разработке методов защиты от коррозии используют различные способы снижения скорости коррозии, которые выбираются в зависимости от характера коррозии и условий ее протекания. Выбор того или иного способа определяется его эффективностью, а также экономической целесообразностью. В зависимости от причин, вызывающих коррозию, различают следующие методы защиты. 1) Легирование. Применяется для изменения или улучшения физических и химических свойств металлов, сплавов. В особенности, для придания металлам и сплавам повышенной коррозионной стойкости. Металл, подвергшийся легированию, называется легированным. 2) Наиболее распространены неметаллические защитные покрытия – эмали, лаки, краски, пластмассы, различные смолы, полимеры. Защитное действие этих покрытий сводится в основном к изоляции металлов от окружающей среды. Достоинство этого способа защиты – простота технологии их нанесения. Недостаток – легко разрушаются из-за хрупкости и растрескивания при тепловых и механических ударах; эти покрытия защищают до тех пор, пока сохраняется их целостность. 3) Металлические защитные покрытия. Классифицируя металлопокрытия по способу защиты основного металла, их обычно подразделяют на катодные и анодные. Анодные покрытия. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент: А (–) Cr | H2O, O2 | Fe (+) К на аноде: Cr – 2ē → Cr2+ на катоде: 2 H2O + O2 + 4ē → 4 OH– Cr2+ + 2 OH– → Cr(OH)2 Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3: 4Cr(OH)2 + 2H2O + O2 → 4Cr(OH)3 Катодные покрытия. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении целостности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае (например, в атмосфере влажного воздуха). А (–) Fe | H2O, O2 | Sn (+) К на аноде: Fe – 2ē → Fe2+ на катоде: 2 H2O + O2 + 4ē → 4 OH– Fe2+ + 2 OH– → Fe(OH)2 Разрушается защищаемый металл. Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически. 4) Электрохимическая защита - перевод металла в коррозионно- устойчивое состояние путём торможения катодных и анодных реакций коррозионного процесса электрохимическими методами. Различают три вида электрохимической защиты: катодная, протекторная и анодная. Катодная защита. Суть катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу источника электрического напряжения, то становится катодом. В качестве противоэлектрода используется металлический лом или графит. Протекторная защита. Суть протекторной защиты состоит в следующем. К изделию, подвергающемуся электрохимической коррозии, присоединяют деталь-протектор из более активного металла, чем металлы изделия: протектор является анодом и будет разрушаться, а изделие останется неизменным. Анодная защита. Анодная защита используется только для тех металлов, которые при анодной нагрузке способны образовывать на своей поверхности пассивные оксидные или солевые пленки, защищающие металл от коррозии, например, железо в серной кислоте. Анодная защита отличается от катодной тем, что защищаемая конструкция присоединяется к положительному полюсу внешнего источника тока. 5) Обработка внешней среды, в которой протекает коррозия. Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяризатора, либо в изоляции металла от деполяризатора. Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ – ингибиторов. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов. 3. Коррозионная характеристика свинца. В атмосферных условиях свинец устойчив. Примеси сернистого газа, сероводорода, серной кислоты и угольного ангидрида, содержащиеся в сухом и влажном воздухе, на свинец не влияют. Скорость коррозии свинца в городской атмосфере (промышленные районы) равна 0,00043-0,00068 мм/год, в морской -0,00041-0,00056 мм/год и сельской -0,00023-0,00048 мм/год. В пресной и дистиллированной воде свинец не корродирует. Однако в присутствии кислорода и ангидрида угольной кислоты коррозия свинца заметно повышается. Свинец весьма стоек в растворах сернокислых солей. Щелочные соли вследствие гидролиза, а также соли азотной кислоты значительно ускоряют коррозию свинца. В азотной кислоте концентрацией ниже 70% свинец быстро корродирует в соляной кислоте свинец также недостаточно стоек, но стоек в серной кислоте. Скорость коррозии свинца увеличивается при высоких концентрациях серной кислоты (выше 90%), а также с повышением температуры. Свинец устойчив в хромовой, сернистой, фосфорной и плавиковой кислотах при комнатной температуре. Он также стоек в концентрированной уксусной кислоте. Однако в разбавленной уксусной и муравьиной кислотах в присутствии кислорода свинец быстро корродирует. В растворах сильных щелочей он корродирует медленнее. Газы - хлор (до 100°С), сероводород, сернистый газ и ангидрид серной кислоты - почти не действуют на свинец как в сухом, так и влажном состоянии; свинец также устойчив при низких температурах в сухих парах брома. Под действием фтористого водорода свинец быстро корродирует. Коррозия свинца в контакте с железом или медью в кислых растворах не увеличивается, так как свинец в этих условиях является катодом. В щелочных растворах, наоборот, при контакте с указанными металлами скорость коррозии свинца возрастает. На коррозионные свойства свинца заметное влияние оказывают также примеси других металлов. Так, висмут, и цинк снижают кислотоупорность свинца, а медь и сурьма, наоборот, повышают устойчивость свинца против действия серной кислоты. Свинец характеризуется высокой пластичностью, большой плотностью, низкой температурой плавления, низкой прочностью, низкой теплопроводностью, плохие литейные свойства; следовательно, его не применяют при температурах >150-180˚С. Коррозионная характеристика свинца термодинамически неустойчив φPb2+/Pb= – 0,126 в низкая склонность к пассивации способность образовывать труднорастворимые продукты коррозии высокое перенапряжение водорода, следовательно, затруднена коррозия с водородной поляризацией амфотерность оксидов и гидроксидов. Коррозионная стойкость свинца объясняется образованием на его поверхности толстых прочно связанных с металлом защитных пленок, состоящих из трудно растворимых вторичных продуктов коррозии. Такие слои либо совсем прекращают, либо сильно ограничивают дальнейшее взаимодействие металла со средой. Кроме того высокое перенапряжение водорода на свинце способствует замедлению коррозии в неокислительных кислотах. Свинец обладает высокой стойкостью в растворах серной (до 80%), фосфорной, плавиковой, азотной, соляной (до 10 %) кислотах, в морской воде и атмосферном воздухе, в обычной воде. В азотной кислоте с концентрацией до 70 % он нестоек. Сплавы свинца. Для повышения механических свойств свинца и улучшения его литейных свойств свинец легируют сурьмой 4-12%. Марки ССу-1 и ССу-2. Свинец применяют как металл для защитных покрытий. Это используют для: 1. предотвращения или уменьшения коррозии основного металла; 2. придания поверхности основного металла определенных декоративных свойств; 3. защиты от атмосферных воздействий. 4. Механизм действия пассивирующих ингибиторов. Ингибитором – называется вещество, снижающее скорость коррозии. Ингибиторы используются в системах, работающих с постоянным или малоизменяющимся объемом. Наиболее четко ингибирующее действие выражено у следующих типов соединений: амины, азотосодержащие гетероциклические соединения, сульфиды, альдегиды, меркаптаны. По условиям применения ингибиторы делятся на: ингибиторы для водных растворов (кислотные, щелочные и для нейтральной сред); «летучие ингибиторы» - для защиты от.) атмосферной коррозии (соединения аминов с азотистой, угольной или хромовой кислотами. Ингибиторы-пассиваторы вызывают формирование на поверхности металла защитной пленки и способствуют переходу металла в пассивное состояние. Наиболее широко пассиваторы применяются для борьбы с коррозией в нейтральных или близких к ним средах, где коррозия протекает преимущественно с кислородной деполяризацией. Различают несколько видов пассивирующих ингибиторов, например, неорганические вещества с окислительными свойствами (нитриты, молибдаты, хроматы). Последние способны создавать защитные оксидные пленки на поверхности корродирующего металла. В этом случае, как правило, наблюдается смещение потенциала в сторону положительных значений до величины, отвечающей выделению кислорода из молекул воды или ионов гидроксила. При этом на металле хемосорбируются образующиеся атомы кислорода, которые блокируют наиболее активные центры поверхности металла и создают добавочный скачок потенциала, замедляющий растворение металла. Возникающий хемосорбционный слой близок по составу к поверхностному оксиду. Механизм действия ингибиторов заключается в адсорбции их на корродирующей поверхности и последующем торможении катодных и анодных процессов. Анодные ингибиторы– окислители (NO2-, NO3-, CrO42-, PO43-). Металл при этом переходит в устойчивое пассивное состояние. Катодные ингибиторы – снижают скорость катодного процесса или сокращают площадь катодных участков. Относятся органические вещества, содержащие серу, азот и кислород (диэтиламин, уротропин, гидразин). Пассивирующие ингибиторы коррозии играют важную роль при образовании на поверхности металла защитной пленки, которая пассивирует ее. Пассиваторами чаще всего являются неорганические соединения, обладающие окислительными свойствами (нитриты, молибдаты, хроматы). Пассивирующие соединения считаются более эффективными, чем большая часть непассивирующих. 5. Особенности использования анодной защиты от коррозии. Анодную электрохимическую защиту применяют для конструкций, изготовленных из титана, низколегированных нержавеющих, углеродистых сталей, железистых высоколегированных сплавов, разнородных пассивирующихся металлов. Анодная защита применяется в хорошо электропроводных коррозионных средах. При анодной защите потенциал защищаемого металла смещается в более положительную сторону до достижения пассивного устойчивого состояния системы. Достоинствами анодной электрохимической защиты является не только очень значительное замедление скорости коррозии, но и тот факт, что в производимый продукт и среду не попадают продукты коррозии. Анодную защиту можно реализовать несколькими способами: сместив потенциал в положительную сторону при помощи источника внешнего электрического тока или введением в коррозионную среду окислителей (или элементов в сплав), которые повышают эффективность катодного процесса на поверхности металла. Анодная защита с применением окислителей по защитному механизму схожа с анодной поляризацией. Если использовать пассивирующие ингибиторы с окисляющими свойствами, то защищаемая поверхность переходит в пассивное состояние под действием возникшего тока. К ним относятся бихроматы, нитраты и др. Но они достаточно сильно загрязняют окружающую технологическую среду. При введении в сплав добавок (в основном легирование благородным металлом) реакция восстановления деполяризаторов, протекающая на катоде, проходит с меньшим перенапряжением, чем на защищаемом металле. Если через защищаемую конструкцию пропустить электрический ток, происходит смещение потенциала в положительную сторону. Установка для анодной электрохимической защиты от коррозии состоит из источника внешнего тока, электрода сравнения, катода и самого защищаемого объекта. Для того, чтоб узнать, возможно ли для определенного объекта применить анодную электрохимическую защиту, снимают анодные поляризационные кривые, при помощи которых можно определить потенциал коррозии исследуемой конструкции в определенной коррозионной среде, область устойчивой пассивности и плотность тока в этой области. Для изготовления катодов используются металлы малорастворимые, такие, как высоколегированные нержавеющие стали, тантал, никель, свинец, платина. Чтобы анодная электрохимическая защита в определенной среде была эффективна, необходимо использовать легкопассивируемые металлы и сплавы, электрод сравнения и катод должны все время находится в растворе, качественно выполнены соединительные элементы. Для каждого случая анодной защиты схема расположения катодов проектируется индивидуально. Для того, чтоб анодная защита была эффективной для определенного объекта, необходимо, чтоб он отвечал некоторым требованием: - все сварные швы должны быть выполнены качественно; - в технологической среде материал, из которого изготовлен защищаемый объект, должен переходить в пассивное состояние; - количество воздушных карманов и щелей должно быть минимальным; - на конструкции не должно присутствовать заклепочных соединений; - в защищаемом устройстве электрод сравнения и катод должны всегда находиться в растворе. Для реализации анодной защиты в химической промышленности часто используют теплообменники и установки, имеющие цилиндрическую форму. Электрохимическая анодная защита нержавеющих сталей применима для производственных хранилищ серной кислоты, растворов на основе аммиака, минеральных удобрений, а также всевозможных сборников, цистерн, мерников. Анодная защита может также применяться для предотвращения коррозионного разрушения ванн химического никелирования, теплообменных установок в производстве искусственного волокна и серной кислоты. Анодная защита внешним током – защита металла от коррозии с помощью постоянного электрического тока от внешнего источника, при которой защищаемый металл присоединяют к положительному полюсу (т.е. в качестве анода), а к отрицательному полюсу присоединяют дополнительный электрод, поляризуемый катодно. При этом поверхность защищаемого металла поляризуется анодно; ее потенциал при этом смещается в положительную сторону, что обычно приводит к увеличению электрохимического растворения металла; однако, при достижении определенного значения потенциала может наступить пассивное состояние металла (это наблюдается при отсутствии депассиваторов в коррозионной среде и приводит к значительному снижению скорости электрохимической коррозии металла), для длительного сохранения которого требуется незначительная плотность анодного тока. На дополнительном электроде – катоде при этом протекает преимущественно катодный процесс. При больших плотностях анодного тока возможно достижение значений потенциала, при которых наступает явление перепассивации растворение металла с переходом в раствор ионов высшей валентности, в результате чего образуются растворимые или неустойчивые соединения (железо и хром образуют ионы FeO42-и CrO42-), что приводит к нарушению пассивного состояния и увеличению скорости растворения металла. |
