Контрольная работа по иммунологии. КР Подлипская К.В.. Контрольная работа по дисциплине Иммунология Вариант 7 Направление подготовки 36. 05. 01 Ветеринария
 Скачать 323.85 Kb. Скачать 323.85 Kb.
|
|
Министерство сельского хозяйства Российской Федерации федеральное государственно бюджетное образовательное учреждение высшего образования «Вологодская государственная молочнохозяйственная академия им. Н. В. Верещагина» Факультет ветеринарной медицины и биотехнологий Кафедра эпизоотологии и микробиологии КОНТРОЛЬНАЯ РАБОТА по дисциплине: «Иммунология» Вариант №7 Направление подготовки 36.05.01 – «Ветеринария» Выполнил студент 722 группы, 1 подгруппы заочного отделения, шифр: 1844007 Подлипская К.В. Проверил к.в.н., доцент Закрепина Е.Н.  Вологда-Молочное Вологда-Молочное 2020 2020СОДЕРЖАНИЕ
1 КЛЕТОЧНЫЕ ФАКТОРЫ НЕСПЕЦИФИЧЕСКОЙ РЕЗИСТЕНТНОСТИ ОРГАНИЗМА Клеточные факторы неспецифической резистентности связаны с явлением фагоцитоза, микро- и макрофагами. Центральным звеном клеточных факторов защиты является система мононуклеарных фагоцитов. К этим клеткам относятся моноциты крови, гистиоциты соединительной ткани, купферовские клетки печени, легочные, плевральные и перитонеальные макрофаги, свободные и фиксированные макрофаги, свободные и фиксированные макрофаги лимфоузлов, селезенки, красного костного мозга, макрофаги синовиальных оболочек суставов, остеокласты костной ткани, клетки микроглии нервной системы, эпителиоидные и гигантские клетки воспалительных очагов, эндотелиальные клетки. Макрофаги осуществляют бактерицидную активность благодаря фагоцитозу, а также они способны секретировать большое количество биологически активных веществ, обладающих цитотоксическими свойствами в отношении микроорганизмов и опухолевых клеток [1, с. 75]. а) Фагоцитоз (от греческого phago – ем и cytos – клетка) один из самых древних механизмов резистентности, действует на всех станах эволюции. У простейших организмов он обеспечивает функцию питания и защиты клеток. На более высоких ступенях эволюции фагоцитоз выполняет только защитные функции с помощью дифференцированной системы клеток. Фагоцитоз - процесс активного поглощения клетками организма попавших в него патогенных живых и убитых микроорганизмов и других чужеродных частиц с последующим перевариванием их с помощью внутри клеточных ферментов. Фагоцитирующие клетки подразделяются на микрофаги (полиморфно-нуклеарные фагоциты), в подавляющем большинстве это нейтрофилы и макрофаги (мононуклеарные фагоциты). Среди макрофагов различают подвижные - оседлые (макрофаги печени, селезенки, лимфатических узлов, клетки, выстилающие стенки мелких сосудов и других органов и тканей) [3, с. 56]. Основная характеристика фагоцитирующих клеток представлена в таблице 1. Таблица 1
Один из основных функциональных элементов микро и макрофагов являются лизосомы (гранулы диаметром от 0,25 до 0,5 мкг, содержащие набор ферментов и других веществ) катионные белки, фагоциты, лактофферин и др), способных разрушать антигены. Характеристика основных групп антимикробных компонентов лизосом представлена в таблице 2. Таблица 2.
Фагоцитоз – это способность определенных клеток организма поглощать и переваривать чужеродные начала (вещества). Клетки, противостоящие возбудителям заболеваний, освобождающие организм от собственных, генетически чужеродных клеток, их обломков, инородных тел, были названы И.И. Мечниковым (1829г.) фагоцитами (от греческого phaqos – пожирать, cytos – клетка). Все фагоциты подразделяют на микрофаги и макрофаги. К микрофагам относят нейтрофилы и эозинофилы, к макрофагам – все клетки системы мононуклеарных фагоцитов [2, с. 34]. Процесс фагоцитоза сложный, многоэтажный (рис.1). Начинается он сближением фагоцита с возбудителем, затем наблюдают прилипание микроорганизма к поверхности фагоцитирующей клетки, дальше поглощение с образованием фагосомы, внутриклеточное объединение фагосомы с лизосомой и, наконец, переваривание объекта фагоцитоза лизосомальными ферментами. Однако не всегда клетки взаимодействуют подобным образом. Вследствие ферментативной недостаточности лизосомальных протеаз фагоцитоз может быть неполным (незавершенным), т.е. протекает только три стадии и микроорганизмы могут сохраняться в фагоците в латентном состоянии. При неблагоприятных для макроорганизма условиях бактерии становятся способными к размножению и, разрушая фагоцитарную клетку, вызывают инфекцию [6, с. 157]. Процесс фагоцитоза включает следующие этапы: хемотаксис и прилипание (адгезия) частиц к поверхности фагоцитов; постепенное погружение (захват) частиц в клетку с последующим отделением части клеточной мембраны и образованием фагосомы; слияние фагосомы с лизосомами; ферментативное переваривание захваченных частиц и удаление оставшихся микробных элементов. Активность фагоцитоза связана с наличием в сыворотке крови опсонинов (белков нормальной сыворотки крови, вступающих в соединение с микроорганизмами и превращающих их в доступную фагоцитозу форму). Делятся на термостабильные (в основном относятся к иммуноглобулину G, реже к иммуноглобулинам А и М) и термолобильные (разрушаются за 20 минут при 560С – компоненты системы комплемента С1,С2,С3,С4). Если в результате фагоцитоза происходит гибель микроорганизмов, фагоцитоз называют завершенным, если микроорганизмы, находящиеся внутри фагоцита не погибают, - называют незавершенным. Значение фагоцитоза в системе защиты организма огромно, но представление И.И. Мечникова о фагоцитозе как универсальном и господствующем механизме защиты от всех существующих инфекций в настоящее время претерпело много поправок.  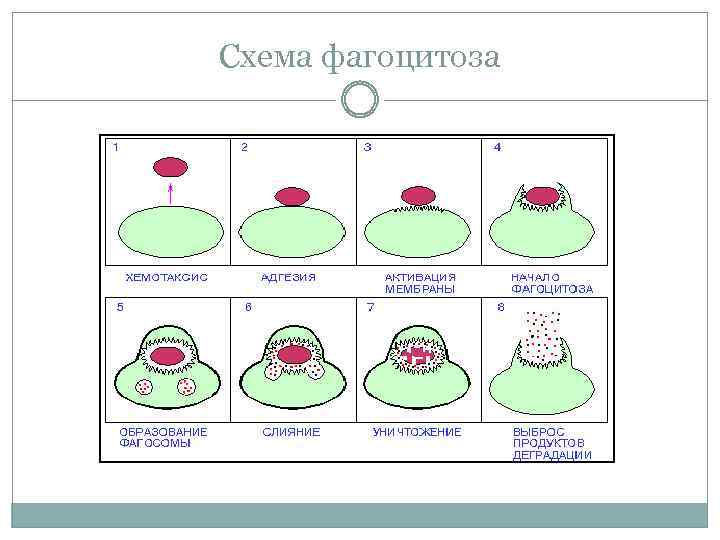 Рис. 1. Схема фагоцитоза. 2 ИММУНОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ При повторной встрече с антигеном организм формирует более активную и быструю иммунную реакцию — вторичный иммунный ответ. Этот феномен - иммунологической памяти. Иммунологическая память имеет высокую специфичность к конкретному антигену, распространяется на гуморальное и клеточное звено иммунитета и обусловлена В- и Т-лимфоцитами. Благодаря ей наш организм надежно защищен от повторных антигенных интервенций [3, с. 12]. Механизм формирования. Один из них предполагает длительное сохранение антигена в организме. Этому имеется множество примеров: инкапсулированный возбудитель туберкулеза, персисгирующие вирусы кори, полиомиелита, ветряной оспы и некоторые другие патогены длительное время, иногда всю жизнь, сохраняются в организме, поддерживая в напряжении иммунную систему. Другой в процессе развития в оргнизме продуктивного иммунного ответа часть антигенореактивных Т- или В-лимфопитов дифференцируется в малые покоящиеся клетки, или клетки иммунологической памяти. Эти клетки отличаются высокой специфичностью к конкретной антигенной детерминанте и большой продолжительностью жизни (до 10 лет и более). Они активно рециркулируют в организме, распределяясь в тканях и органах, но постоянно возвращаются в места своего происхождения за счет хоминговых рецепторов. Это обеспечивает постоянную готовность иммунной системы реагировать на повторный контакт с антигеном по вторичному типу. Однако феномен имеет и отрицательные стороны. Например, повторная попытка трансплантировать уже однажды отторгнутую ткань вызывает быструю и бурную реакцию — криз отторжения [5, с. 41]. И 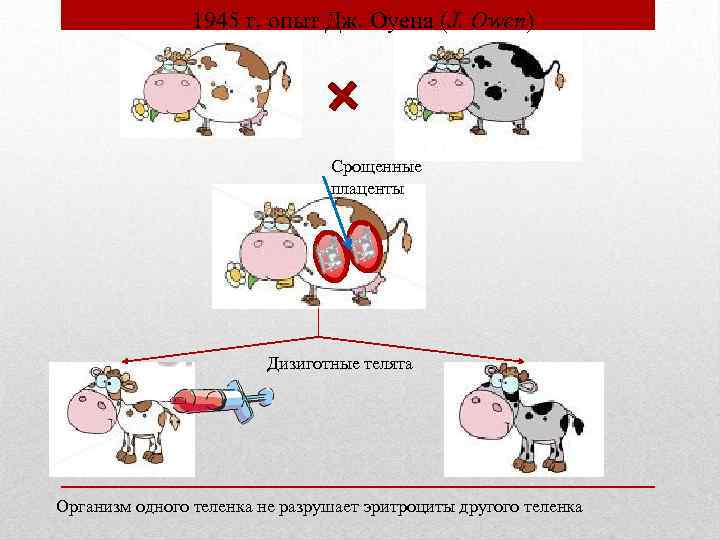 ммунологическая толерантность— явление, противоположное иммунному ответу и иммунологической памяти. Проявляется отсутствием специфического продуктивного иммунного ответа организма на антиген в связи с неспособностью его распознавания. В отличие от иммуносупрессии иммунологическая толерантность предполагает изначальную ареактивность иммунокомпетентных клеток к определенному антигену. Открытию предшествовали работы Р. Оуэна (1945), который обследовал разнояйцовых телят-близнецов (рис. 2). Ученый установил, что такие животные в эмбриональном периоде обмениваются через плаценту кровяными ростками и после рождения обладают одновременно двумя типами эритроцитов — своими и чужими. Наличие чужеродных эритроцитов не вызывало иммунную реакцию и не приводило к внутрисосудистому гемолизу. Явление было названо эритроцитарной мозаикой. Однако Оуэн не смог дать ему объяснение . ммунологическая толерантность— явление, противоположное иммунному ответу и иммунологической памяти. Проявляется отсутствием специфического продуктивного иммунного ответа организма на антиген в связи с неспособностью его распознавания. В отличие от иммуносупрессии иммунологическая толерантность предполагает изначальную ареактивность иммунокомпетентных клеток к определенному антигену. Открытию предшествовали работы Р. Оуэна (1945), который обследовал разнояйцовых телят-близнецов (рис. 2). Ученый установил, что такие животные в эмбриональном периоде обмениваются через плаценту кровяными ростками и после рождения обладают одновременно двумя типами эритроцитов — своими и чужими. Наличие чужеродных эритроцитов не вызывало иммунную реакцию и не приводило к внутрисосудистому гемолизу. Явление было названо эритроцитарной мозаикой. Однако Оуэн не смог дать ему объяснение .Рис. 2. 1945 г. опыт Дж. Оуена (J. Owen) Срощенные плаценты Дизиготные телята Организм одного теленка не разрушает эритроциты другого теленка. Собственно феномен иммунологической толерантности был открыт в 1953 г. независимо чешским ученым М. Гашеком и группой английских исследователей во главе е П. Медаваром. Гашек в опытах на куриных эмбрионах, а Медавар — на новорожденных мышатах (рис. 3.) показали, что организм становится нечувствительным к антигену при его введении в эмбриональном или раннем иостнатальном ггериоде. Иммунологическую толерантность вызывают AI - толерогены. бывает врожденной - отсутствие реакции иммунной системы на свои собственные антигены. Приобретенную толерантность можно создать, вводя в организм вещества, подавляющие иммунитет (иммуно-депрессанты), или же путем введения антигена в э 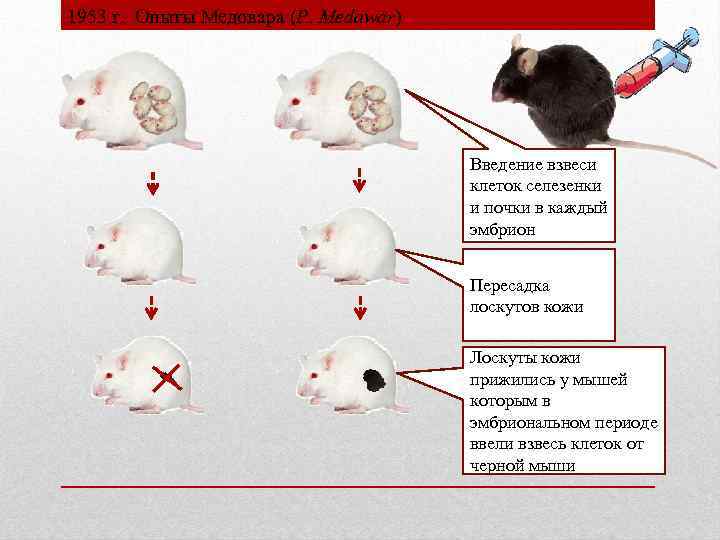 мбриональном периоде или в первые дни после рождения индивидуума. мбриональном периоде или в первые дни после рождения индивидуума. Рис. 3. 1953 г. Опыты Медовара (P. Medawar) Введение взвеси клеток селезенки и почки в каждый эмбрион Пересадка лоскутов кожи Лоскуты кожи прижились у мышей которым в эмбриональном периоде ввели взвесь клеток от черной мыши. Приобретенная толерантность: Активная толерантность создается путем введения в организм толерогена, который формирует специфическую толерантность. Пассивную толерантность можно вызвать веществами, тормозящими биосинтетическую или пролиферативную активность иммуно- компетентных клеток (антилимфоцитарная сыворотка, цитостатики и пр.). Иммунологическая толерантность отличается специфичностью — она направлена к строго определенным антигенам. По степени распространенности различают: Поливалентная толерантность возникает одновременно на все антигенные детерминанты, входящие в состав конкретного антигена. Для расщепленной, или моновалентной, толерантности характерна избирательная невосприимчивость каких-то отдельных антигенных детерминант [2, с. 397]. Степень проявления зависит от свойств макроорганизма и толерогена - возраст и состояние иммуннореактивности организма.легче индуцировать в эмбриональном периоде развития и в первые дни после рождения, со сниженной иммунореактивностью антигена- степень его чужеродности для организма и природу, дозу препарата и продолжительность воздействия антигена на организм. Наибольшей толерогенностью обладают наименее чужеродные по отношению к организму антигены, имеющие малую молекулярную массу и высокую гомогенность. Важное значение в индукции иммунологической толерантности имеют доза антигена и продолжительность его воздействия. Различают высокодозовую и низкодозовую толерантность. Высокодозовую толерантность вызывают введением больших количеств высококонцентрированного антигена. При этом наблюдается прямая зависимость между дозой вещества и производимым им эффектом. Низкодозовая толерантность, наоборот, вызывается очень малым количеством высокогомогенного молекулярного антигена. Соотношение «доза-эффект» в этом случае имеет обратную зависимость [5, с. 297]. Выделяют три наиболее вероятные причины развития иммунологической толерантности: 1. Элиминация из организма антигенспецифических клонов лимфоцитов. 2. Блокада биологической активности иммунокомпетентных клеток. З. Быстрая нейтрализация АГ AT. Элиминации, подвергаются клоны аутореактивных Т- и В-лимфоцитов на ранних стадиях их онтогенеза. Активация антигенспецифического рецептора (ТСК или ВСК.) незрелого лимфоцита индуцирует в нем апоптоз. Этот феномен, обеспечивающий в организме ареактивность к аутоантигенам, получил название центральной толерантности. Основная роль в блокаде биологической активности иммунокомпетентных клеток принадлежит иммуноцитокинам. Воздействуя на соответствующие рецепторы, они способны вызвать ряд «негативных» эффектов [5, с. 316]. Биосинтез в B-лимфоците и его превращение в плазмоцит подавляется YgG. Быстрая инактивация молекул антигена антителами предотвращает их связывание с рецепторами иммунокомпетентных клеток — элиминируется специфический активирующий фактор. Возможен адаптивный перенос иммунологической толерантности интактному животному путем введения ему иммунокомпетентных клеток, взятых от донора. Толерантность можно также искусственно отменить. Для этого необходимо активировать иммунную систему адъювантами. интерлейкинами или переключить направленность ее реакции иммунизацией модифицированными антигенами. Другой путь — удалить из организма толероген, сделав инъекцию специфических антител или проведя иммуносорбцию. Феномен иммунологической толерантности имеет большое практическое значение. Он используется для решения многих важных проблем медицины, таких как пересадка органов и тканей, подавление аутоиммунных реакций, лечение аллергий и других патологических состояний, связанных с агрессивным поведением иммунной системы. 3 РЕАКЦИЯ ФЛОКУЛЯЦИИ Реакция флокуляции по Рамону (Ramon assay) основана на способности некоторых антигенов при соединении со специфическими антителами образовывать нерастворимый комплекс «антиген-антитело», который визуально выявляется в виде помутнения среды и образования хлопьев (флокулята). Характерной особенностью реакции флокуляции является феномен инициальной флокуляции, т.е. способность формирования флокулята в первую очередь в тех растворах, где содержание антигена и антител (токсина/анатоксина-антитоксина) эквивалентны [1, с. 224]. Для проведения испытания используют специфический антитоксин, калиброванный, в зависимости от использованного иммунохимического метода, в Международных единицах (МЕ) или Lf-эквивалентах (ЬГ-ец.). Предпочтительнее использовать антитоксины, калиброванные в единицах Lf- eq. против соответствующих международных референс-препаратов анатоксинов для флокуляционных тестов. За 1 Lf принимают количество анатоксина, которое вступает в реакцию флокуляции с 1 МЕ или 1 Lf-eq. антитоксина в наиболее короткий промежуток времени. Содержание токсина/анатоксина в растворе, определенное в реакции флокуляции, выражают в Lf/мл. ПРОВЕДЕНИЕ ИСПЫТАНИЯ Специфический антитоксин в концентрации 100 МЕ или Lf-eq. в 1 мл вносят в возрастающих объемах (количествах МЕ/мл) в ряд пробирок, содержащих равные объемы испытуемого раствора токсина/анатоксина. Содержимое каждой пробирки доводят до равного объема 0,9 % раствором натрия хлорида. Смеси перемешивают, избегая образования пены. Пробирки со смесями инкубируют на водяной бане при температуре 45-50 °С, периодически оценивая состояние растворов ( рис 4). Результат реакции оценивают в проходящем свете, при необходимости применяют лупу. Отмечают пробирки, в которых раньше других произошла флокуляция, и время наступления флокуляции (Kf). Пробирка, в которой раньше других наблюдается появление хлопьев (инициальная флокуляция), содержит эквивалентные или близкие к эквивалентным количества антигена и антител. Для расчета содержания антигена учитывают концентрацию антитоксина в этой пробирке. Если инициальная флокуляция наблюдается одновременно в 2 пробирках, для расчета берут среднее значение показателей концентрации антитоксина, содержащегося в этих пробирках. Если перед проведением реакции флокуляции испытуемый раствор был разведен, то для расчета содержания анатоксина в растворе полученный результат умножают на степень разведения [7, с. 256]. Показатель (Kf) является полезным индикатором качества антигена. Если при данных значениях температуры и концентраций анатоксина и антитоксина значение Kf при повторных испытаниях увеличивается по сравнению с наблюдавшимся ранее, это может свидетельствовать о разрушении антигена и снижении его иммуногенной активности. Определение содержания анатоксина в испытуемом образце представлено в таблице 3. Таблица 3 - Определение содержания анатоксина в испытуемом образце
В данном примере раньше других наблюдалась флокуляция в пробирке № 3, следовательно, в этой пробирке содержание анатоксина близко или эквивалентно количеству внесенного антитоксина. В данном случае - 45 Lf/мл. Если испытуемый раствор был разведен в 10 раз, содержание анатоксина в нем равно 450 (4540) Lf/мл. Если инициальная флокуляция произошла в пробирке № 1 или № 5, результаты не учитывают, а тест повторяют, изменив количество вносимого антитоксина или разведение испытуемого раствора токсина/анатоксина. Для выполнения повторной реакции объемы вносимого в пробирки антитоксина следует выбирать с учетом того, чтобы крайняя пробирка (№ 1 или № 5), в которой наблюдалась инициальная флокуляция, оказалась в середине ряда [7, с. 261]. Для получения более точных результатов повторяют тест, выполняя реакцию флокуляции с объемами вносимого антитоксина, близкими по значению к эквивалентной концентрации, используя меньшие различия во вносимых объемах. Например: если инициальная флокуляция произошла в пробирке № 3, следует для уточнения эквивалентной концентрации повторить реакцию, внося в пробирки ряда антитоксин в объемах 0,41; 0,43; 0,45; 0,47; 0,49 мл. Для подтверждения полученных результатов тест повторяют при тех же условиях. Результаты считаются приемлемыми, если в повторных тестах наблюдаются различия не более чем на 1 разведение антитоксина. За окончательное значение принимают среднее арифметическое повторных измерений [2, с. 84]. Реакция флокуляции для растворов с низкой концентрацией анатоксинов/токсинов Для растворов анатоксинов или токсинов с низкой концентрацией (менее 5 Lf/мл) предпочтительнее использовать метод смешанной флокуляции, поскольку Lf смеси анатоксинов равен сумме их Lf (при условии их гомогенности). Метод заключается в сравнении значений Lf раствора анатоксина с предварительно установленной концентрацией с Lf этого же анатоксина в смеси с испытуемым анатоксином низкой концентрации. Если токсины/анатоксины не гомогенны, может возникать ложная картина с 2 флокуляционными максимумами. Например: анатоксин с известным содержанием разводят 0,9 % раствором натрия хлорида в соотношении 1:1. Тот же анатоксин смешивают с раствором испытуемого анатоксина низкой концентрации в равных соотношениях. Каждую из смесей разливают по 1 мл в ряд пробирок. В пробирки обоих рядов вносят в возрастающих объемах антитоксин с концентрацией 100 МЕ/мл и 0,9 % раствор натрия хлорида для доведения общего объема в каждой из пробирок до постоянной величины. Инкубируют пробирки на водяной бане при температуре 45 - 50 °С, периодически оценивая состояние раствора. Отмечают пробирки с инициальной флокуляцией в каждом ряду. Разница значений показателей инициальной флокуляции обоих рядов указывает на содержание анатоксина в испытуемом растворе [4, с. 43]. Эта реакция применяется для определения активности дифтерийного, столбнячного, ботулинического, анатоксинов и титрования противодифтерийной, противостолбнячной и других антитоксических сывороток. Р  ис. 4. Реакция флокуляции ис. 4. Реакция флокуляцииСПИСКОК ЛИТЕРАТУРЫ 1. Белоусова, Р.В. Ветеринарная вирусология: учебник для вузов по спец. "Ветеринария" [Текст] / Р.В.Белоусова, Э.А.Преображенская, И.В.Третьякова; под ред. Р.В.Белоусовой; межд. ассоц. "Агрообразование". - М. : КолосС , 2017. - 422 с. 2. Воронин, Г.С. Иммунология [Текст] / Г.С.Воронин, А.М.Петров, М.М.Серых, Д.А.Дервишов. - М.: Колос-Пресс, 2015. - 408 с. 3. Зыкин, Л.Ф. Клиническая микробиология для ветеринарных врачей: учебное пособие для вузов по спец. "Ветеринария" [Текст] / Л.Ф.Зыкин, З.Ю.Хапцев.- М.: КолосС ,2016. - 95с. 4. Кисленко, В.Н. Ветеринарная микробиология и иммунология: учебник для вузов по спец. "Ветеринария" Ч.3: Частная микробиология [Текст] / В.Н.Кисленко, Н.М.Колычев, О.С.Суворина; межд. ассоциация "Агрообразование". - М.: КолосС , 2017. - 214с. 5. Кисленко, В.Н., Колычев, Н.М., Госманов, Р.Г. Ветеринарная микробиология и иммунология [Текст] / В.Н. Кисленко, Н.М. Колычев, Р.Г. Госманов. - ГЭОТАР-Медиа, 2015.- 784 с. 6. Коляков, Я.Е. Ветеринарная иммунология [Текст] / Я.Е. Коляков. - М.: Агропромиздат, 2015.-340 с. 7. Скородумов,Д.И. Микробиологическая диагностика бактериальных болезней животных [Текст]: справочник / Д.И.Скородумов [и др.] . - М. : ИзографЪ , 2015. - 652с. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
