ТЕМА3. Контрольные вопросы и задачи а Напишите электронную формулу атома циркония Zr
 Скачать 23.89 Kb. Скачать 23.89 Kb.
|
|
ТЕМА3 Задание№15. (стр.12) Контрольные вопросы и задачи. а) Напишите электронную формулу атома циркония Zr. б) Распределите по квантовым ячейкам электроны двух последних уровней атома циркония, соблюдая принцип Паули и правило Гунда. в) Зная, что цирконий в соединениях может проявлять высшую валентность, равную IV, определите, на каких подуровнях находятся валентные электроны атома циркония и укажите эти электроны. Напишите значения четырех квантовых чисел для всех валентных электронов атома циркония. Решение: а)  б) [Kr] 4d2 5s2 - Сокращенная электронная конфигурация Zr
в) 4 квантовых числа: N (главное квантовое) s – 5, s – 5, d - 4, d – 4; L (орбиталуьное) s – 0, s – 0, d – 2, d – 2; M (магнитное) s – 0, s – 0, d – -2, d – -1; S (спиновое) s – +1/2, s – -1/2, d – +1/2, d – +1/2; Задание№45. (стр.21) Контрольные вопросы и задачи. а) Определите число связей в молекуле  . . б) Какая геометрическая структура молекулы 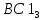 ? ? в) Определить, в какой из перечисленных молекул  , , 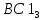 , ,  , ,  связь элемент - хлор обладает наибольшей полярностью? Почему? связь элемент - хлор обладает наибольшей полярностью? Почему? г) Определить все виды химической связи (ионная, ковалентная, донорно-акцепторная) в молекулах  Решение: а) Ионное соединение, в котором ионы  . связаны электростатическим взаимодействием. Структурная формула: Ион . связаны электростатическим взаимодействием. Структурная формула: Ион 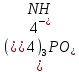 содержит 7 ковалентных связей (6σ-связей и π-связи). содержит 7 ковалентных связей (6σ-связей и π-связи). б) Геометрическая структура молекулы определяется равновесным расположением атомных ядер. Энергия взаимодействия атомов зависит от расстояния между ядрами. На очень больших расстояниях эта энергия равна нулю. ? в)  - ? - ?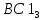 - ? - ? - ? - ? - ионная связь - ионная связьг) ? Задание№70. (стр.29) Контрольные вопросы и задачи. а) Каким количеством эквивалентов  можно заменить 250 мл 0,5 М раствора можно заменить 250 мл 0,5 М раствора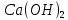 ? ? б) В каком объёме 0,5 М раствора  содержится столько же эквивалентов серной кислоты, сколько их в 250 мл 0,2 М раствора содержится столько же эквивалентов серной кислоты, сколько их в 250 мл 0,2 М раствора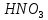 ? ? в) Эквивалентная масса хлора равна 35,5 г/моль. Атомная масса меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Определите и напишите формулу хлорида меди. Решение: a) N = 2*0.5*0.25 = 0.25 моль-экв б) N = 0.2*0.25 = 0.05 моль-экв, V = 0.05/(2*0.5) = 0.05 л = 50 мл в) Е (Cu) = 99.5 - 35.5 = 64 эквивалентная масса меди в хлориде валентность меди = 64/63,5 = 1, формула CuCl - хлорид меди (I) Задание№95. (стр.35 и 36-37) Написать уравнение следующих окислительновосстановительных реакций. Определить, какое вещество является окислителем и восстановителем, какое вещество создает среду. Указать степень окисления элемента окислителя и восстановителя, определить, сколько электронов отдает восстановитель и принимает окислитель. Уравнять коэффициенты в уравнениях реакций. а) Al + 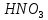 (очень разб.) = ? (очень разб.) = ?б)  + + + KOH = ? + KOH = ?в) NaI +  + +  = ? = ?Задание№120. (стр.47) Контрольные вопросы и задачи. а) Рассчитайте, сколько миллилитров 20%-ного раствора  (ρ =1,14 г/ (ρ =1,14 г/ ) необходимо взять для приготовления 300 мл 0,5 М раствора. ) необходимо взять для приготовления 300 мл 0,5 М раствора. б) В 250 мл воды растворили 5,85 г NaCl. Какова молярность и нормальность полученного раствора? в) Понижение давления пара над раствором бензойной кислоты, содержащим 0,100 моль бензойной кислоты в 760 г сероуглерода, при некоторой температуре равно 7,53 мм рт.ст. Давление пара сероуглерода при той же температуре 760 мм рт.ст. Вычислить молекулярную массу сероуглерода. а) Дано: ?  - 20% = 0,2 - 20% = 0,2 ρ =1,14 г/  300 мл 0,5 моль б) ? в) ? Задание№145. (стр.56) Контрольные вопросы и задачи. а) В 400 мл раствора HCl содержится 4 мг кислоты. Чему равен рН раствора. б) Вычислить рН 0,4% раствора  , плотность которого принять 1. , плотность которого принять 1.а) Дано: vHCl = 400мл. mHCl = 4мг. Рн = ? Решение: n =  = =  CHCl = 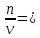  Ph = -lg CHCl = -lg 0,00027 = 3,57=3,6 Ответ: 3,6 б) ? Задание№170. (стр. 63) Вычислить H°, G°, S° приведенных ниже реакций. Сделать вывод о возможности протекания приведенных реакций в указанном направлении при 25°С, если реакция при комнатных условиях не идет, выяснить, пойдет ли реакция при других температурах.  + + 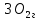 = = 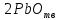 + +  ? ?Задание№195. (стр. 67,69) В каждом задании равновесная система относится к пп. «а» и «б». Для п. «а» написать выражение константы равновесия и определить, в какую сторону сместится равновесие при повышении в заданной системе давления, температуры. Ответ обосновать. Какими ещё воздействиями на систему равновесие можно сместить вправо? Для п. «б» задание в каждом конкретном случае своё. а)  (г) + (г) + (г) ↔ (г) ↔  (г). ? (г). ?б) Найдите равновесные концентрации веществ, если константа равновесия равна 10, а исходные концентрации  , ,  , ,  равны соответственно 2 моль/л, 2 моль/л, 1 моль/л. равны соответственно 2 моль/л, 2 моль/л, 1 моль/л.а) ? б) ? Задание№225. (стр. 72) Напишите в молекулярной и краткой ионной форме уравнения гидролиза солей. Если гидролиз идёт по стадиям. Напишите уравнения гидролиза по стадиям. Укажите условия, при которых происходит данная стадия гидролиза. Укажите, как изменяется pH-среды. a)  б)  в) Fe  а) Первая стадия: ZnCl2 ↔ Zn2+ + 2Cl— (диссоциация соли); Zn2+ + HOH ↔ ZnOH+ + H+ (гидролиз по катиону); Zn2+ + 2Cl— + HOH ↔ ZnOH++ 2Cl— + H+ (ионное уравнение); ZnCl2 + H2O ↔ Zn(OH)Cl +HCl (молекулярное уравнение). Вторая стадия: Zn(OH)Cl ↔ ZnOH++ Cl— (диссоциация соли); ZnOH++ HOH ↔ Zn(OH)2↓ + H+ (гидролиз по катиону); ZnOH++ Cl3— + HOH ↔ Zn(OH)2↓ + Cl— + H+ (ионное уравнение); Zn(OH)Cl + H2O ↔ Zn(OH)2↓ + HCl (молекулярное уравнение). В результате гидролиза образовались ионы водорода, поэтому раствор имеет кислую среду рН < 7. б) Первая стадия: Na2S ↔ 2Na+ +S2- (диссоциация соли); 2Na+ +S2-+ HOH ↔ HS— + 2Na+ +OH— (ионное уравнение); Na2S + HOH ↔ NaHS + NaOH (молекулярное уравнение). Вторая стадия: NaHS ↔ Na+ + HS— (диссоциация соли); Na+ + HS— +HOH ↔ H2S↑ + Na+ + OH— (ионное уравнение); NaHS + HOH ↔ H2S↑ + NaOH (молекулярное уравнение). В результате гидролиза образовались гидроксид-ионы, поэтому имеет щелочную среду рН < 7. в) Fe(CH3COO)3+3HOH=3CH3COOH+Fe(OH)3 CH3COO(-) + Fe (3+) +H2O=CH3COOH+Fe(OH)3 возможно ? рН = 7. Задание№250. (стр 76) Рассчитать ЭДС следующих гальванических элементов: Pt,  | | 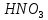 0,01 н. | | 0,01 н. | |  10% р-р | Cu ? 10% р-р | Cu ?Задание№280. (стр. 82-83) Цинковая и никелевая пластины скреплены друг с другом. Как будет протекать процесс коррозии в кислой, щелочной и нейтральной средах? Напишите уравнения реакций тех процессов, которые будут протекать на анодных и катодных участках в результате коррозии в каждой из сред. ? Задание№310. (стр.89) Рассчитайте, сколько времени должен длиться электролиз водного раствора хлорида калия, чтобы при силе тока 5 А у катода образовалось 100 г KOH. Определите, сколько при этом будет израсходовано KCl. ? |
