Краткая теория. Краткая теория для подготовки к экзамену. (Более подробно можно посмотреть из раздела эиос в лекционном блоке)
 Скачать 1.47 Mb. Скачать 1.47 Mb.
|
|
Сила оснований: Hb–>HCO3–>HbO2– П 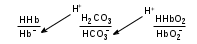 еренос протона происходит по следующей схеме: еренос протона происходит по следующей схеме:В капиллярах ткани:HHbO2O2 + HHb HbO2–O2 + Hb– СО2 + Н2О ⇄ Н2СО3 (продукт деятельности клетки в результате метаблизма) сильное основание Hb– забирает протон у слабой кислоты: H  2CO3 + Hb–⇄HCO3– + HHb 2CO3 + Hb–⇄HCO3– + HHbк о с.о. с.к. В капиллярах легких образуется сильная оксигемоглобиновая кислота: HHb + О2 = HHbO2 Основание HCO3– присоединяет протон, образуя H2CO3: Н  HbO2 + HCO3–⇄H2CO3 + HbO2– HbO2 + HCO3–⇄H2CO3 + HbO2–к о с.к. с.о. H2CO3 разлагается под действием ферментов (карбоангидразы): H2CO3H2O + CO2 и удаляется из организма через легкие. HbO2– с током крови уходит в ткани. Комплексные соединения (КС) ГЕМОГЛОБИН Гемоглобин – белок крови, который обратимо связывается с молекулярным кислородом. Белковая часть – апофермент – белок глобин, небелковая часть – кофермент – гем. Строение гема: это хелат, в котором комплексообразователем являетсяFe2+ (степень окисления постоянная) с координационным числом 6, связанный с тремя лигандами: Н2О (О2) и глобин – монодентатные и протопорфириновое кольцо – тетрадентатный. Гем имеет плоское строение. Одна молекула гемоглобина переносит 4 молекулы кислорода. Гемоглобин переносит кислород от лёгких к клеткам. В легких, где высокое парциальное давление кислорода, гемоглобин присоединяет кислород и образует оксигемоглобин, который придает алый цвет артериальной крови: ЦИАНОКОБАЛАМИН ИЛИ ВИТАМИН В12. Комплексообразователем является Co3+ с координационным числом 6. В структуре кобальт занимает такое же положение, что и железо в гемоглобине. ХЛОРОФИЛЛ. Хлорофиллы имеют порфириновое строение и структурно близки к гему. Комплексообразователь Mg2+. Цитохромы. Существует большая группа железосодержащих ферментов, которые катализируют процесс переноса электронов в митохондриях. Их называют цитохромами (Cyt). Всего известно около 50 цитохромов. Доказано, что перенос электронов в окислительно-восстановительной цепи с участием этого фермента осуществляется за счет изменения степени окисления железа.Cyt(Fe3+) + ē ⇄Cyt(Fe2+) Каталаза. Фермент, катализирующий окислительно-восстановительную реакцию разложения пероксида водорода. 2Н2О2  2Н2О + О2 2Н2О + О2Каталаз несколько, но все они имеют в своей структуре гем. В окисленной каталазе комплексообразователем является железо. (+3), в неокисленной каталазе – Fe+2. ХИМИЯ БИОГЕННЫХ ЭЛЕМЕНТОВ По количественному содержанию условно все биогенные элементы можно разделить на три класса: макроэлементы – содержание в организме более 10–3 % от массы тела. Это 11 элементов: O, C, H, N, P, S, Na, K, Ca, Mg, Cl. Из них 6 элементов – органогены: O, C, H, N, P, S. Это s- и р-элементы малых периодов. микроэлементы – содержание в организме от 10–3 % до 10–5 % от массы тела. Наиболее важные из них: Fe, Mn, Zn, Cu, Co, Mo, J и т.д. – в основном d-элементы. Установлено, чем больше заряд ядра, тем меньше содержание элемента в организме и тем токсичнее его соединения. ультрамикроэлементы – менее 10–5 % до 10–12 % от массы тела. Это: Hg, Au, U, Ra и т.д. Na+ и Са2+ – основные внеклеточные ионы, а К+ и Mg2+ – внутриклеточные ионы J – щитовидная железа F – эмаль зубов Zn – поджелудочная железа Мо – почки Ва – сетчатка глаза Sr – кости Au – ногти, волосы Районы с аномальным содержанием какого-то химического элемента в почве и водоемах называют эндемическими. У людей, проживающих в таких областях, протекают специфические биохимические реакции, которые вызывают, так называемые, эндемические заболевания. Например, Ярославская область является эндемическим районом по недостатку йода (J2) и кобальта (Со). Поэтому, есть опасность развития эндемического зоба (болезнь щитовидной железы). алюминоз – добыча и переработка алюминия силикоз – керамическая промышленность антракоз – угледобывающая отрасль нитриты вызывают тканевую гипоксию, т.к. окисляют Fe2+ в гемоглобине. В результате образуется метгемоглобин, который не способен транспортировать кислород (О2) К s-элементам относятся элементы IA, IIA групп, Н и Не. В образовании связи участвуют валентные электроны, которые находятся на внешнем уровне s-подуровне. Атомы легко отдают валентные электроны, проявляя металлические свойства и являясь восстановителями. В группах сверху вниз радиус атомов увеличивается, энергия ионизации уменьшается, металлические и восстановительные свойства увеличиваются. Среди s-элементов 1 органоген (Н), 5 макроэлементов (H, K, Na, Mg, Ca). Остальные микроэлементы. В организме существуют в виде ионов. К р-элементам относятся элементы с III по VIII группы главные подгруппы периодической таблицы. Валентные электроны располагаются на внешнем s- и внешнем р-подуровнях. ns2 nр6 С – это органоген № 1 С, Н, N, O – входят в водную и воздушную оболочку нашей планеты N, P, S – участвуют в образовании макроэргических связей в соединениях N – в составе белков и нуклеиновых кислот О – под его действием протекают большинство ОВР As – в небольших количествах оказывает положительное действие на кроветворение, участвует в нуклеиновом обмене, в больших дозах – яд. К d-элементам относятся элементы с I по VIII группы побочные подгруппы, Расположены в периодической таблице в больших периодах. Валентные электроны располагаются на внешнем s- и предвнешнем d-подуровнях. ОСОБЕННОСТИ а) наличие переменных степеней окисления, б) высокая комплексообразующая способность, в) наличие окраски большого числа соединений БИОЛОГИЧЕСКАЯ РОЛЬ Это микроэлементы. Их содержание от 103 до 1012 масс.%. Наиболее чутко организм реагирует на изменение концентрации микроэлементов. d-элементы непригодны для активного выполнения биологических функций из-за нерастворимости их неорганических соединений в водных растворах. Но это только в неорганических соединениях, а в органических соединениях являются биологически важными для организма. Это прекрасные биокатализаторы (вступают в комплексообразование с белками). Входят в состав металлоферментов: Mn – аргиназа Zn – алкогольдегидрогеназа, карбоангидраза Cr – трипсин Fe – гемоглобин, каталаза, цитохромы Cu – тирозиназа, гемоцианин, церулоплазмин Fe и Co – ксантиноксидаза Mo-нитрогеназа и нитратредуктаза Цитохром С, тирозиназа и ксантиноксидаза – это оксидоредуктазы (в них ионы d-элементы, меняя степень окисления, переносят электроны от окисляющегося субстрата к окислителю). При повышенном содержании вызывают токсическое действие на организм. Факторы, влияющие на электропроводность: - вязкость раствора (чем больше вязкость, тем меньше электропроводность) - температура (увеличение температуры приводит к снижению вязкости, увеличению степени диссоциации электролита, увеличению абсолютной скорости, уменьшению степени гидратации ионов, а следовательно к увеличению электропроводности) - радиус иона (чем больше собственный радиус, тем меньше эффективный радиус и тем больше электропроводность) ИСКЛЮЧЕНИЕ: Аномальная подвижность ионов Н+ и ОН ЭЛЕКТРОД – электрохимическая система, состоящая из двух или более фаз. ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ – величина, равная скачку потенциала на границе двух фаз (в двойном электрическом слое). Обозначается Е. Возникает на границе металл – раствор, или твердое – жидкость. СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ – потенциал, измеренный при стандартных условиях. Обозначается Ео. Стандартные условия: t = 298К = 25С, р = 1 атм = 101,325 кПа, a = 1 моль. Запись электрода: ионы или вещества находящиеся в растворе / вещества, находящиеся на электроде Men+ / Meo Запись электродной реакции: Men+ + nē ⇄ Meo. – реакция восстановления или Ox + nē ⇄ Red Расчет потенциала электродов I рода: УравнениеНернста: E = Eo + 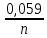 lg a(Men+) lg a(Men+)Расчет потенциала электродов II рода не требуется, у них потенциал известен Расчет потенциала электродов III рода: Уравнение Нернста-Петерса: E = Eo + 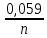 lg lg 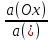 где n – число электронов, участвующих в электродной реакции. где n – число электронов, участвующих в электродной реакции.а – активность ионов в растворе (в разбавленных растворах равна конц-ции с)  Э     ЛЕКТРОДЫ ЛЕКТРОДЫI рода II рода III рода IV рода металлические металл + трудно- окислительно- стеклянный газовые растворимая соль восстановительный (позволяет делать состоят из 2 фаз этого металла + легко электрод измерения малых кол-в растворимая соль, содер- безразличный металл+ биол. жидкост.) жащая одноименный анион раствор, содержащий ионы не действуют состоит из 3 фаз в окисленной и восстан. формах каталитич. яды  СТАНДАРТНЫЙ ЭЛЕКТРОД – электрод сравнения. Это электроды с известными потенциалами, электроды второго рода. (хлорсеребряный, каломельный, ртутносульфатный) Электроды, определяющие рН: Хингидронный E = Eo + 0,059 lg a(Н+) или E = Eo – 0,059 рН Водородный E = Eo + 0,059 lg a(Н+) , т.к. Eo = 0, то E = 0,059 lg a(Н+) или E = – 0,059 рН Стеклянный E = const + 0,059 lg a(Н+) или E = const – 0,059 рН ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ – ‘электрохимическая система, состоящая из двух электродов, в которых энергия химической реакции превращается в энергию электрического тока. Во внешней цепи полуэлементы соединены проводником, а во внутренней – электролитическим мостиком. Запись гальванического элемента: электрод с меньшим потенциалом // электрод с большим потенц. Meo / Me n+ // Men+ / Meo ЭДС – электродвижущая сила, равная разности потенциалов. Всегда положительная величина. Обозначается ℰ. ℰ = Е1 – Е2, где Е1 > Е2 Стандартная ЭДС равна разности стандартных потенциалов. ℰ = Еo1 – Еo2, где Еo1 > Еo2 В гальваническом элементе электрод с большим потенциалом является окислителем, с меньшим потенциалом – восстановителем. Суммарная реакция записывается исходя из электродных реакций окисления и восстановления. O n Еo1 > Еo2 x1 + nē ⇄ Red1 1 Еo1 Red2 - nē ⇄ Ox2 1 Еo2 Суммарная реакция: Ox1 + Red2 = Ox2 + Red1 Для гальванического элемента рассчитывают энергию Гиббса и константу равновесия: Go = -nFℰo Kравн = 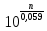 где n – наименьшее общее кратное числа электронов F – число Фарадея, равное 96500 Кл Гальванические элементы, служащие для определения концентрации ионов в растворе должны состоять из электрода сравнения и электрода, зависящего от концентрации этих ионов. ДИФФУЗИОННЫЙ ПОТЕНЦИАЛ - потенциал, который возникает на границе раздела двух растворов, имеющих различный электролитный состав или концентрации. Он возникает за счет разной скорости движения ионов, но со временем уменьшается и исчезает. МЕМБРАННЫЙ ПОТЕНЦИАЛ – потенциал, который возникает на клеточной мембране, т.е. на границе двух жидкостей, разделенных биологической мембраной. Потенциал покоя: (-75 мВ) – отрицательный: 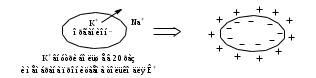 Потенциал действия: (+50 мВ) – положительный: 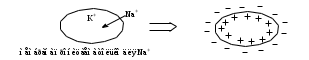 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ Поверхностные явления – явления, протекающие в гетерогенных системах на границе раздела фаз. Силы, действующие между молекулами одной фазы – когезионные силы Силы, действующие между молекулами разных фаз – адгезионные силы Поверхностное натяжение – это значение свободной поверхностной энергии, приходящейся на единицу поверхности раздела фаз [Дж/м2] сила, стремящаяся сократить поверхность до минимума [Н/м] Факторы, оказывающие влияние на : температура (при t силы когезии ) природа граничащей среды (при плотности среды силы когезии ) природа дисперсной фазы (растворенного вещества) (при полярности молекул силы когезии ) добавление ПАВ и ПИАВ (ПАВ ; ПИАВ ) Основные понятия. Сорбция – поглощение Адсорбция – изменение концентрации третьего компонента на границе раздела фаз. Положительная адсорбция – увеличивается концентрация растворенного вещества на границе (характерно для ПАВ). Отрицательная адсорбция – уменьшается концентрация растворенного вещества на границе (характерно для ПИАВ). Десорбция – процесс, обратный адсорбции. (процесс регенерации адсорбентов). Адсорбент – вещество, на котором адсорбируется адсорбтив. Адсорбтив – вещество, которое адсорбируется. Гемосорбция – способность белков крови адсорбироваться на различных границах. Хемосорбция – химическая адсорбция, при которой образуются ковалентные химические связи между адсорбентом и адсорбтивом (очень прочная адсорбция). Физическая адсорбция – адсорбция, которая возникает за счёт межмолекулярных, водородных слабых связей. Абсорбция – поглощение вещества всей массой (объемом) другого вещества. Природа ПАВ и ПИАВ ПАВ - поверхностно-активное вещество (концентрируется на поверхности): положительно адсорбируется на границе раздела фаз снижает поверхностное натяжение Х 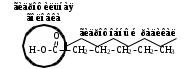 арактерная особенность: дифильность – наличие полярной группы и неполярного углеводородного радикала. арактерная особенность: дифильность – наличие полярной группы и неполярного углеводородного радикала. Примеры: жирные кислоты, их соли, спирты, амины, липиды – органические соединения. ПИАВ – поверхностно-инактивное вещество (концентрируется в глубине раствора) не адсорбируется или отрицательно адсорбируется на границе раздела. повышает поверхностное натяжение Характерная особенность: наличие полярных групп, неполярных групп мало или нет. н  ет гидрофобной части и распадается на ионы в растворе. ет гидрофобной части и распадается на ионы в растворе.Примеры: неорганические основания, кислоты, соли, органические без длинного углеводородного радикала – глюкоза, мочевина, сахароза. Правило Траубе-Дюкло: С удлинением углеводородной цепи на группу -СН2- поверхностная активность увеличивается в 3,2-3,4 раза. |
