Краткая теория. Краткая теория для подготовки к экзамену. (Более подробно можно посмотреть из раздела эиос в лекционном блоке)
 Скачать 1.47 Mb. Скачать 1.47 Mb.
|
|
1 2 3 4 5 НСООН муравьиная уксусная пропионовая масляная валерьяновая кислота кислота кислота кислота кислота Структурообразование ПАВ в биологических системах.  расширенный монослой 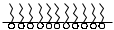 конденсированный монослой 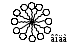 сферическая мицелла в водной среде 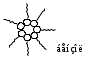 сферическая мицелла в органической жидкости 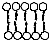 бислой в водной среде  бислой в органической жидкости Хроматография разделения компонентов смеси. Основана на различной адсорбционной способности веществ, что обуславливается природой адсорбента и адсорбтива. Полярный адсорбент (неподвижная фаза) лучше адсорбирует полярный адсорбтив, растворенный в неполярном растворителе (подвижная фаза). И наоборот. Выделяют: Ионообменную адсорбцию. Основана на явлении обратимого обмена ионов электролита, находящегося в растворе, на подвижные ионы, входящие в состав ионита. Адсорбент – ионит (катионит – подвижные катионы; анионит – подвижные анионы, амфолит – подвижные и катионы и анионы). Адсорбтив – электролит. В колонку насыпают ионит, пропускают раствор электролита, при этом происходит обмен ионов. электролит Пример: R-H+ NaСl⇄R-Na + HCl катионит Колоночную хроматографию Основана на различной адсорбционной способности Адсорбент – твердое вещество (неподвижная фаза). Засыпается в колонку. Адсорбтив – смесь компонентов. Наносят на поверхность адсорбента сверху колонки П 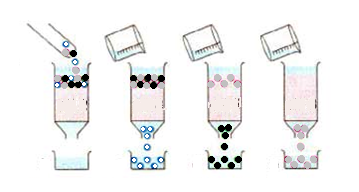 одвижная фаза – растворитель, которым вымывают компоненты. одвижная фаза – растворитель, которым вымывают компоненты.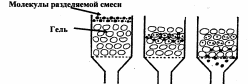 Вымывая растворителем, постепенно собирают фракции. Те вещества, которые адсорбируются на поверхности лучше, вымываются хуже. Вымывая растворителем, постепенно собирают фракции. Те вещества, которые адсорбируются на поверхности лучше, вымываются хуже.Из рисунка белое вещество адсорбируется хуже всех, так как быстрее выходит из колонки, а серое вещество адсорбируется лучше всех, так как вымывается из колонки последним. Гель-хроматографию Основана на различной степени пористости частиц геля и зависит от размера молекул разделяемых соединений. Мелкие частицы забиваются в поры геля, а крупные вымываются из колонки. Тонкослойную хроматографию. Основана на различной адсорбционной способности. 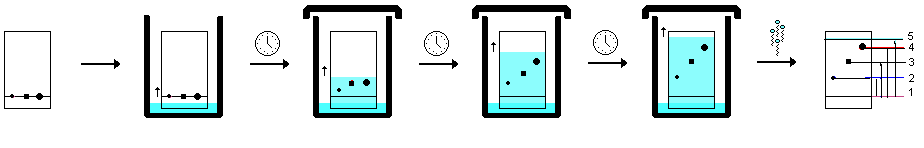 Адсорбент нанесен на алюминиевую фольгу. Адсорбтив наносят капиллярами на стартовую линию. Подвижная фаза – растворитель вымывает постепенно разделяемые компоненты. Для каждого компонента смеси рассчитывают его подвижность (Rf). Чем более подвижен компонент, тем меньше его адсорбционная способность. Д   ИСПЕРСНЫЕ СИСТЕМЫ ИСПЕРСНЫЕ СИСТЕМЫдисперсная фаза дисперсионная среда (диспергированное, раздробленное вещество) Пример: соленая вода (дисперсная фаза – соль, дисперсионная среда – вода) КЛАССИФИКАЦИЯ: по размерам частиц: грубодисперсные коллоиднодисперсные молекулярнодисперсные и ионнодисперсные (r = 10–4 – 10–6м) (r = 10–7 – 10–9м) (r = 10–10 – 10–11м) (Д = 104 – 106 м–1) (Д = 107 – 109 м–1) (Д = 1010 – 1011 м–1) Коллоидные растворы – это гетерогенная лиофобная дисперсная система с радиусом частиц r = 10–7 – 10–9м или со степенью дисперсности Д = 107 – 109 м–1. Коллоидные растворы золь Коллоидные частицы мицеллы ультрамикроны П  ОЛУЧЕНИЕ: ОЛУЧЕНИЕ:    д     исперсионный конденсационный исперсионный конденсационныйфизический химический физический химический (дробление) (пептизация) (замена растворителя (химические конденсация паров реакции) резкое снижение t) СВОЙСТВА: молекулярно-кинетические     броуновское движение диффузия седиментация осмос (тепловое движение (самопроизвольное (оседание частиц (движение молекул частиц) выравнивание под действием растворителя через концентрации в силы тяжести) полупроницаемую единице объема) мембрану из р-ра с меньшей концентра- цией в раствор с большей концентр.) оптические   эффект Фарадея-Тиндаля опалесценция (светящийся конус) (игра цветов: разная окраска в проходящем и отраженном свете) э  лектрокинетические лектрокинетические   электрофорез электроосмос потенциал течения потенциал оседания (движение фазы (движение среды (обратный электроосмосу) (обратный электрофорезу) относительно среды относительно фазы за счет движения среды за счет движения фазы под действием раз- через мембрану под относительно фазы относительно среды ности потенциалов) действ. разн. потенциал) через капилляр возникает разность потенц. возникает разность потенциалов ОЧИСТКА диализ (очистка от низкомолекулярных примесей через полупроницаемую мембрану) электродиализ (очистка от электролитов через полупрониц. мембрану под действием тока) ультрафильтрация (очистка от частиц с мелкими размерами) КОАГУЛЯЦИЯ - укрупнение частиц, под действием электролитов, температуры, концентрации, рН среды. Правило Шульце-Гарди: Коагулирующим действием обладают ионы противоположного знака относительно золя. Коагулирующая способность увеличивается с увеличением заряда иона. 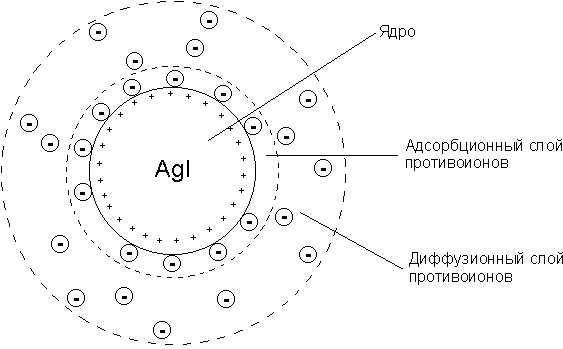 Пример: Золь AgI, стабилизатор KI Золь AgI,стабилизатор AgNO3. 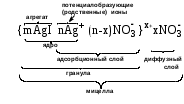  ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ Определение класса органического соединения Номенклатура . Старший заместитель (который выше) называют в окончании и нумерацию начинают с него. Органические соединения углеводороды (в состав входят С и Н)  функциональные производные углеводородов    монофункциональные полифункциональные гетерофункциональные (1 функц. группа) (несколько одинаковых) (несколько разных) СН3-СН2-NH2 НО-СН2-СН2-ОН НО-СН2-СН2-NH2 Ц   иклические органические соединения иклические органические соединениякарбоциклические гетероциклические ( O цикл только из углеродов) (в цикле есть гетероатом:N, O, S)     -избыточные гетероциклы – это пятичленный ароматический гетероцикл П  О    ример: ример: -недостаточные гетероциклы – это шестичленный ароматический гетероцикл П   ример: ример:N   Сопряжение. ,- сопряжение – , пример: СН2=СН-СН=О р,- сопряжение – Х, Х-это N, O, S, Cl, Br. пример: СН2=СН-NH2 Число электронов в сопряжении: двойная связь (=) это 2 электрона гетероатом без двойной связи (Х) это еще 2 электрона п 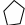 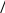  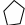 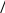  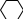 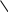 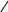 N ример: 4ē 6ē 6ē O Ароматичность. Признаки: цикл, все углероды с двойной связью, электронов в сопряжении равно 6 или 10. пример: неароматическое ароматическое    N N    Электронные эффекты I – индуктивный эффект смотрим по таблице М – мезомерный эффект смотрим по таблице, только если есть сопряжение Электроноацепторная группа будет, если эффекты отрицательные (–I и/или –М) или отрицательный больше положительного (–I> +М) Электронодонорная группа будет, если эффекты положительные (+I и/или +М) или положительный больше отрицательного (–I< +М) Пример: СН3-СН2-Br в данном случае Br (галоген) имеет –I (по таблице), сопряжения этой группы с молекулой нет, значит мезомерного эффекта нет. Т.к. только отрицательный эффект, то это электроноакцептор. СН2=СН-Br в данном случае Br (галоген) имеет –I (по таблице), сопряжение есть (р,), значит мезомерный эффект есть. По таблице для галогена это +М. Т.к. –I> +М (по таблице для галогенов) преобладает отрицательный эффект, то это электроноакцептор. Кислотно-основные свойства. Кислотность увеличивается если есть центр –ХН, если есть сопряжение и если присутствует электроноакцепторная группа. Ряд кислотности: карбоновая кислота > фенол > тиол > спирт Основность можно определить по правилу NOS (там где есть N будет более сильным основанием) и основность увеличивается если присутствует электронодонорная группа. Пиридиновый атом азота – это азот при двойной связи (–N=). Это электроноакцепторная группа и основный центр. Пиррольный атом азота – это азот без двойной связи (–NН–). Это электронодонорная группа и кислотный центр. Оптическая активность Оптическая активность характерна для соединений, у которых есть атом углерода с четырьмя различными заместителями. Число стереоизомеров рассчитывают по формуле N = 2n.   Н Н Н НП  ример: Cl-CH2-CH-COOH Распишем водороды: Cl-C-C-COOH. ример: Cl-CH2-CH-COOH Распишем водороды: Cl-C-C-COOH.OH Н ОН В этой формуле только один оптически активный центр, указан стрелочкой. У этого углерода 4 разных заместителя. Н     Н НC  l-C-C-COOH А значит у него стереоизомеров N = 21 = 2 l-C-C-COOH А значит у него стереоизомеров N = 21 = 2Н  ОН ОН3  2 1 2 1Cl-CH2-CH-COOH Стереоизомеры: СООН СООН O   H Н ОН НО Н H Н ОН НО НСН2-Cl СН2-Сl D – форма L-форма D или L форма определяется по нижнему центру (если их несколько) и -аномеры – у углеводов в циклической форме ( - ОН группа вниз, - ОН группа вверх) В организме и в природе углеводы в D-форме, аминокислоты в L-форме. Качественные реакции: для алкенов: обесцвечивание бромной воды (Br2/H2O) обесцвечивание перманганата калия (KMnO4) для фенолов: фиолетовое окрашивание с FeCl3 для диолов (многоатомных спиртов): синий раствор с Cu(OH)2, н.у. для альдегидов: красный осадок с Cu(OH)2, t реакция серебряного зеркала с Ag2O/NH3 Т 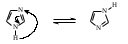 аутомерии: аутомерии:прототропная цикло-оксо 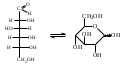 л 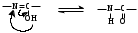 актим-лактамная актим-лактамная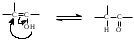 кето-енольная Некоторые реакции: Ацеталь образуется из альдегида и двух молекул спирта Полуацеталь образуется из альдегида и спирта Альдоль образуется из двух молекул альдегида Этерификация – реакция между карбоновой кислотой и спиртом Декарбоксилирование – отщепление СО2 у карбоксильной группы (облегчается при наличии у -атома электроноакцепторного заместителя) Пример: щавелевая кислота НООС-СООН, малоновая кислота Циклизация до ангидрида: янтарная и глутаровая кислоты Внутримолекулярная дегидратация спиртов приводит к получению алкена Межмолекулярная дегидратация спиртов приводит к образованию простого эфира Реакции окисления: первичные спирты окисляются до альдегидов, вторичные до кетонов. Альдегиды окисляются до карбоновых кислот. Тиолы окисляются до дисульфидов. Алкены окисляются до диолов. Первичный спирт: гидрокси-группа (-ОН) находится у углерода, у которого только один сосед углерод. Пример: НО-СН2-СН2-СН3 Вторичный спирт: гидроксигруппа находится у углерода, у которого два соседа углерода П  ример: НО-СН-СН2-СН3 или НО- ример: НО-СН-СН2-СН3 или НО-СН3 Третичный спирт: гидроксигруппа находится у углерода, у которого три соседа углерода С  Н3 Н3Пример: СН3-С-СН2-NH2 ОН Правило Марковникова: водород присоединяется по двойной связи к углероду, имеющему больше водорода. Это правило не выполняется, если у углеродов при двойной связи одинаковое число атомов водорода. Присоединение идет против правила Марковникова если в молекуле присутствуют электроноакцепторные заместители (-СООН, -NO2, -Cl, -Br и т.д.) -гидроксикислота образует при нагревании лактид -аминокислота образует при нагревании дикетопиперазин -гидроксикислота образует при нагревании ненасыщенную кислоту -аминокислота образует при нагревании ненасыщенную кислоту -гидроксикислота образует при нагревании лактон -аминокислота образует при нагревании лактам |
