конспект лекций. Криворізький медичний коледж Зошит для самостійних робіт
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
|
Питання для самоконтролю: 1. Диференціальне рівняння вимушених|змушених| коливань має вигляд|: 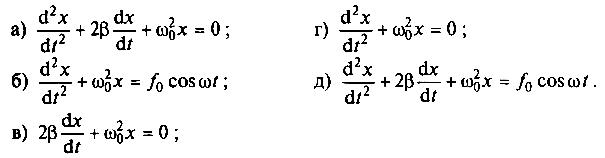 2. Рівняння плоскої хвилі має вигляд|вид|: 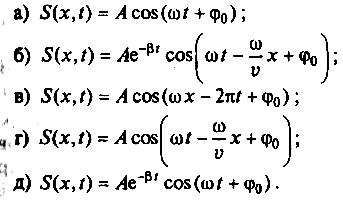 3. Рівень інтенсивності звуку вимірюється: а) герцах; г) ватах; б) фонах; д) ватах на секунду в квадраті. в) децибелах; Відповіді: д); 2. г) ; 3. в) . Самостійна робота №2 Реографія — метод обстеження загального та органного кровообігу. Знати основні поняття термодинаміки; перший і другий закони термодинаміки, поняття ентропії, термодинамічних потенціалів, спряження потоків, стаціонарного стану, значення термодинаміки та синергетики в проблемі охорони навколишнього середовища. Вміти користуватись основними поняттями термодинаміки; пояснювати перший і другий закони термодинаміки, користуватись поняттями ентропії, термодинамічних потенціалів; спряження потоків, стаціонарного стану, пояснювати теорему Пригожина. Зміст теми Термодинамічний метод вивчення медико-біологічних систем. Перший і другий закони термодинаміки, ентропія, термодинамічні потенціали. Термодинаміка відкритих систем (спряження потоків, стаціонарний стан, теорема Пригожина). Значення термодинаміки та синергетики в проблемі охорони навколишнього середовища. Опрацюйте наступну літературу: Основна: Шевченко А.Ф. Основи медичної і біологічної фізики. — К.: Медицина, 2008.- Р.6. Додаткова: Тіманюк В.О., Животова О.М. Біофізика: Підр. для студ. внз.-Х.: Вид-во НФАУ; Золоті сторінки, 2003.- 704с.- Гл.4,5. Дайте відповіді на питання: Термодинаміка. Види термодинамічних систем. Перший закон термодинаміки. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Теплообмін. Види теплообміну. Ентальпiя. Закон Гесса. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Другий закон термодинаміки. Ентропія i термодинамічна ймовірність. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Організм як відкрита система. Рівняння Пригожина. Стаціонарний стан. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Основні формули Закон Бойля-Маріотта (ізотермічний процес): 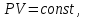 при Т= const, m=const. при Т= const, m=const.Закон Гей-Люссака (ізобарний процес): 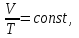 при P = const, m = const. при P = const, m = const.Закон Шарля (ізохорний процес): 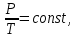 при V = const, m = const. при V = const, m = const.Рівняння Менделєєва-Клапейрона: 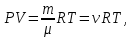 де P – тиск газу; V – його об’єм, Т – абсолютна температура, m – маса газу, μ - молярна маса газу, ν – кількість речовини, 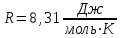 - універсальна газова стала. - універсальна газова стала.Кількість теплоти при зміні температури на ΔТ речовини масою 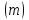 : : 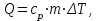 де ср – питома теплоємність речовини за сталого тиску. де ср – питома теплоємність речовини за сталого тиску.Зміна внутрішньої енергії газу при сталому об’ємі: 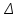 U =cv∙ m ∙ ∆T, або в диференціальній формі: U =cv∙ m ∙ ∆T, або в диференціальній формі: dU = cv∙ m ∙ dT. Перший закон термодинаміки для замкнутих систем: 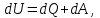 де dU – зміна внутрішньої енергії системи; dQ – кількість теплоти одержаної або відданої системою в процесі теплопередачі; dA – робота виконана системою або над системою. Елементарна робота газу при сталому тиску: 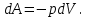 Робота при ізобарному процесі: 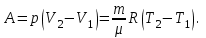 Робота при ізотермічному процесі: 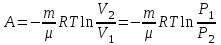 . .Зміна ентропії: 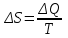 - при сталій температурі, - при сталій температурі,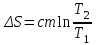 - при зміні температури тіла від Т1 до Т2, - при зміні температури тіла від Т1 до Т2,де m – маса тіла; с – питома теплоємність речовини, Т – абсолютна температура термодинамічної системи. Зразок розв’язку типової задачі Визначити зміну ентропії водню масою 200 г при ізотермічному розширенні від об’єму V1 до V2 = 10 V1. Газ вважати ідеальним. Р Дано: m = 200г = 0,2 кг V2 = 10V1 T = const R = 8,31Дж/(моль.К) μ = 2 г/моль = 2.10-3 кг/моль ΔS - ? озв’язання: Згідно І закону термодинаміки для замкнутих систем dU = dQ + dA При Т = const, U = 0, тому dQ = -dA = pdV Зміна ентропії при ізотермічному процесі: 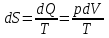 S-? З рівняння стану ідеального газу 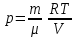 . Тоді . Тоді 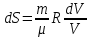 . .Після інтегрування одержимо: 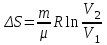 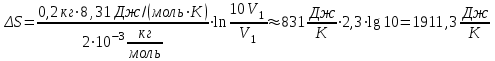 Відповідь: S 1911,3 Дж/К Задачі для самостійного розв’язку 1. 4 кг кисню нагрівають за постійного об’єму від температури 270С до 2270С. Знайти зміну ентропії при цьому процесі.
2. При незворотному термодинамічному процесі, який протікає при температурі 4230С, тіло виконало роботу 89 Дж, ентропія зросла на 10 Дж/К. Знайти зміну внутрішньої енергії тіла.
3. Визначити кількість теплоти, яка виділяється при ізотермічному стиску 1 кг азоту від нормального тиску 105 до тиску 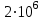 Па. Температура азоту становить 370С. Па. Температура азоту становить 370С.
4. Визначити зміну ентропії у процесі перетворення 2 кг води, взятої при температурі 270С в пару.
|
