|
|
Возобн. источн. энерг. Тексты лекций. Курс лекций для студентов специальности энергоэффективные технологии и энергетический менеджмент Минск 2009 удк620. 9(042. 4)
1. Аккумулятор с насыщенной жидкостью.
Это случай аккумулирования с постоянным объемом 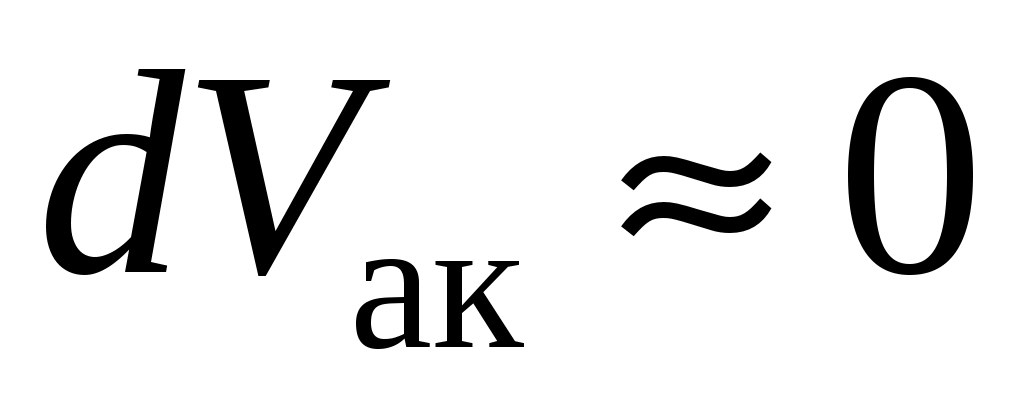 . .
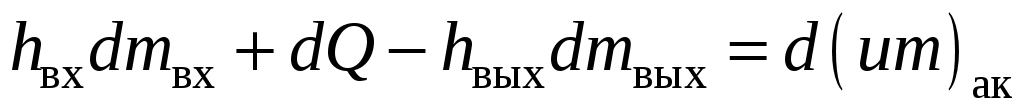
Такого типа аккумуляторы в качестве рабочей среды используют двухфазную среду жидкость–пар при температуре насыщения. Резервуар заполнен на 75–95% водой в состоянии насыщения и паром на
5–25%. Зарядка аккумулятора осуществляется либо введением горячего пара, либо введением горячей воды, либо через теплообменник.
При зарядке аккумулятора горячим паром, разрядка происходит насыщенным паром. При этом небольшая часть воды испаряется и температура понижается. Разрядка всегда сопровождается значительным понижением давления, а зарядка – повышением.
Для такого аккумулятора энергетическое уравнение примет вид
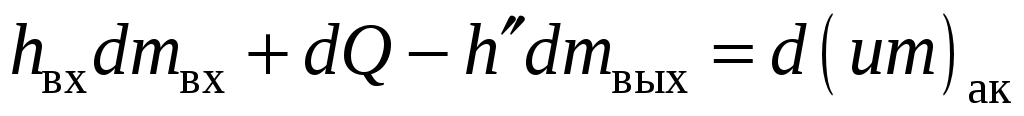 , ,
где 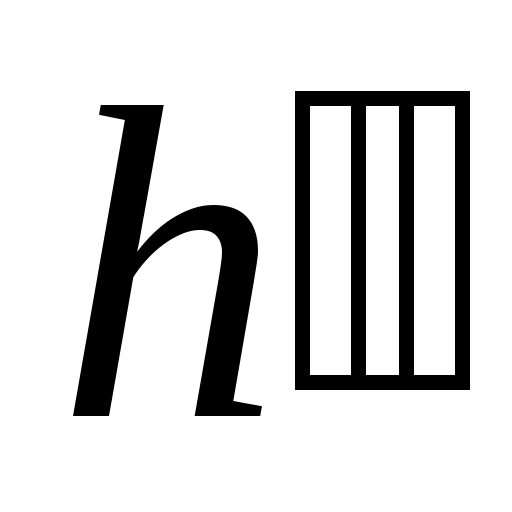 – энтальпия сухого пара. – энтальпия сухого пара.
При зарядке и разрядке аккумулятора горячей водой объем пара в резервуаре значительно увеличивается. Дополнительное количество пара образуется за счет испарения небольшой части воды, что приводит к некоторому снижению давления.
Энергетический баланс имеет вид
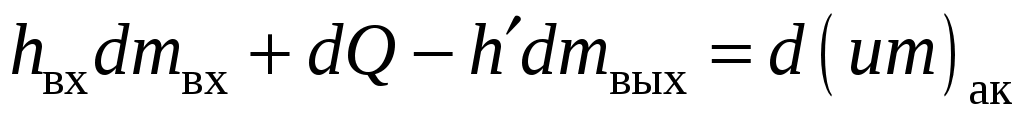 , ,
где 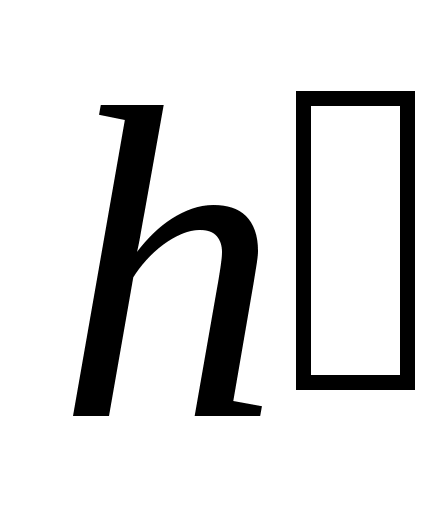 – энтальпия кипящей воды. – энтальпия кипящей воды.
В данном аккумуляторе в отличие от аккумулятора с зарядкой горячим паром массовый расход значительно больше, но циклические изменения температуры и давления меньше.
При косвенном аккумулировании со скользящим давлением разрядка аккумулятора происходит через теплообменник. Аккумулирующая среда при постоянном массе и объеме содержится в закрытом сосуде под давлением. Тогда энергетический баланс имеет вид
 , ,
где 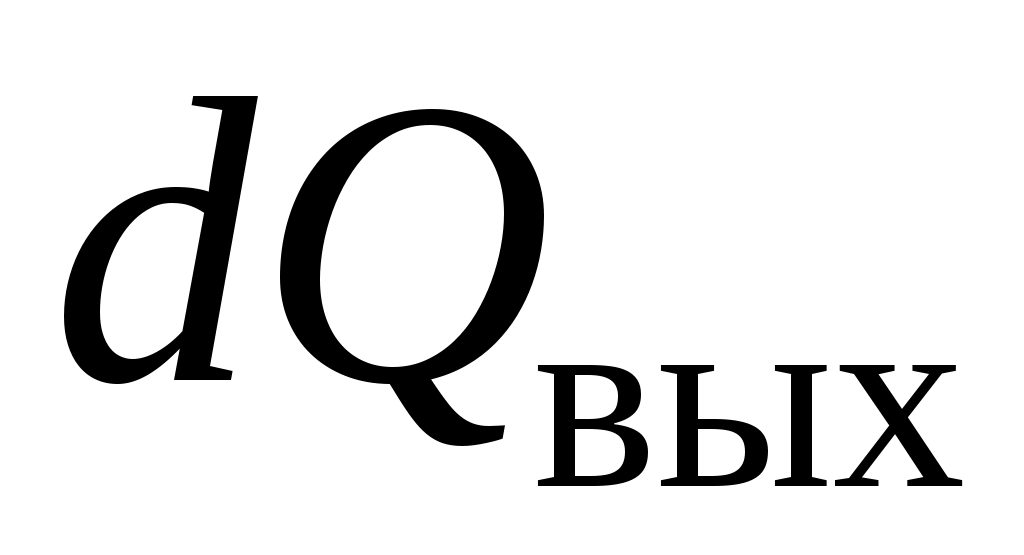 – теплота, переданная аккумулятору через теплообменник. – теплота, переданная аккумулятору через теплообменник.
2. Аккумулятор с ненасыщенной жидкостью под давлением.
В аккумуляторе находится жидкость с давлением выше давления насыщения, что предотвращает вскипание жидкости.
Поскольку 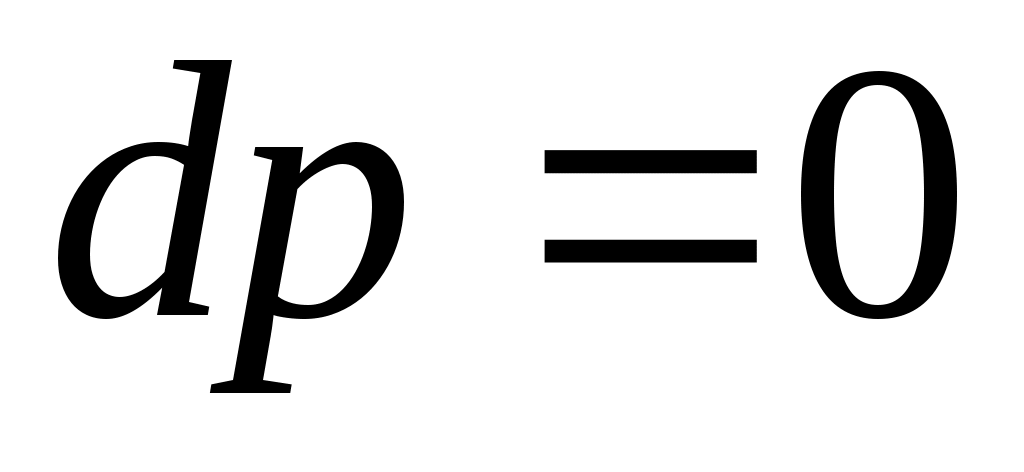 , то , то 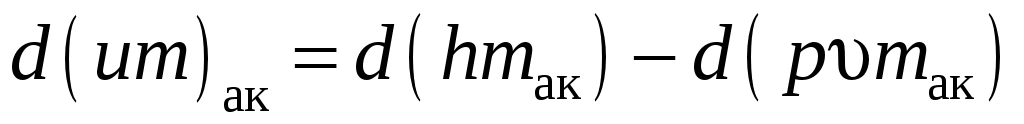 и энергетическое уравнение имеет вид и энергетическое уравнение имеет вид
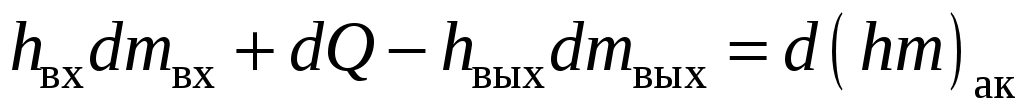 . .
Если разрядка происходит через теплообменник, то 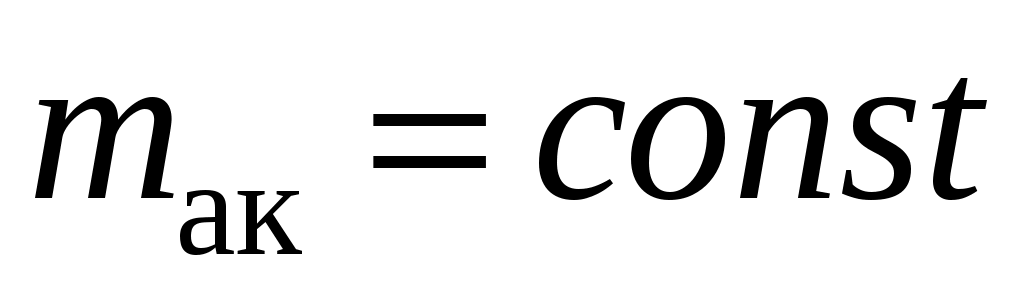 и и
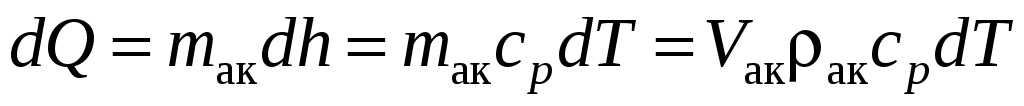 . .
В качестве рабочей среды в данном типе аккумулятора применяют: воду, смеси воды и этиленгликоля (C6H6O2), воды и NaOH, теплопроводящие масло, расплавы солей (KNO3, NaNO3), жидкие металлы (Na, K).
На практике водяные системы аккумулирования применяются в районных теплосетях, системах для нагрева питающей воды тепловых электростанций, системах с расплавленными солями в солнечных электростанциях. Достоинство – простота эксплуатации, недостаток – изменение температуры рабочей среды.
3.Аккумулятор с твердым рабочим телом
В данных аккумуляторах энергия от рабочего тела обычно отбирается другим типом теплоносителя (жидкость или газ). В качестве рабочих сред используют металлы (чугун, сталь, медь, алюминий) и неметаллы (клинкер – огнеупорная глина, окислы алюминия Al2O3, окислы магния MgO, феонит – спеченный порошок окиси железа, керамзит и др.). На данном принципе работают регенеративные теплообменники. Данные типы аккумуляторов широко применяют в составе с промышленными печами.
Достоинство – высокие объемные теплоемкости рабочего тела и возможность использования высоких температур. Основной недостаток – значительные гидравлические сопротивления при прокачке теплоносителя. Кроме того, насадки с произвольной засыпкой рабочего тела при частых температурных циклах могут быть подвержены усадке, а также радиальному расширению, которое может привести к повреждению обшивки сосуда.
4. Аккумулятор с использованием тепла фазового перехода.
При фазовом переходе температура тела не меняется, а изменяется агрегатное состояние вещества (жидкость – газ, твердое тело – жидкость). Поскольку пар является мало теплоемким теплоносителем, то обычно в качестве фазового перехода используют плавление (твердое тело – жидкость).
Энтальпию фазового перехода для неорганических веществ можно определить по формуле
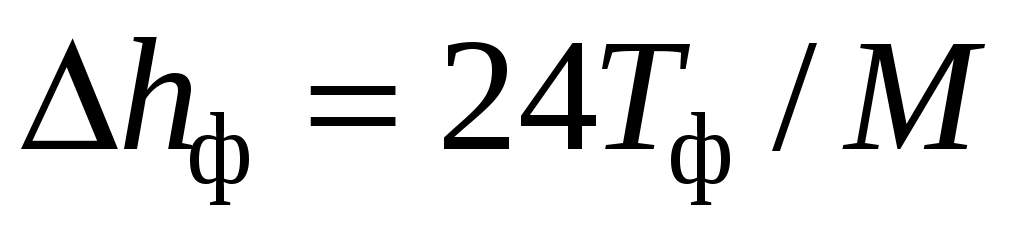 , ,
где Tф – температура фазового перехода (К), М – молекулярная масса (кмоль/кг).
Рабочее вещество – СаСl2·6H2O (Tф = 27,2С), Na2S2O35H2O, глауберовая соль Na2SO410H2O (Tф = 32С) или MgCl26H2O.
Достоинства: высокая объемная теплоемкость, постоянство температуры и низкое давление.
Недостатки: сложность подвода и отвода тепла от рабочего вещества, т.к. в твердом теле конвекция отсутствует, теплопроводность низкая, а объем при фазовом переходе меняется.
Предложены и разработаны системы аккумулирования на основе использования теплоты фазового перехода для зарядки и разрядки воздухом СаСl2·6H2O (Tф = 27,2°С) или водой на Na2S2O35H2O или MgCl26H2O. Каждый теплообменный элемент состоит из внутренней и наружной трубок, тепловой контакт между которыми обеспечивается продольными ребрами из материала с хорошей теплопроводностью (например, алюминия). Кольцевое пространство между ребрами заполнено материалом, аккумулирующим энергию фазового перехода (равную теплоте плавления). В этом варианте система теплового аккумулирования работает как гибридный аккумулятор, в котором используются теплота фазового перехода и теплота нагрева рабочего тела.
5. Сорбционный аккумулятор.
Сорбция – это процесс поглощения одного вещества другим с потреблением тепла.
Например, абсорбент гидрооксид натрия (NaOH) поглощает воду или СaCl2 поглощает NH3 с потреблением тепла 745 кДж/кг.
Энтальпию сорбции можно определить по формуле:
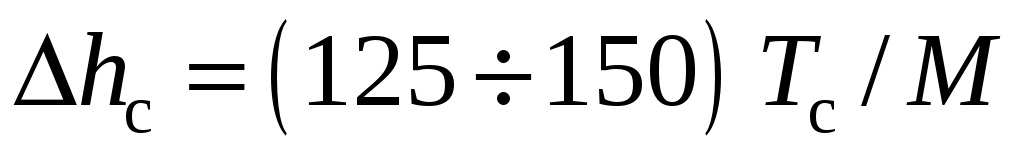 , ,
где Tс – температура сорбции (К), М – молекулярная масса (кмоль/кг).
Недостаток – абсорбирующий материал должен находиться в грануллированном состоянии для улучшения аккумулирования и ускорения реакции. Однако теплопроводность такого материала низкая, что усложняет подвод и отвод тепла.
8.3.2. Аккумулирование в системах солнечного отопления
Теплоснабжение от солнечной радиации имеет регулярный суточный и годовой графики, на которые налагаются случайные изменения, определяемые погодными условиями. При этом существует обратная зависимость между сезонным поступлением солнечной энергии и потребностями обогрева помещения (зимой поступление солнечной энергии низкое, а потребности в обогреве высокие).
Выбор соотношения между размерами солнечного коллектора и аккумулятора для кратковременного (горячая бытовая вода) и долговременного (обогрев) аккумулирования – интересная оптимизационная задача. Общий оптимум получается, когда оптимальны характеристики, как коллектора, так и аккумулятора. Удельные емкости аккумуляторов для кратковременного аккумулирования обычно составляют 50–100 кг воды на 1 м2 площади коллектора, а для долговременного аккумулирования в климатических условиях Центральной Европы необходимы значения удельной емкости 1000 кг/м2.
Солнечный бассейн это система аккумулирования с использованием горячего теплоносителя, в которой коллектор и аккумулятор совмещены (рис. 8.2). Солнечная радиация поглощается донной поверхностью бассейна. В теплоносителе создается и поддерживается градиент концентрации соли (концентрация увеличивается с глубиной) между верхним конвективным слоем (под действием ветра) и нижним конвективным слоем (в результате отвода тепла). Благодаря этому конвекция и связанный с ней теплоотвод к поверхности подавляются, и слой толщиной 1 м, в котором нет конвекции, служит тепловой изоляцией.
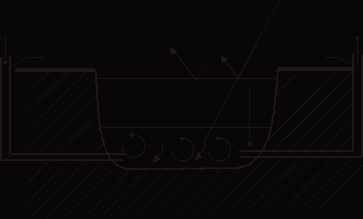
Рис. 8.2. Схема солнечного бассейна с градиентом концентрации соли:
1 – неконвективный (изолирующий) слой,
2 – конвективная (аккумулирующая) область,
3 –– подача холодного соляного раствора в бассейн,
4 – выход горячего соляного раствора к потребителю тепла.
Таким способом можно достичь температуры воды 100°С, а 90°С является обычным расчетным значением в зонах с жарким климатом. Осенью, когда температура воздуха понижается до 0 С происходит резкое охлаждение верхнего слоя бассейна. С образованием водяного покрова теплоотдача в атмосферу резко сокращается, а придонные температуры остаются довольно высокими.
Крупные сезонные тепловые аккумуляторы энергии. Системы солнечного обогрева в широтах РБ нуждаются в сезонном тепловом аккумулировании. Для больших (более 10000 м3) сезонных аккумуляторов можно использовать стальные мембранные резервуары, полости в скальных породах или глине, водоносные слои, которые находятся между двумя ограничивающими пластами, а так же водные бассейны.
8.4. Химическое аккумулирование
Энергия может удерживаться в связях многих химических элементов и выделяться в процессе экзотермических реакций, из которых наиболее известно окисление кислородом (горение). Биологическое естественное аккумулирование (т.е. акуумулирование энергии в биологических и ископаемых горючих материалах) является самым эффективным аккумулированием с высокой плотностью энергии. Однако процесс зарядки энергии при таком типе аккумулирования слишком долгий. В данной главе будут рассмотрены лишь аккумуляторы на неорганических соединениях.
Термохимическое аккумулирование основано на использование энергии связей обратимых химических реакций. Например
MgCO3(тв.) + 1,2 МДж/кг = MgO(тв.) + CO2(г.)
Ca(OH)2(тв.) +1,4 МДж/кг = CaO(тв.) + H2O(г.)
SO3(г.) +1,2 МДж/кг = SO2(г.) +0,5O2(г.)
CH4(г.) + H2O(г.) + 6,05 МДж/кг = CO2(г.) +3H2(г.)
H2O(г.)+120 МДж/кг = H2+0,5O2
Наиболее привлекательным является использование водородного аккумулятора. Во-первых, в Мировом океане содержится 1,2×1013 тонн водорода. Суммарная масса водорода составляет 1% от общей массы Земли. Но самое важное – это то, что водород при сгорании превращается в воду и возвращается в круговорот веществ в природе (не возникает парникового эффекта). Водород легко улетучивается, а значит не возникает застойных взрывоопасных зон. Теплота сгорания водорода в 2,8 раза выше по сравнению с бензином. Энергия воспламенения водорода в 15 раз меньше, чем для углеводородного топлива. В виде газа он может быть накоплен и передан на большие расстояния без существенных затрат (перекачка водорода дешевле, чем передача электроэнергии по проводам).
У водородного топлива также есть недостатки: водород более взрывоопасен, чем, например, метан. Объемная теплота сгорания водорода в три раза меньше, чем у природного газа.
Имеется несколько способов получения водорода: электролиз и высокотемпературное нагревание.
Электролиз наиболее отработанный способ получения водорода, однако, эффективность этого способа не превышает 60%. Основные потери энергии при электролизе связаны с возникновением пузырьков газа вблизи электродов, препятствующих перемещению ионов в электролите и увеличивающих общее сопротивление электрической цепи. При электролизе для получения одного кубометра водорода требуется 4–5 кВтч электроэнергии. Производство количества бензина с той же теплотой сгорания обходится примерно втрое дешевле.
Для высокотемпературного разложения воды необходимо к ней приложить энергию (называемой энергией Гибса), которую можно определить по формуле
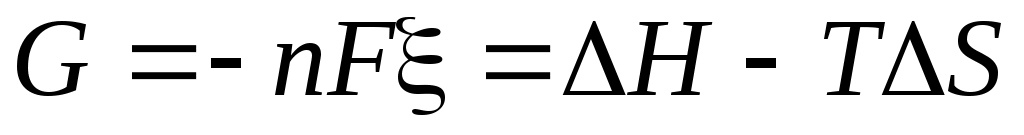 , ,
где – электрический потенциал, S – изменение энтропии, F = 96500 Кл/моль – постоянная Фарадея, n – количество молей вещества вступивших в реакцию.
Разложение воды будет происходить при = 0 и T = 2700 К.
Один из недостатков использования водорода в энергетики – это сложность его хранения, так как в газообразном состоянии (даже под высоким давлением) он занимает большие объемы. Для решения этой проблемы предложены следующие способы: хранить водород в сжиженном состоянии (температура конденсации 20 К), в виде металлогидридов
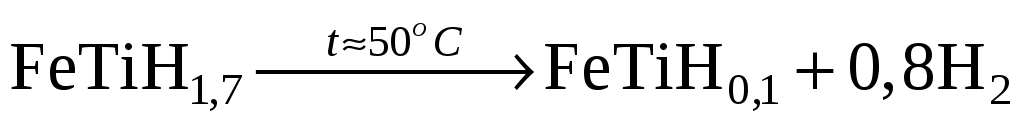 . .
Однако для сжижения водорода нужно потратить почти половину энергии, содержащейся в нем самом. Кроме того, должна быть обеспечена идеальная теплоизоляция.
8.5. Электрохимическое аккумулирование
Электричество это наиболее совершенная форма энергии, и поэтому в направлении поисков дешевых и эффективных методов аккумулирования электрической энергии делаются значительные усилия. Устройство, допускающее как поглощение, так и выдачу электроэнергии называют электрическим аккумулятором.
Хотя многие электрохимические реакции обратимы, только некоторые из них на практике подходят для создания аккумуляторов, которые допускали бы сотни циклов зарядки и разрядки при токах от 1 до 100 А. Наиболее известен и широко используется свинцово-кислотный аккумулятор, изобретенный Планте в 1860 г.
Свинцово-кислотный аккумулятор состоит из двух пластинок-электродов (свинец и диоксид свинца.), помещенных в проводящий раствор-электролит (серная кислота).
Электрический ток в электролите поддерживается ионами аккумулятора диссоциированой серной кислоты
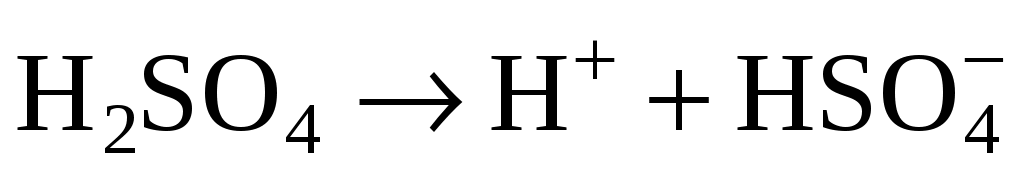 . .
В процессе разряда аккумулятора на отрицательном электроде идет реакция
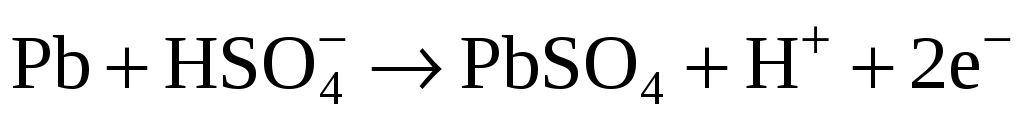 . .
При этом полученный сульфат свинца замещает свинцовую пасту в ячейках электрода, а освобожденные в этой реакции электроны перемещаются по внешней цепи к положительному электроду, где вступают в реакцию:
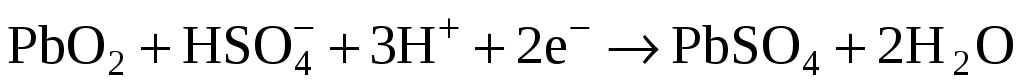 . .
Освобожденный сульфат свинца аналогичным образом замещает оксид свинца на положительном электроде.
Свинцово-кислотный аккумулятор имеет ряд недостатков:
низкую плотность энергии, т.е. плотность энергии на единицу веса аккумулятора,
низкий КПД,
небольшой срок службы (около трех лет).
Низкая плотность энергии реального аккумулятора (0,06 МДж/кг – 15% от идеального кислотно-свинцового аккумулятора) обусловлена тем, что реальный аккумулятор обязательно содержит неактивные элементы: корпус, сепараторы (предотвращающие короткое замыкание между электродами), воду, в которой растворена кислота (концентрация кислоты не должна быть слишком большой, чтобы аккумулятор не разряжался сам на себя).
Низкий КПД обусловлен тем, что нельзя допустить, чтобы реакция в аккумуляторе шла до полного завершения. Если весь свинец вступит в реакцию, то не станет электрода, на котором должна пойти обратная реакция. Аналогично, нельзя позволить концентрации соляной кислоты упасть до слишком низкого значения: электролит перестанет быть проводником. На практике нельзя допускать разряда аккумулятора более чем на 50%.
Небольшой срок службы аккумулятора обусловлен двумя причинами.
Поскольку твердый свинец имеет почти в два раза большую плотность, чем участвующий в реакциях при разряде сульфат свинца PbSO4, то часть сульфата свинца не может поместиться в ячейках на отрицательном электроде и выпадает в осадок на дно аккумулятора. Это приводит к невосполнимым потерям активного вещества.
В некоторых аккумуляторах (например, автомобильных) для прочности сетки электродов делают не из чистого свинца, а из сплава свинца с сурьмой. К сожалению, наличие сурьмы ведет к саморазряду аккумулятора:
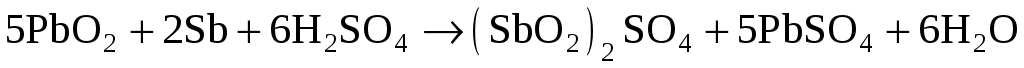 . .
Данная реакция достаточно медленно, но необратимо уничтожает активный материал аккумулятора. В аккумуляторах стационарного типа (например, для ветроустановок или осветительных систем) можно применять электроды без сурьмы, что увеличивает срок службы аккумулятора до семи лет. |
|
|
 Скачать 6.34 Mb.
Скачать 6.34 Mb.