Лекция по теме:"Белки"_2009. Курс лекций по общей биохимии модуль Биохимия белков и аминокислот Автор к б. н., доцент кафедры биохимии Гаврилов И. В
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
| ||||||||||||||||||||||||||||||||||||||||||
| Аминокислоты (АК) – органические соединения, содержащие –СООН и -NH2 в α-положении. Почти все АК имеют хиральный атом и обладают оптической изомерией. У человека присутствуют L-аминокислоты. | 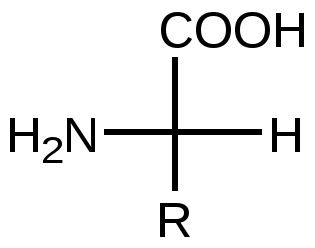 |
Всего известно около 300 видов АК, у человека в организме - 70, а в составе белков - 20.
Физико-химические свойства аминокислот
АК белые кристаллические вещества, хорошо растворимые в воде. Имеют высокую температуру плавления, в твердом состоянии находятся в виде внутренней соли. Многие сладкие на вкус (гли).
АК амфотерные вещества – проявляют свойства кислот и оснований.
К наиболее важным общим реакциям АК относятся реакции:
декарбоксилирования,
переаминирования,
дезаминирования,
образование пептидных связей
образование оснований Шиффа (при гликозилировании белков).
Специфические реакции АК связаны с наличием функциональных групп в радикале (окислительно-восстановительные реакции цис).
Существует несколько классификаций аминокислот.
Классификация АК по природе радикала: 1). алифатические (гли, ала, вал, лей, иле и.т.д.); 2). ароматические (фен, тир, три, гис); 3). гетероциклические (про, оксипро).
Классификация АК по количеству карбоксильных и аминогрупп: 1). нейтральные; 2). кислые (глу, асп); 3) основные (арг, лиз).
Классификация АК по функциональным группам в радикале: 1). содержащие –ОН (сер, тре); 2). содержащие –SH (цис, мет); 3). содержащие –СОNH2 (глн, асн);
Классификация АК по способности к синтезу:
АК, которые синтезируются в организме, называют заменимыми (глицин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, серии, пролин, аланин).
АК, которые не синтезируются в организме, но для него необходимы, называются незаменимыми (фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин).
Аргинин и гистидин - частично заменимыеАК, у взрослых они образуются в достаточных количествах, а у детей - нет. Поэтому, необходимо дополнительное поступление этих АК с пищей.
Тирозин и цистеин — условно заменимые, так как для их синтеза необходимы незаменимые АК (фенилаланин и метионин).
Функции аминокислот
Используются для синтеза белков, углеводов, липидов, нуклеиновых кислот, биогенных аминов (гормонов, нейромедиаторов), других аминокислот
Служат источником азота при синтезе всех азотсодержащих небелковых соединений (нуклеотиды, гем, креатин, холин и др);
Выполняют регуляторную функцию (гли, глу - нейромедиаторы);
служат источником энергии для синтеза АТФ.
ПУТИ ОБРАЗОВАНИЯ ПУЛА АМИНОКИСЛОТ В КРОВИ
И ЕГО ИСПОЛЬЗОВАНИЕ В ОРГАНИЗМЕ
Большая часть аминокислот организма человека, примерно 15кг, входит в состав белков. Фонд свободных АК организма составляет примерно 35г.
Источниками АК в организме являются белки пищи, белки тканей и синтез АК из углеводов. В сутки у человека распадается на АК около 400г белков, примерно такое же количество синтезируется. Специальной формы депонирования АК, подобно глюкозе (в виде гликогена) или жирных кислот (в виде ТГ), не существует (исключение - казеин молока). Поэтому резервом АК служат все белки тканей, но преимущественно белки мышц (т.к. их много).
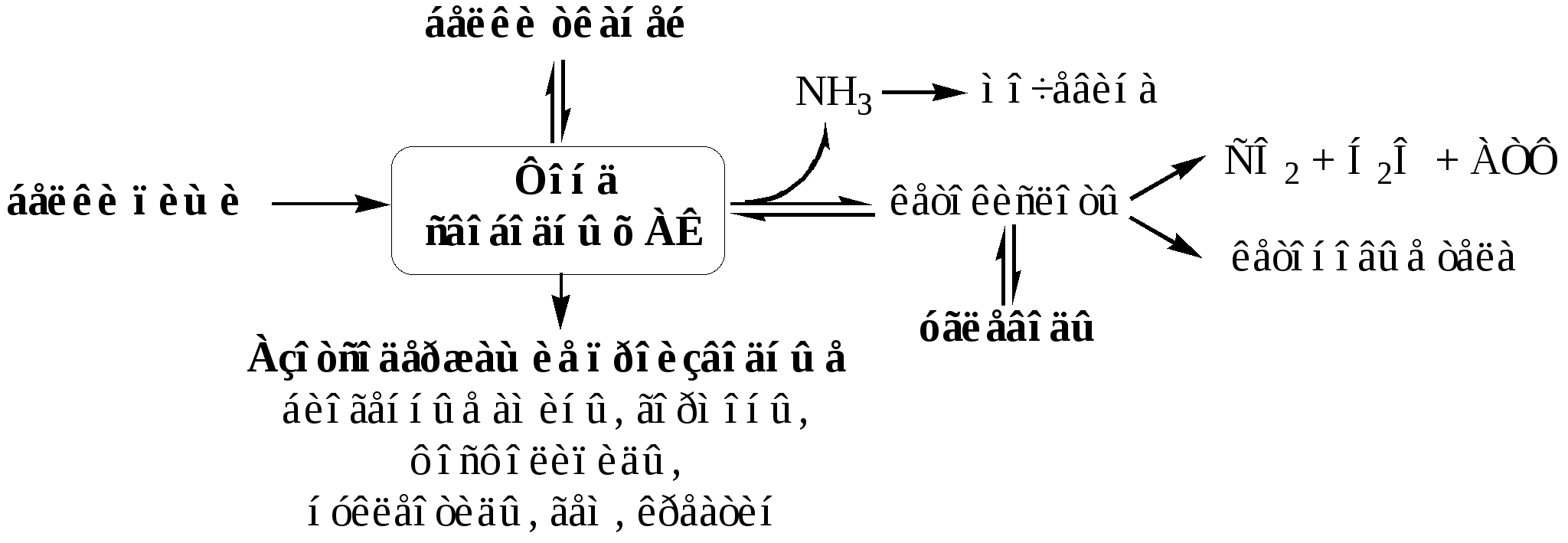
ОБЩИЕ РЕАКЦИИ ОБМЕНА АМИНОКИСЛОТ
АК, появившиеся в организме, включаются в общие и специфические реакции обмена.
К общим реакциям обмена АК относят реакции трансаминирования, дезаминирования и декарбоксилирования, биосинтеза белков и рацемизации (L переходы D).
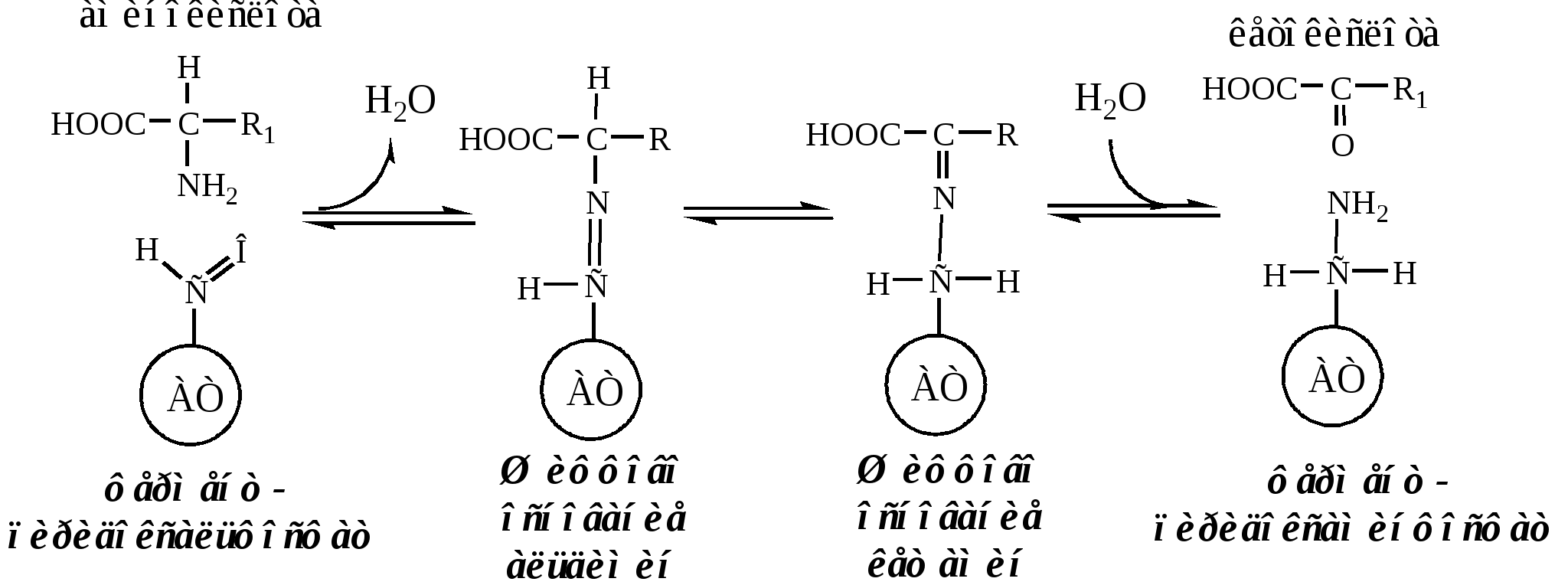
ТРАНСАМИНИРОВАНИЕ (ПЕРЕАМИНИРОВАНИЕ) АМИНОКИСЛОТ
Трансаминирование — реакция переноса α-аминогруппы с АК на α-кетокислоту, в результате чего образуются новая α-кетокислота и новая АК. Процесс трансаминирования легко обратим, при нем общее количество АК в клетке не меняется.
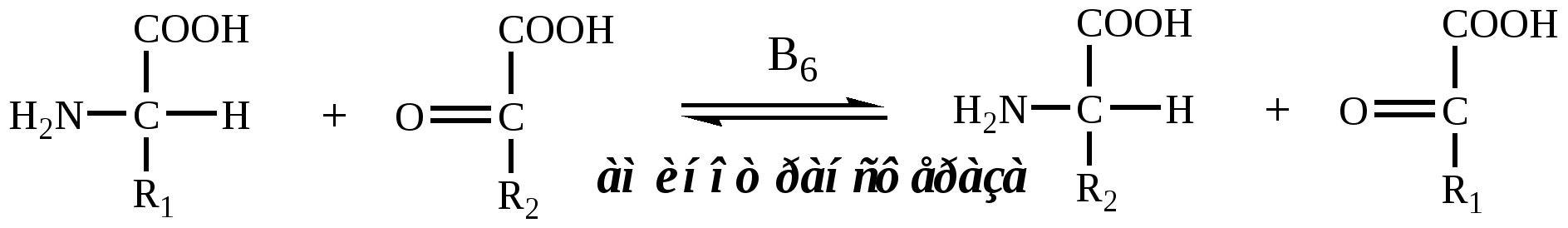
| Реакции катализируют аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6 (пиридоксина). | 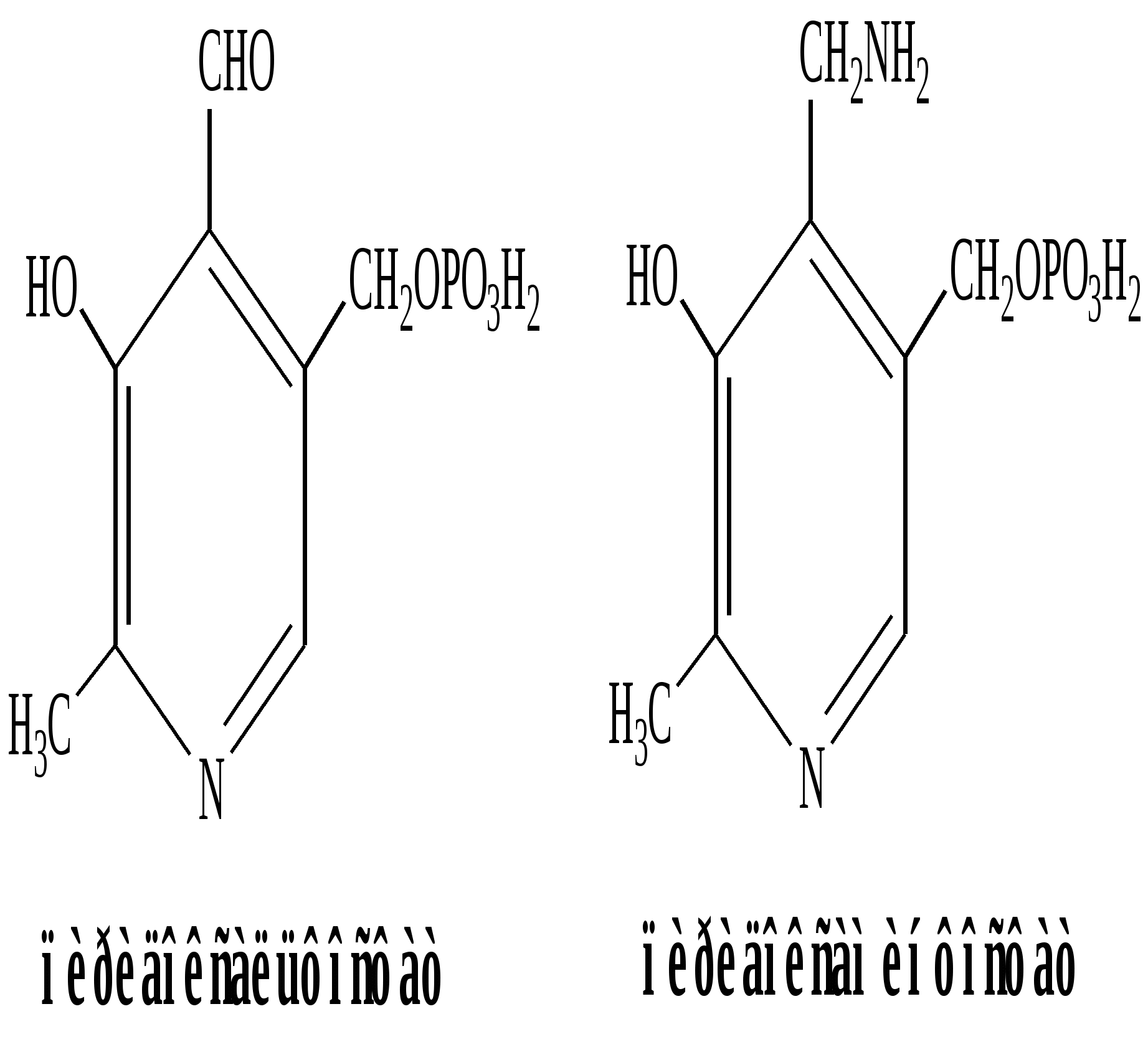 |
У человека найдено более 10 аминотрансфераз, которые локализуются в цитоплазме и митохондриях клеток. В реакции трансаминирования вступают почти все АК, за исключением лизина, треонина и пролина.
Механизм переаминирования

Вначале, АК передает свою аминогруппу на пиродоксальфосфат. АК при этом превращается в кетокислоту, а пиродоксальфосфат - в пиридоксаминфосфат.
Затем, реакции идут в обратную сторону: но уже другая кетокислота, принимает аминогруппу от пиридоксаминфосфата и превращается в новую АК, а пиридоксаминфосфат в пиродоксальфосфат.
Органоспецифичные аминотрансферазы АЛТ и АСТ
Чаще всего в трансаминировании участвуют АК и кетокислоты, которых много в организме — глу, ала, асп, α-КГ, ПВК и ЩУК. Основным донором аминогруппы служит глу, а кетогруппы - α-КГ.
Наиболее распространёнными аминотрансферазами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (ACT).
АЛТ катализирует реакцию трансаминирования между ала и α-КГ: ала+α-КГ↔ПВК+глу АЛТ локализуется в цитозоле клеток многих органов, больше всего ее в клетках печени и миокарде.
ACT катализирует реакцию трансаминирования между асп и α-КГ: асп+α-КГ↔ЩУК+глу
ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее ее количество обнаружено в миокарде и печени.
АСТ и АЛТ являются органоспецифичными ферментами, их определяют в крови для диагностики заболеваний печени, сердца и, в меньшей степени, скелетных мышц. Соотношение активностей АСТ/АЛТ называют «коэффициент де Ритиса». В норме он равен 1,33±0,42.
При инфаркте миокарда активность ACT в крови увеличивается в 8—10 раз, а АЛТ — в 1,5—2,0 раза, коэффициент де Ритиса резко возрастает.
При гепатитах активность АЛТ в сыворотке крови увеличивается в - 8—10 раз по сравнению с нормой, a ACT — в 2—4 раза. Коэффициент де Ритиса снижается до 0,6.
Биологическое значение трансаминирования
Реакции трансаминирования обеспечивают синтез и распад амино- и кетокислот, перераспределение аминного азота в тканях организма.
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
Дезаминирование АК — реакция отщепления α-аминогруппы от АК, в результате чего образуется соответствующая α-кетокислота и выделяется молекула аммиака.
Дезаминирование бывает прямым и непрямым.
Прямое дезаминирование АК
Прямое дезаминирование - это дезаминирование, которое происходит в 1 стадию с участием одного фермента. Прямому дезаминированию повергаются глу, гис, сер, тре, цис.
Существует 5 видов прямого дезаминирования АК:
окислительное;
неокислительное;
внутримолекулярное;
восстановительное;
гидролитическое.
Окислительное дезаминирование - самый активный вид прямого дезаминирования АК.
1. Глутаматдегидрогеназа (глу-ДГ) - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД), содержит кофермент НАД+. Глу-ДГ катализирует обратимое дезаминирование глу, очень активна в митохондриях клеток практически всех органов, кроме мышц. Глу-ДГ аллостерически ингибируют АТФ, ГТФ, НАДH2, активирует избыток АДФ. Индуцируется Глу-ДГ стероидными гормонами (кортизолом).
Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата, затем — неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α-кетоглутарат. При избытке аммиака реакция протекает в обратном направлении (как восстановительное аминирование α-кетоглутарата).
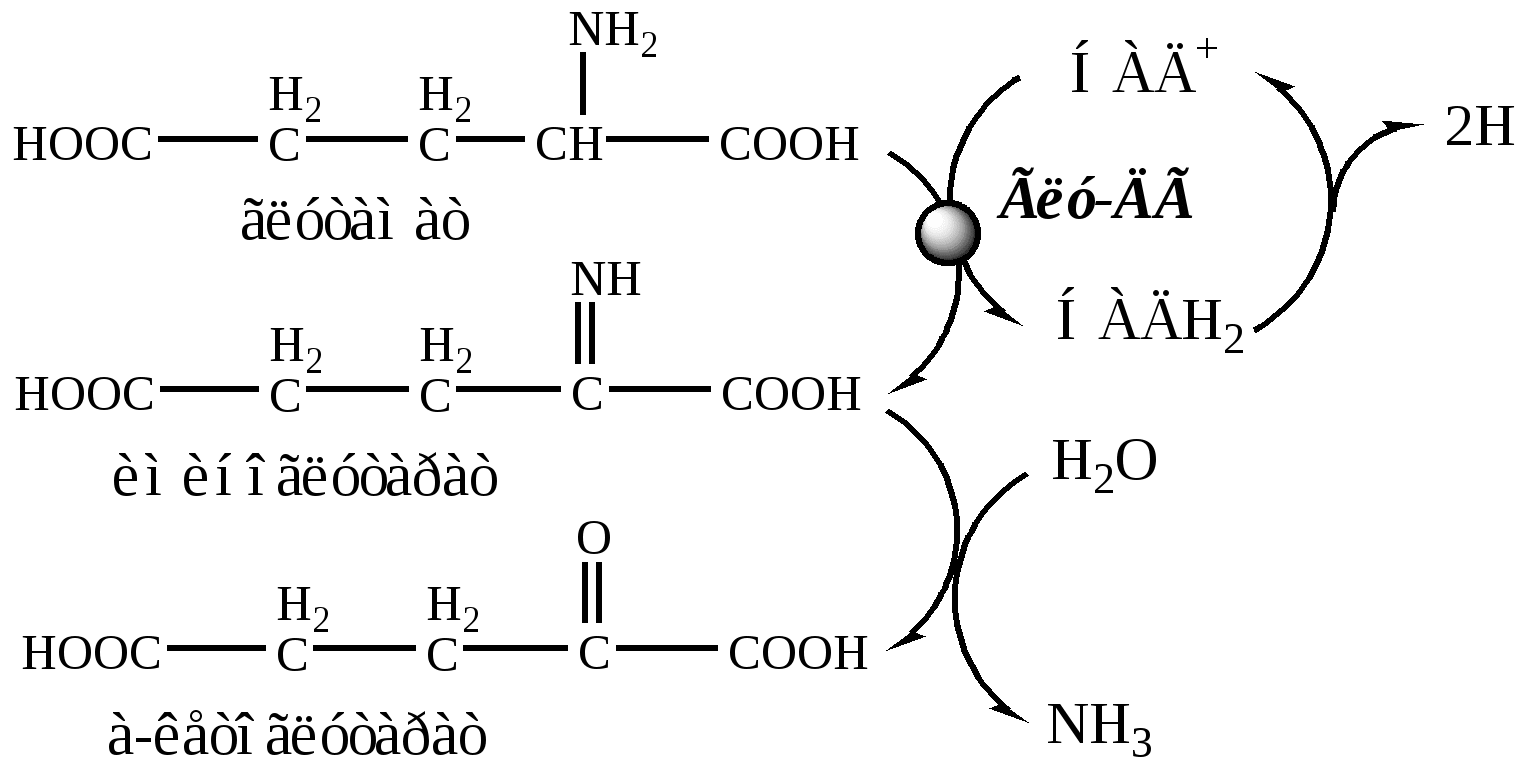
Глу + НАД+ + Н2О ↔ α-КГ + НАДН2 + NH3
2. Оксидаза L-аминокислот
В печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-аминокислоты:
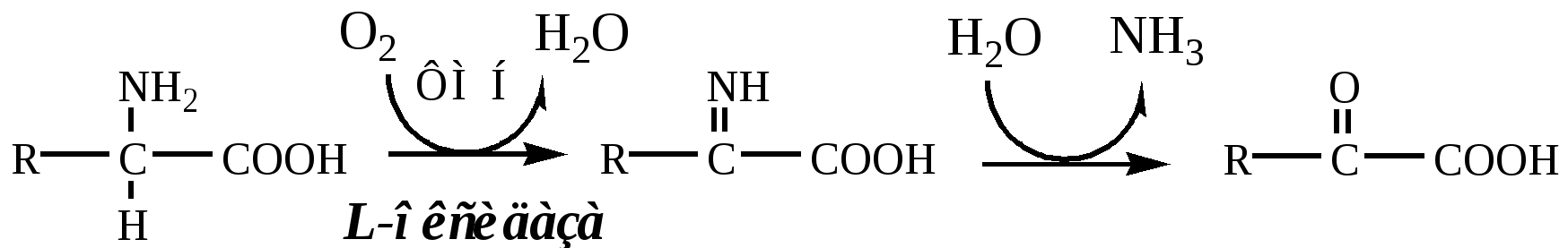
Оксидаза L-АК имеет кофермент ФМН. Т.к. оптимум рН оксидазы L-АК равен 10,0, активность фермента очень низка и вклад ее в дезаминирование незначителен.
3. Оксидаза D-аминокислот
Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-зависимый фермент, с оптимумом рН в нейтральной среде. Оксидаза D-аминокислот превращает, спонтанно образующиеся из L-аминокислот, D-аминокислоты в кетокислоты.
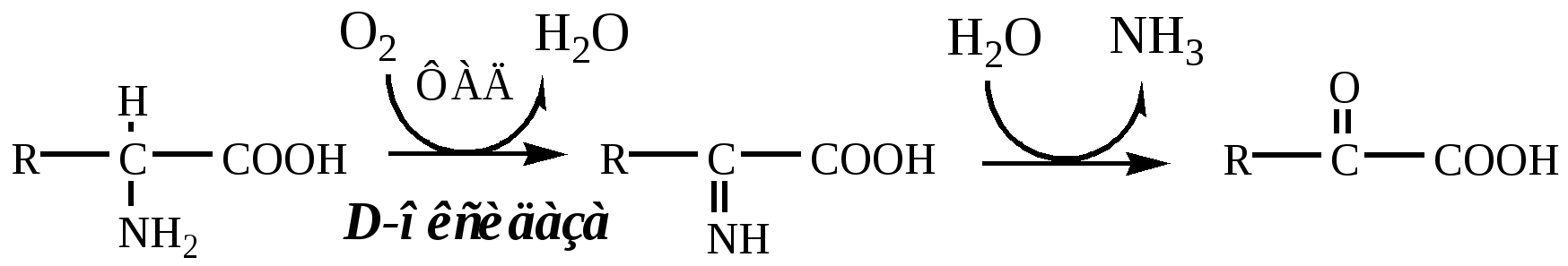
Неокислительное дезаминирование
В печени человека присутствуют специфические пиридоксальфосфатзависимые ферменты сериндегидратаза, треониндегидратаза, катализирующие реакции неокислительного дезаминирования аминокислот серина и треонина.
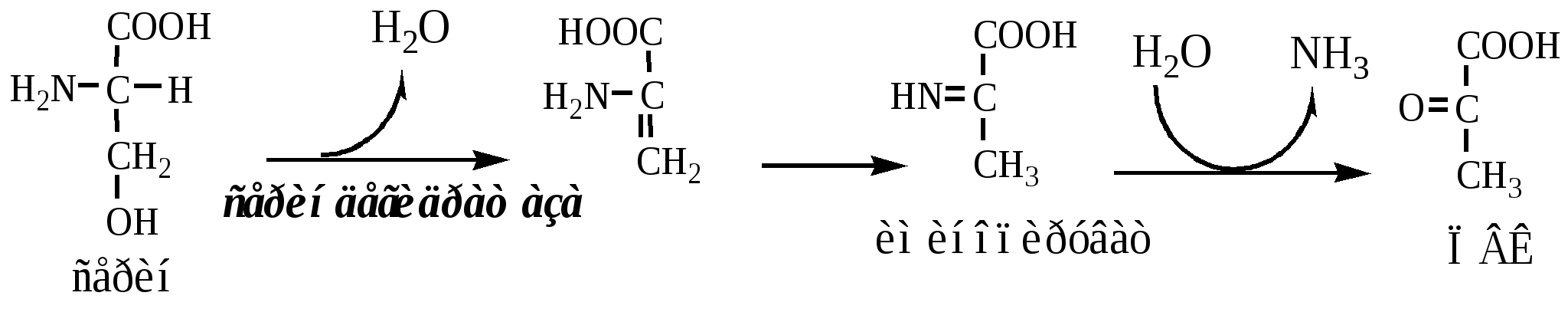
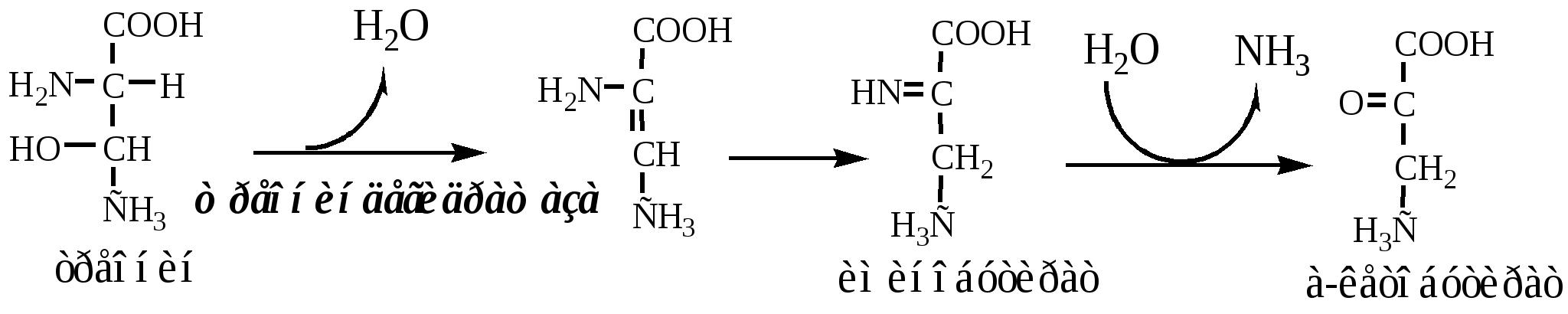
Внутримолекулярное дезаминирование
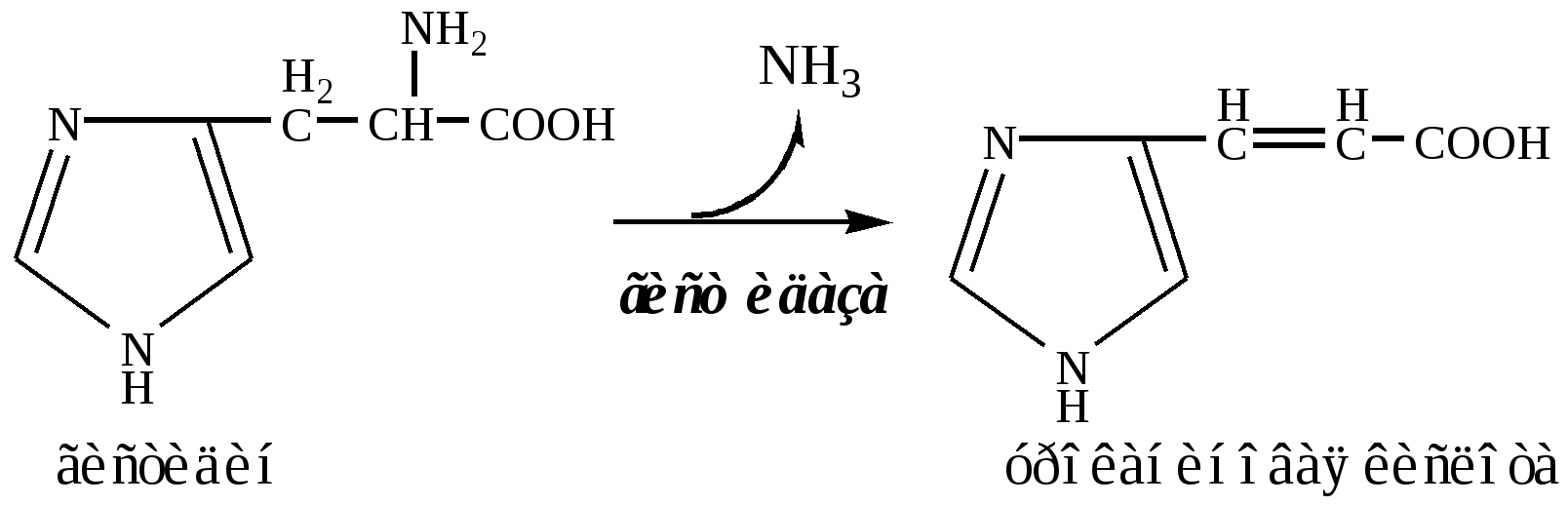
Внутримолекулярное дезаминирование характерно для гистидина. Реакцию катализирует гистидаза (гистидин-аммиаклиаза). Эта реакция происходит только в печени и коже.
Непрямое дезаминирование (трансдезаминирование) АК
Непрямое дезаминирование - это дезаминирование, которое происходит в 2 стадий с участием нескольких ферментов. Оно характерно для большинства АК, так как они не способны к прямому дезаминированию (нет ферментов).
На первой стадии происходит одна и несколько реакций переаминирования с участием аминотрансфераз, в результате аминогруппа АК переходит на кетосоединение (α-КГ, ИМФ).
На второй стадии происходит реакция дезаминирования аминосоединения (глу, АМФ), в результате чего образуется аммиак.
Последовательность реакций непрямого дезаминирования зависит от набора ферментов в тканях.
Непрямое дезаминирование в печени
Непрямое дезаминирование АК происходит при участии 2 ферментов: аминотрансферазы и глу-ДГ. Аминогруппы АК в результате трансаминирования переносятся на α-КГ с образованием глутамата, который затем подвергается прямому окислительному дезаминированию.

Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм АК, так и возможность образования практически любой АК из соответствующей α-кетокислоты.
При энергодефиците АДФ активирует Глу-ДГ, что усиливает катаболизм АК и образование а-кетоглутарата, поступающего в ЦТК как энергетический субстрат.
Таким образом, Глу-ДГ играет ключевую роль в регуляции обмена АК и энергии.
Непрямое дезаминирование в мышцах (и нервной ткани)
В мышечной ткани активность глу-ДГ низка, поэтому при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ.

Можно выделить 4 стадии этого процесса:
трансаминирование с а-кетоглутаратом, образование глутамата (аминотрансфераза);
трансаминирование глутамата с ЩУК, образование аспартата (АСТ);
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата (аденилосукцинасинтаза и аденилосукцинатлиаза);
гидролитическое дезаминирование АМФ (АМФ-дезаминаза).
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
Пути обмена безазотистого остатка аминокислот
За сутки у человека распадаются примерно 100г АК. Катаболизм всех АК сводится к образованию шести веществ, вступающих в общий путь катаболизма: ПВК, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат и ЩУК. Эти вещества окисляются в ЦТК для образования АТФ или используются для синтеза глюкозы и кетоновых тел.
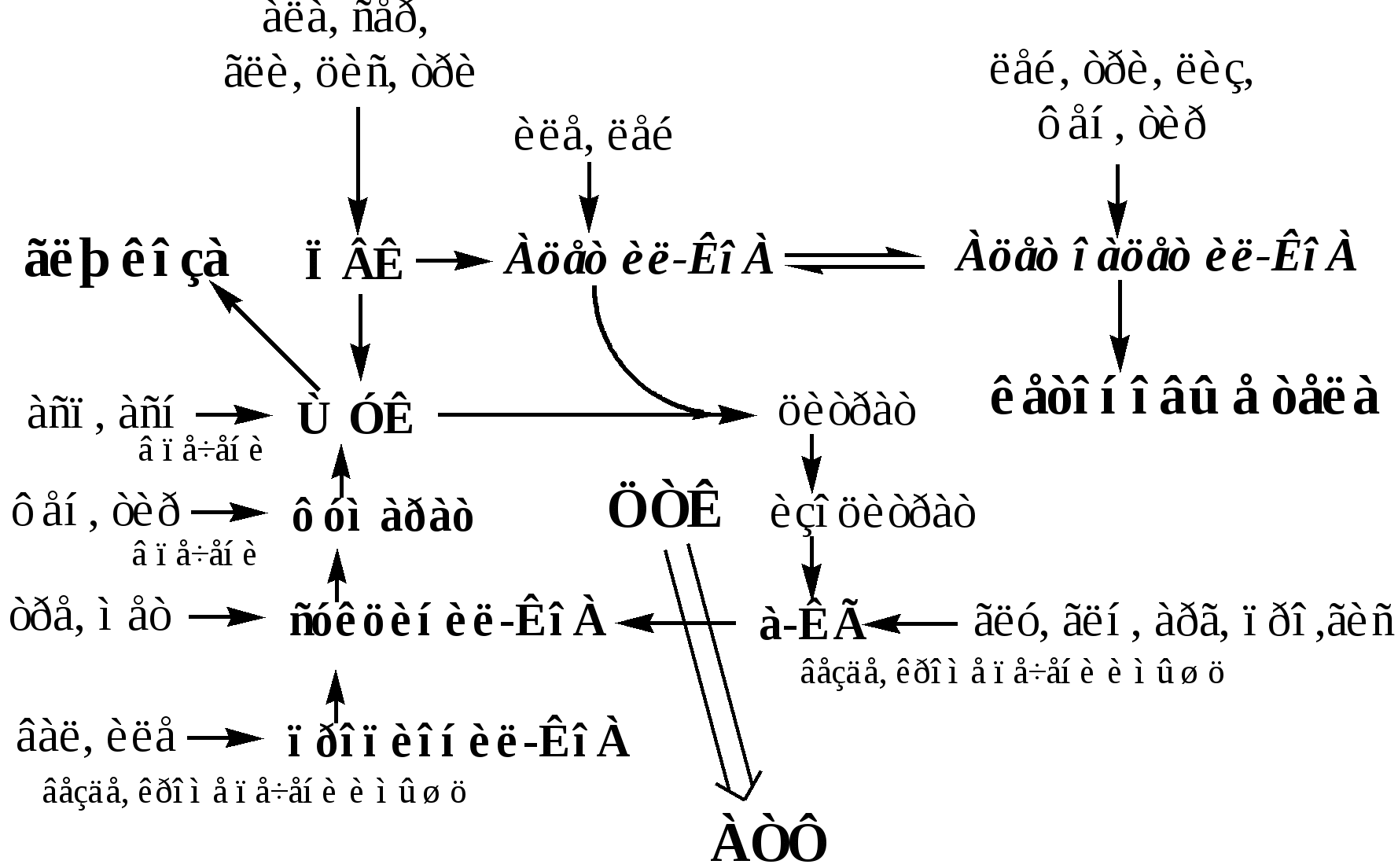
Гликогенные аминокислоты - АК, которые превращаются в ПВК и промежуточные продукты ЦТК (а-КГ, сукцинил-КоА, фумарат, ЩУК). Они через ЩУК, используются в глюконеогенезе (ала, асн, асп, гли, глу, глн, про, сер, цис, арг, гис, вал, мет, тре).
Кетогенные аминокислоты – АК, которые в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел.
Смешанные (глико-кетогенными) аминокислоты – АК, при катаболизме которых образуются метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Эти АК используются для синтеза глюкозы и кетоновых тел.
ОБМЕН АММИАКА
Аммиак в организме образуется:
при дезаминировании АК во всех тканях (много);
при дезаминировании биогенных аминов и нуклеотидов во всех тканях (мало);
при дезаминировании АМФ в интенсивно работающей мышце;
при гниении белков в кишечнике.
Концентрация аммиака
Концентрация аммиака в сыворотке крови в норме 11—35 мкмоль/л. В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония — NH4+, количество неионизированного NH3 невелико ( 1%).
Токсичность аммиака
Аммиак — токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и, прежде всего на ЦНС.
Механизм токсического действия аммиака:
Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глу-ДГ, в сторону образования глу:
α-Кетоглутарат + НАДH2 + NH3 → глу + НАД+.
Уменьшение концентрации α-кетоглутарата вызывает:
угнетение реакции трансаминирования АК и снижение синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
снижения скорости ЦТК и развитие энергодефицита.
Недостаточность α-кетоглутарата ускоряет реакции синтеза ЩУК из ПВК, сопровождающейся интенсивным потреблением СО2 (особенно характерны для клеток головного мозга).
Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону, вызывает алкалоз. Алкалоз увеличивает сродство гемоглобина к кислороду, что препятствует отдачи им кислорода. В результате развивается гипоксия тканей, энергодефицит, от которого главным образом страдает головной мозг.
Высокие концентрации аммиака, при участии глутаминсинтетазы, стимулируют синтез глутамина из глутамата в нервной ткани:
Глу + NH3 + АТФ → Глн + АДФ + Н3РО4. Накопление глн в клетках нейроглии приводит к повышению в них осмотического давления, набуханию астроцитов и в больших концентрациях вызвает отёк мозга. Снижение концентрации глу нарушает обмен АК и нейромедиаторов, в частности синтез γ-аминомасляной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
Ион NH4+ практически не проникает через цитоплазматические и митохондриальные мембраны. Избыток NH4+ в крови нарушает трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
Низкие концентрации аммиака стимулируют дыхательный центр, а высокие – угнетают.
Связывание (обезвреживание) аммиака
В связи с токсичностью аммиака в тканях происходит его связывание с образованием нетоксичных соединений – АК и мочевины. Процесс образования и обезвреживания аммиака регулируют в основном ферменты глутаматдегидрогеназа и глутаминсинтетаза.
Обмен глутамата
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию.
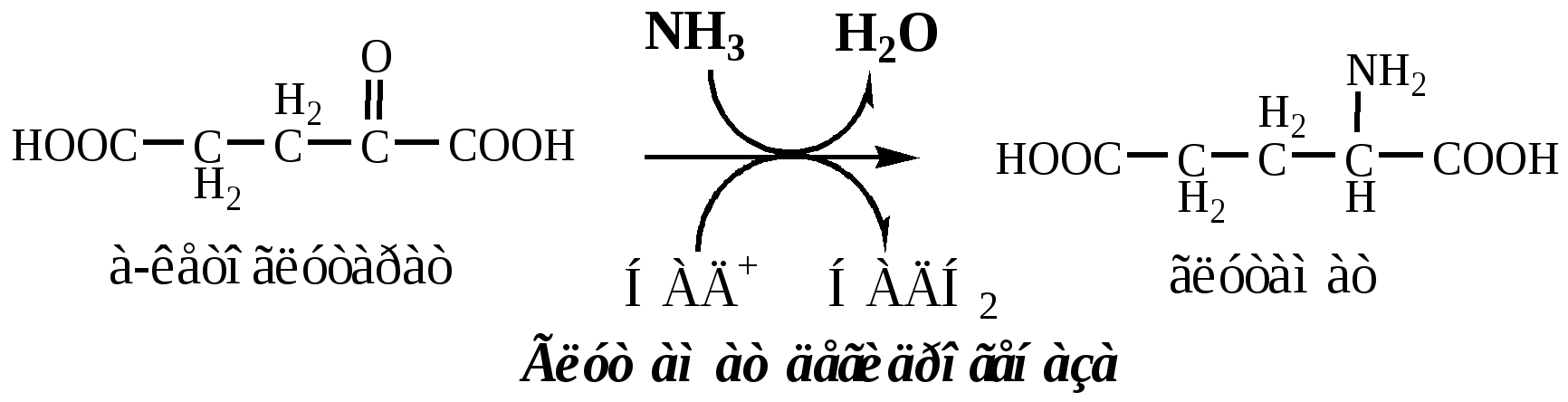
Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Обмен глутамина
Основной реакцией связывания аммиака, протекающей во всех тканях организма (основные поставщики мышцы, мозг и печень), является синтез глутамина под действием глутаминсинтетазы:
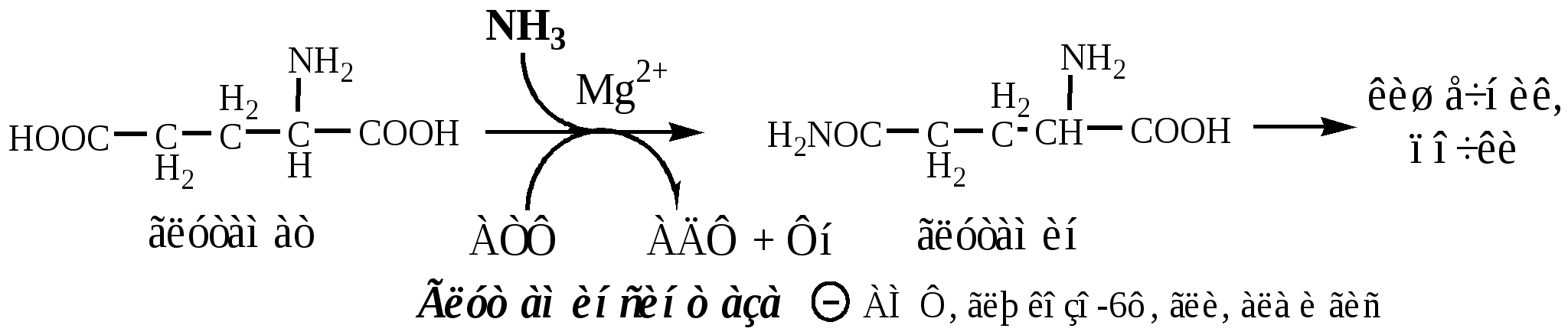
Глутаминсинтетаза находиться в митохондриях клеток, содержит кофактор — ионы Mg2+, является одним из основных регуляторных ферментов обмена АК. Она аллостерически ингибируется АМФ, глюкозо-6ф, гли, ала и гис.
Глутамин, путём облегчённой диффузии, легко проходит клеточные мембраны (для глутамата возможен только активный транспорт), поступает из тканей в кровь и транспортируется в кишечник и почки.
В почках происходит гидролиз глутамина под действием глутаминазы с образованием аммиака:
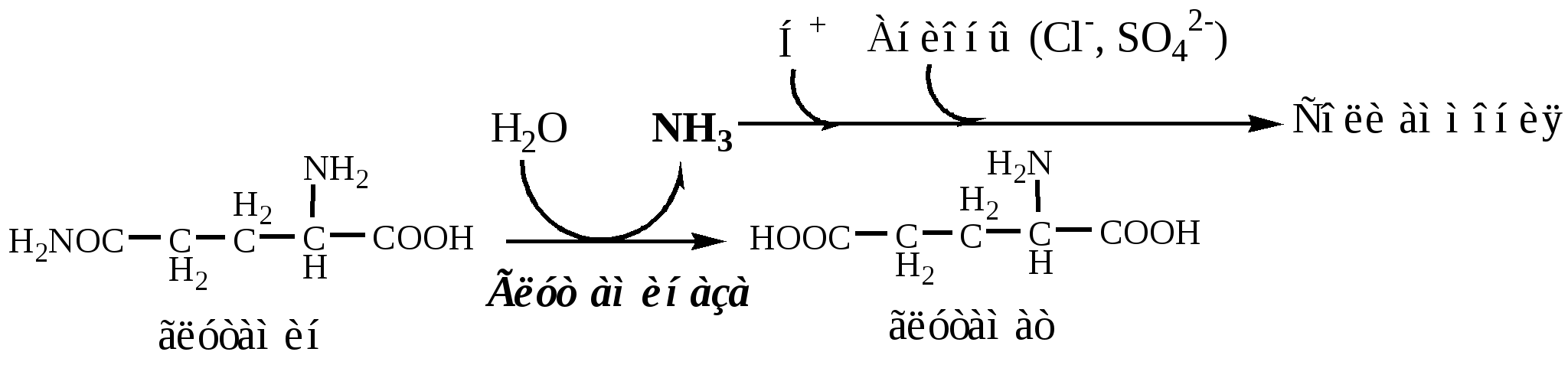
Аммиак с протонами и анионами образует соли аммония (0,5 г/сут), которые выделяются с мочой. Этот процесс используется для регуляции КОС и сохранения в организме важнейших катионов Na+ и К+. Глутаминаза почек значительно индуцируется при ацидозе, ингибируется при алкалозе.
В клетках кишечника также под действием глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
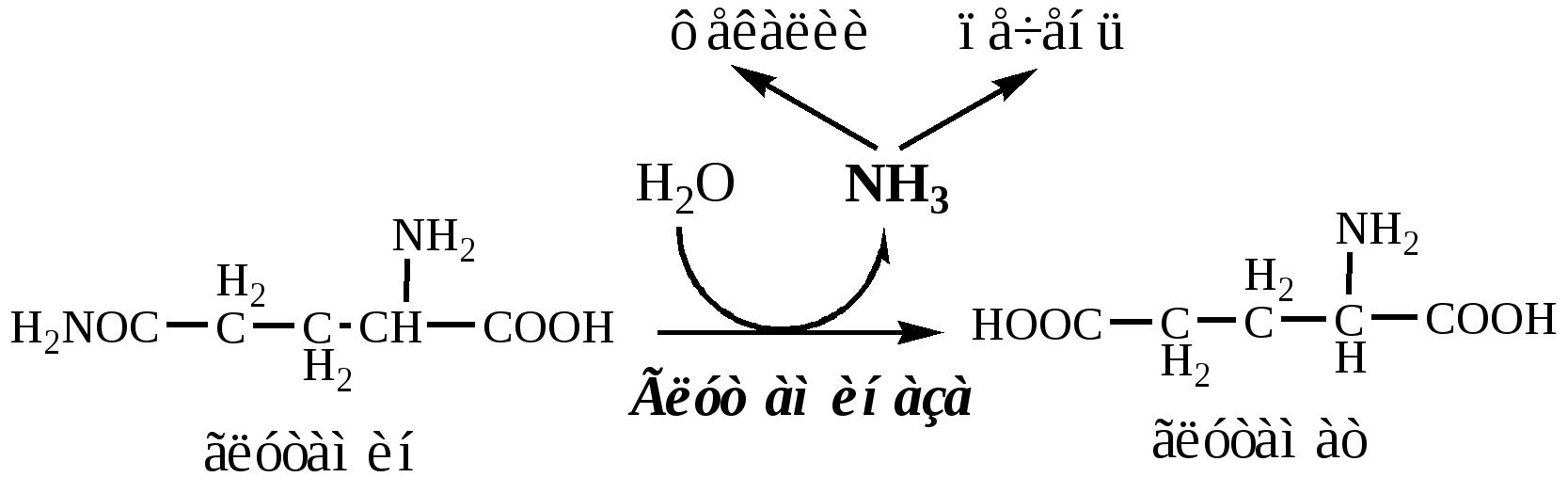
Образовавшийся аммиак поступает через воротную вену в печень или удаляется из организма с фекалиями.
Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин — основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений.
Обмен аспарагина
Обезвреживание аммиака в тканях происходит незначительно при синтезе аспарагина под действием глутаминзависимой и аммиакзависимой аспарагинсинтетазы.
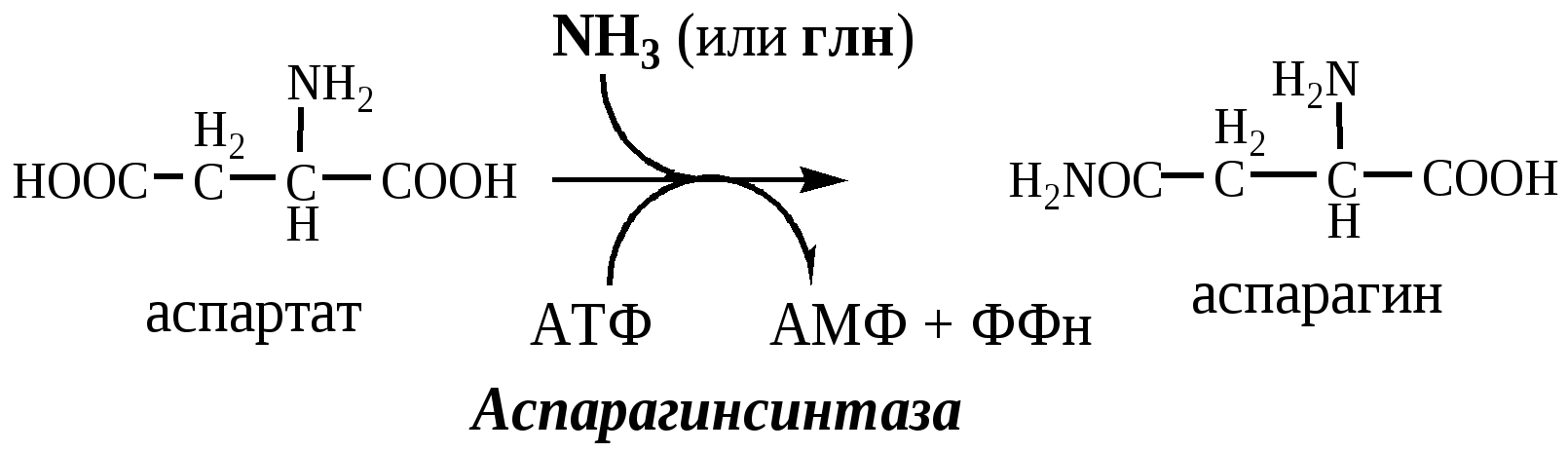
Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных.
Обмен аланина
Из мышц и кишечника избыток аминого азота выводится преимущественно в виде аланина.
В кишечнике:
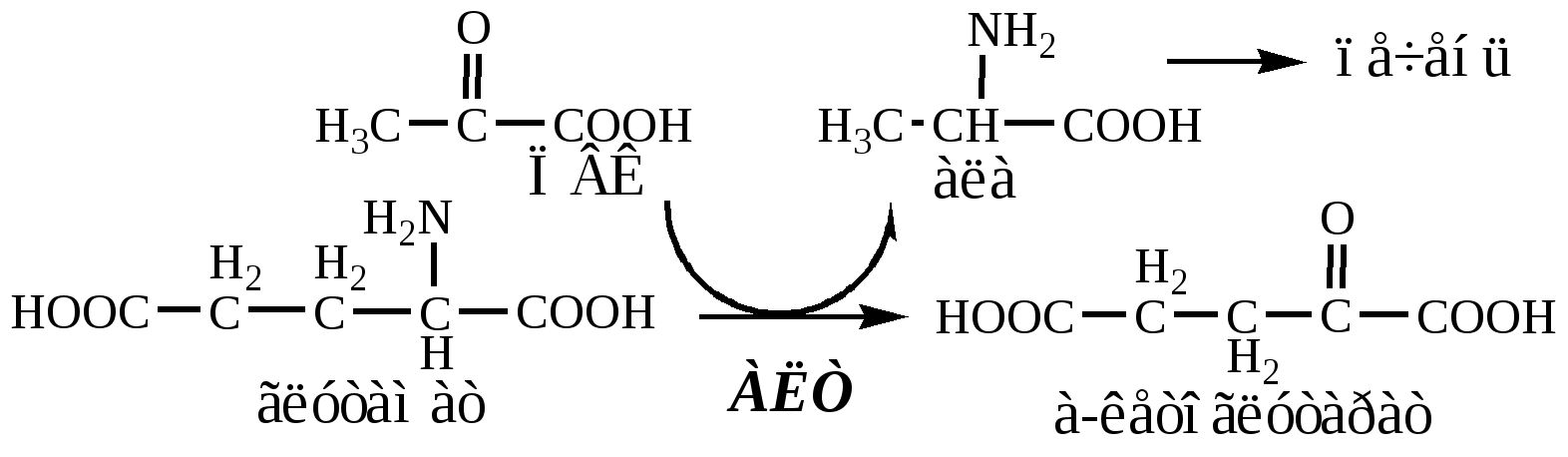
Глутамат подвергается трансаминированию с ПВК с образованием аланина и α-кетоглутарата. Аланин поступает из кишечника в кровь воротной вены и поглощается печенью.
В мышцах:
Образование аланина в мышцах, его перенос в печень связан с обратным переносом в мышцы синтезированной в печени глюкозы. Этот процесс называется глюкозо-аланиновый цикл:
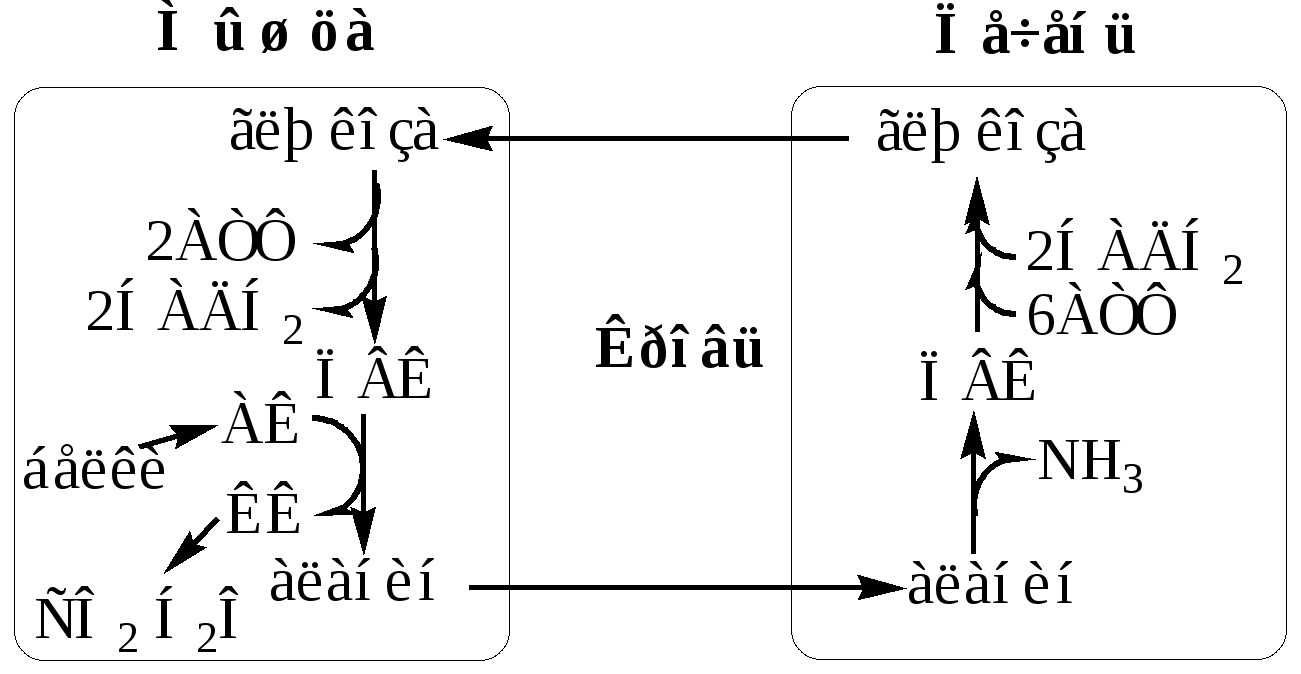
Он необходим, так как активность глу-ДГ в мышцах невелика и непрямое дезаминирование АК малоэффективно.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада АК. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак идет на синтез мочевины, а ПВК включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до ПВК.
ОРНИТИНОВЫЙ ЦИКЛ
Большая часть свободного аммиака, а также аминного азота в составе АК (в основном глутамин, аланин) поступают в печень, где из них синтезируется нетоксичное и хорошо растворимое в воде соединение — мочевина. Мочевина является основной формой выведения азота из организма человека.
Синтез мочевины происходит в цикле, который замыкается орнитином. Цикл открыли в 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт.
Мочевина (карбамид) — полный амид угольной кислоты — содержит 2 атома азота, один из аммиака, другой – из асп.
Реакции орнитинового цикла
Предварительно в митохондриях под действием карбамоилфосфатсинтетазы I с затратой 2 АТФ аммиак связывается с СО2 с образованием карбамоилфосфата:

(Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе пиримидиновых нуклеотидов).
1. В митохондриях орнитинкарбамоилтрансфераза переносит карбамоильную группу карбамоилфосфата на орнитин и образуется — цитруллин:
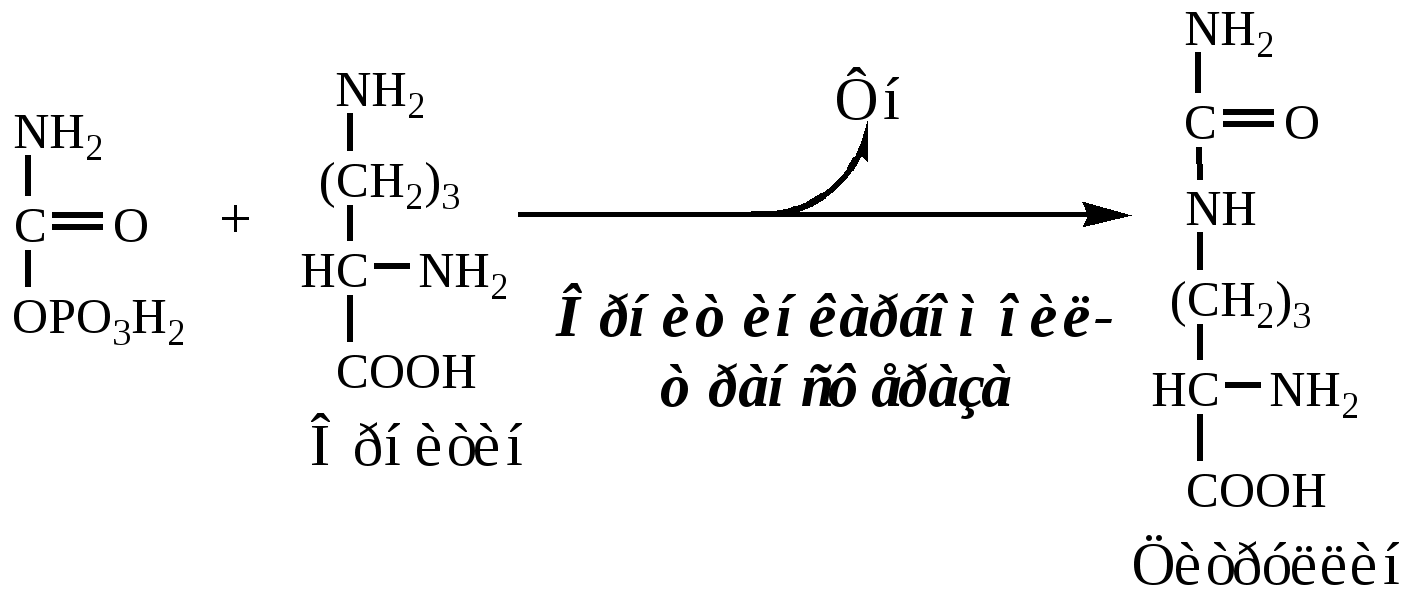
2. В цитозоле аргининосукцинатсинтетаза с затратой 1 АТФ (двух макроэргических связей) связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарная кислота). Фермент нуждается в Mg2+. Аспартат — источник второго атома азота мочевины.
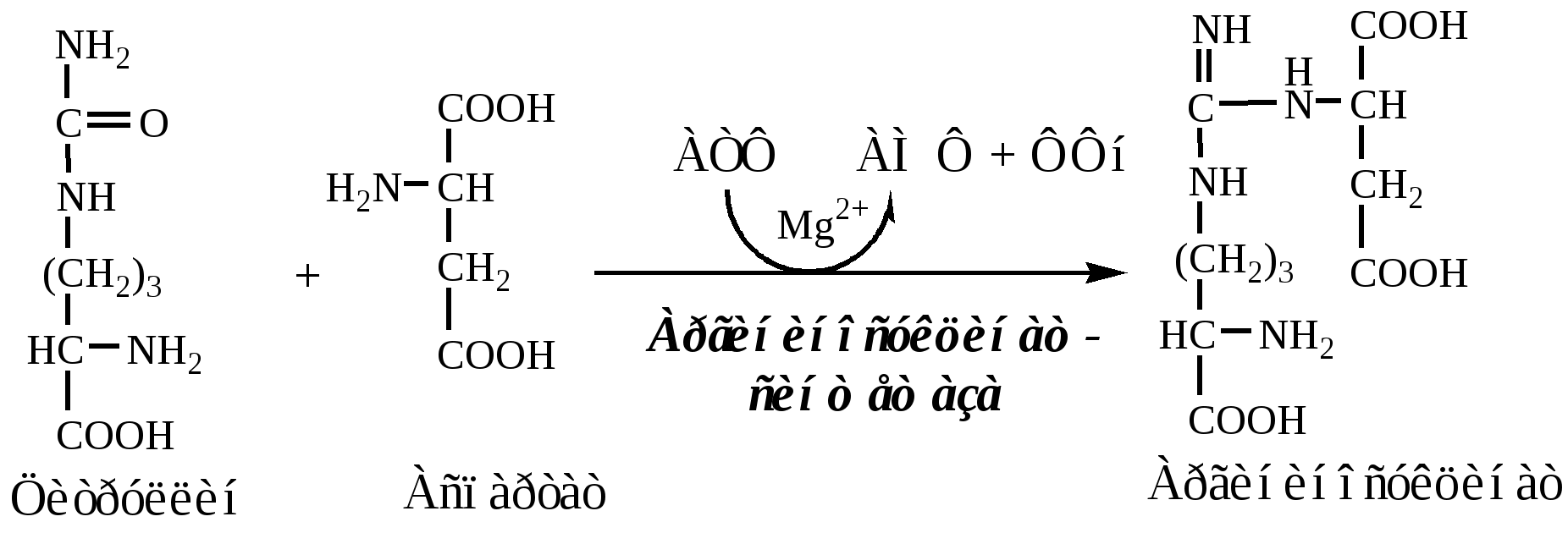
3. В цитозоле аргининосукцинатлиаза (аргининсукциназа) расщепляет аргининосукцинат на аргинин и фумарат (аминогруппа аспартата оказывается в аргинине).
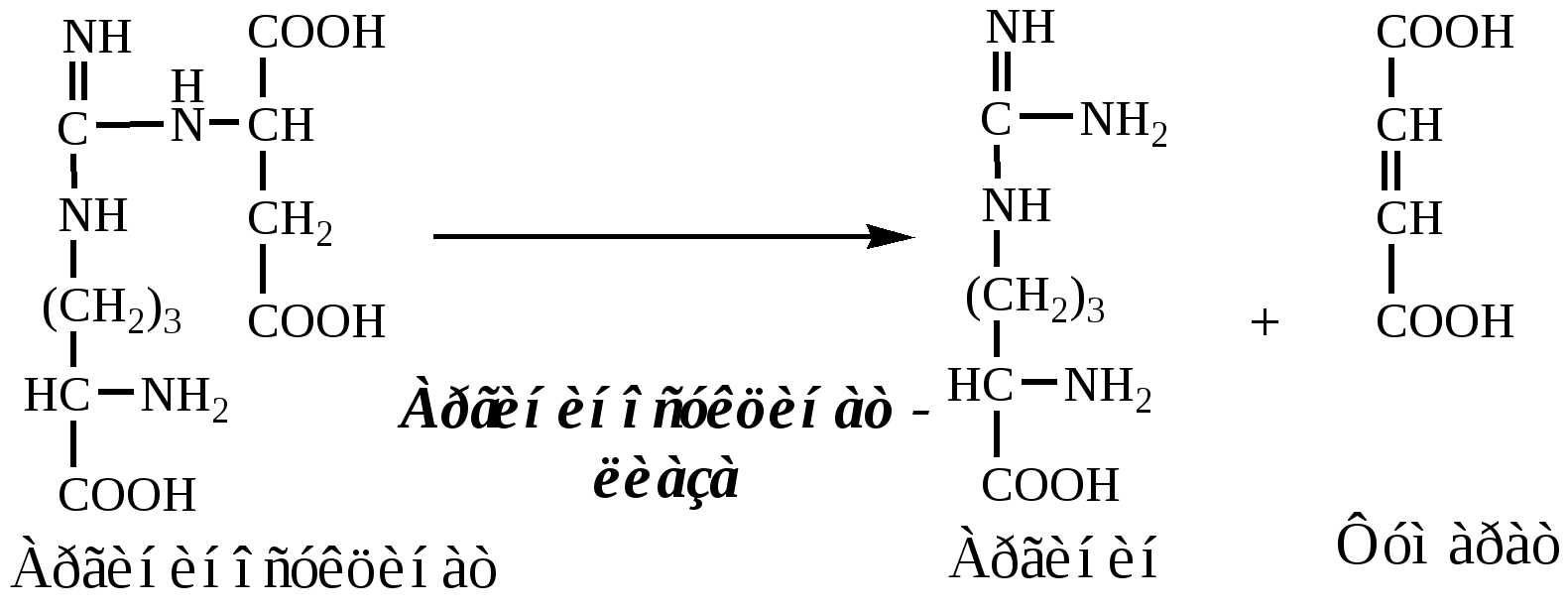
4. В цитозоле аргиназа гидролизует аргинин на орнитин и мочевину. У аргиназы кофакторы ионы Са2+ или Мn2+, ингибиторы - высокие концентрации орнитина и лизина.
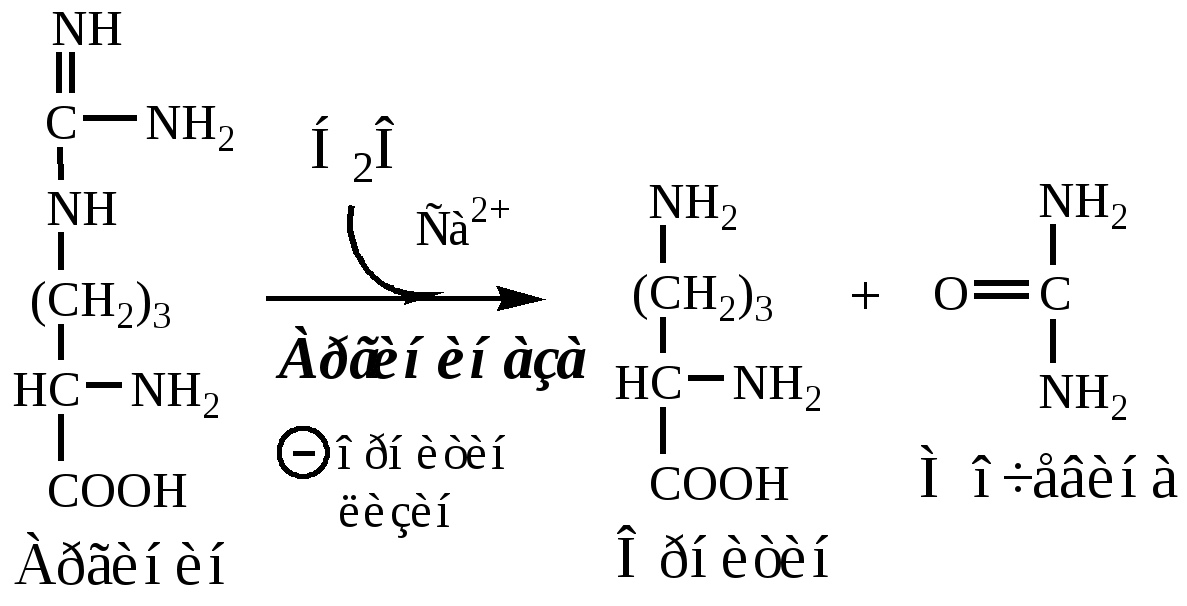
Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Регенерация аспартата из фумарата
Фумарат, образующийся в орнитиновом цикле, в цитозоле превращается в ЩУК, который переаминируется с аланином или глутаматом с образованием аспартата. Аланин поступает главным образом из мышц и клеток кишечника:
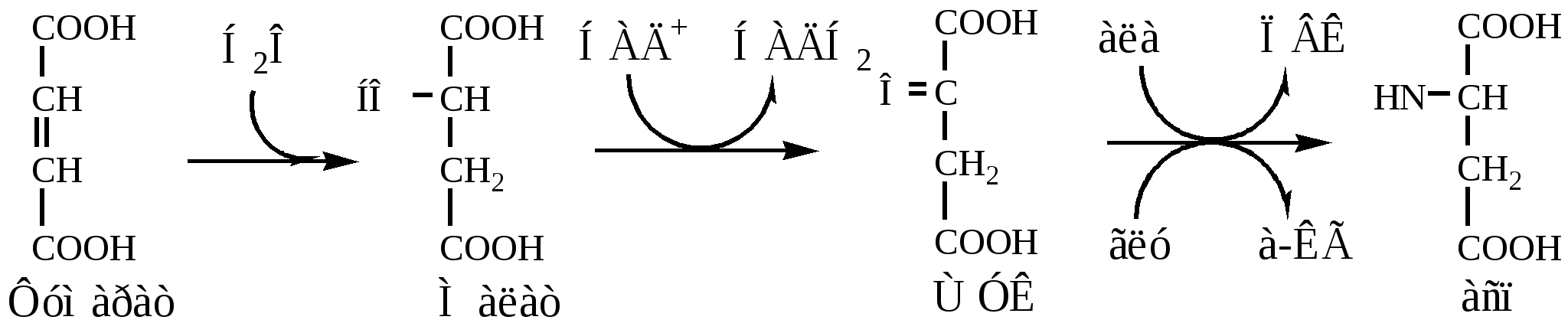
Малат может направиться в митохондрии и включиться в ЦТК.
Пируват, образующийся в этих реакциях из аланина, используется для глюконеогенеза.
Общее уравнение синтеза мочевины:
CO2 + NH3 + асп + 3 АТФ + 2 Н2О → мочевина + фумарат + 2АДФ + АМФ + 2Фн + ФФн
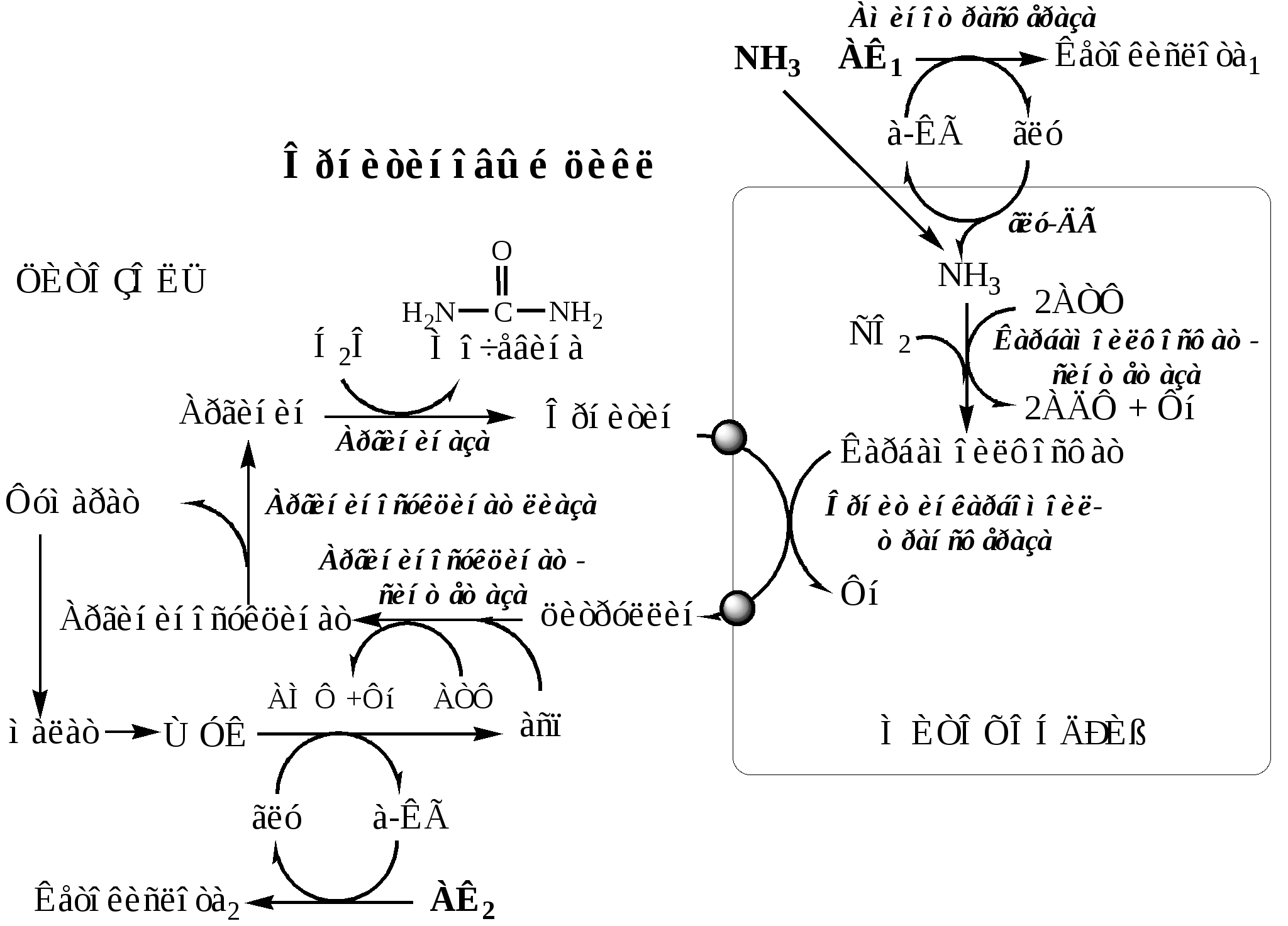
Энергетический баланс орнитинового цикла
На синтез 1 мочевины расходуются 4 макроэргических связи 3 АТФ. Дополнительные затраты энергии связаны с трансмембранным переносом веществ и экскрецией мочевины. Энергозатраты при этом частично компенсируются:
при окислительном дезаминировании глутамата образуется 1 молекула НАДН2, которая обеспечивает синтез 3 АТФ;
в ЦТК, при превращении малата в ЩУК образуется еще 1 молекула НАДН2, которая также обеспечивает синтез 3 АТФ;
Орнитиновый цикл в печени выполняет 2 функции:
превращение азота АК в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
синтез аргинина и пополнение его фонда в организме.
Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Отдельные же ферменты орнитинового цикла обнаруживаются в разных тканях. В энтероцитах, есть карбамоилфосфатсинтетаза I и орнитинкарбамоилтрансфераза, следовательно, может синтезироваться цитруллин. В почках есть аргининосукцинатсинтетаза и аргининосукцинатлиаза. Цитруллин, образовавшийся в энтероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гидролизуется аргиназой. Активность этих рассеянных по разным органам ферментов значительно ниже, чем в печени.
Выделение азота из организма
Азот выводиться из организма с мочой, калом, потом и с выдыхаемым воздухом в виде различных соединений. Основная масса азота выделяется из организма с мочой в виде мочевины (до 90%). В норме соотношение азотсодержащих веществ в моче составляет: мочевина 86%, креатинин 5%, аммиак 3%, мочевая кислота 1,5% и другие вещества 4,5%. Экскреция мочевины в норме составляет 25 г/сут, солей аммония 0,5 г/сут.
ГИПЕРАММОНИЕМИЯ
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови — гипераммониемию, что оказывает токсическое действие на организм.
Причинами гипераммониемии могут быть:
генетические дефекты ферментов орнитинового цикла в печени;
вторичное поражение печени в результате цирроза, гепатита или других заболеваний.
Известны пять наследственных заболеваний, обусловленные дефектом пяти ферментов орнитинового цикла.
Наследственные нарушения орнитинового цикла и их основные проявления
| Заболевание | Дефект фермента | Тип наследования | Клинические проявления | Метаболиты | |
| кровь | моча | ||||
| Гиперам-мониемия, тип I | Карбамоил-фосфат-синтетаза I | Аутосомно-рецессивный | В течение 24-48 ч после рождения кома, смерть | Глн Ала NH3 | Оротат |
| Гиперам-мониемия, тип II | Орнитин-карбамоил-трансфераза | Сцепленный с Х-хромосомой | Гипотония, снижение толерантности к белкам | Глн Ала NH3 | Оротат |
| Цитрул-линемия | Аргинино-сукцинат-синтетаза | Аутосомно-рецессивный | Гипераммониемия тяжёлая у новорождённых. У взрослых — после белковой нагрузки | Цитруллин NH3 | Цитруллин |
| Аргинино-сукцина-турия | Аргинино-сукцинатлиаза | Аутосомно-рецессивный | Гипераммониемия, атаксия, судороги, выпадение волос | Аргини-носукцинат NH3 | Аргини-носукци-нат, Глн, Ала, Лиз |
| Гиперар-гининемия | Аргиназа | Аутосомно-рецессивный | Гипераргининемия | Apг NH3 | Apг Лиз Орнитин |
Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников.
При гипераммониемиях I и II типа происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой.
Тяжесть течения заболевания зависит также от степени снижения активности ферментов.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака (до 6000 мкмоль/л),глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
тошнота, повторяющаяся рвота;
головокружение, тремор, судорожные припадки;
нечленораздельная речь;
потеря сознания, отёк мозга (в тяжёлых случаях);
отставание умственного развития (при хронической врождённой форме).
В тяжёлых случаях развивается кома с летальным исходом.
Все симптомы гипераммониемии — проявление действия аммиака на ЦНС.
Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени.
Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов АК в рацион и стимуляцию выведения аммиака в обход нарушенных реакций:
путём связывания и выведения NH3 в составе фенилацетилглутамина и гиппуровой кислоты. Пищевой фенилацетат при конъюгации с глутамином образует фенилацетилглутамин, а пищевой бензоат при конъюгации с глицином образует гиппуровую кислоту, которые потом выводится с мочой;
повышением концентрации промежуточных метаболитов цикла (аргинина, цитруллина, глутамата), образующихся вне блокируемых реакций. Введение больших доз цитруллина стимулирует синтез мочевины из аспартата. Большие дозы аргинина стимулируют регенерацию орнитина и выведение азота в составе цитруллина и аргининосукцината.
Обмен аминокислот и аммиака между тканями
Печень
В печень азот поступает в основном в виде аммиака, глутамина, аланина, а меньше в виде других АК в основном из мышц и кишечника. Поглощает АК с разветвленной цепью (вал, лей, иле). Синтезирует глюкозу в основном из аланина и серина.
Мышцы
Поглощают АК с разветвленной цепью (вал, лей, иле). Выделяют много аланина и глутамина меньше других АК.
Кишечник
Поглощает глутамин. Выделяет много аланина. С пищей из кишечника поступают все аминокислоты.
Мозг
Поглощает много АК с разветвленной цепью (вал, лей, иле). Выделяет много глутамина.
Почки
Поглощают глутамин. Выделяют много серина и немного аланина.
ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ
Некоторые АК и их производные могут подвергаться декарбоксилированию – отщеплению α-карбоксильной группы. У млекопитающих декарбоксилируются: три, тир, вал, гис, глу, цис, арг, орнитин, SAM, ДОФА, 5-окситриптофан и т.д. Реакцию необратимо катализируют декарбоксилазы, которые содержат в активном центре пиридоксальфосфат. Механизм реакции похож на реакцию переаминирования.
Продуктами реакции являются СО2 и биогенные амины, выполняющие регуляторные функции (гормоны, тканевые гормоны, нейромедиаторы).
Серотонин
Серотонин образуется из три в надпочечниках, ЦНС и тучных клетках.
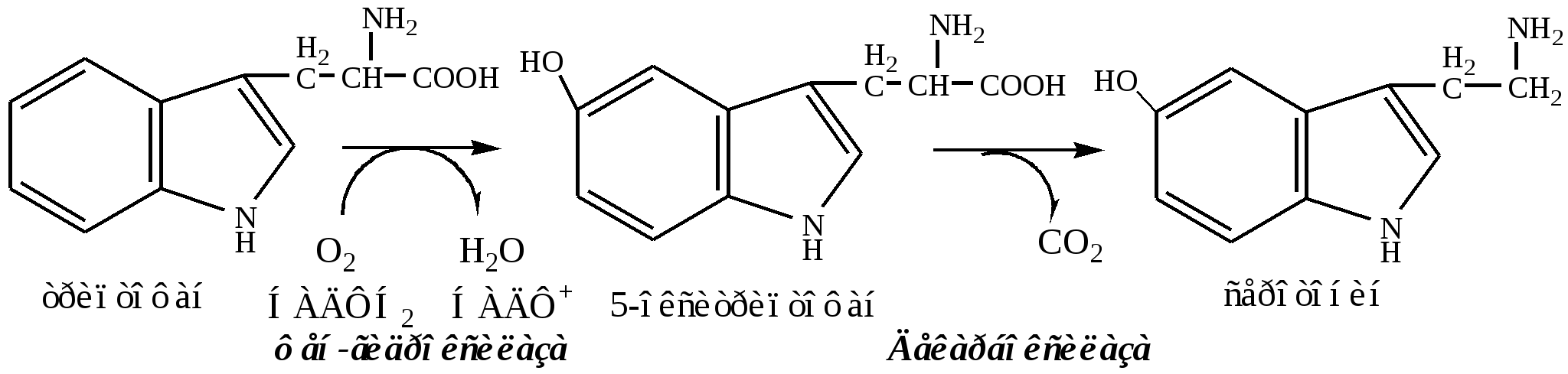 Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.
Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.ГАМК
ГАМК образуется и разрушается в ГАМК-шунте ЦТК в высших отдела мозга. Он имеет очень высокую концентрацию.
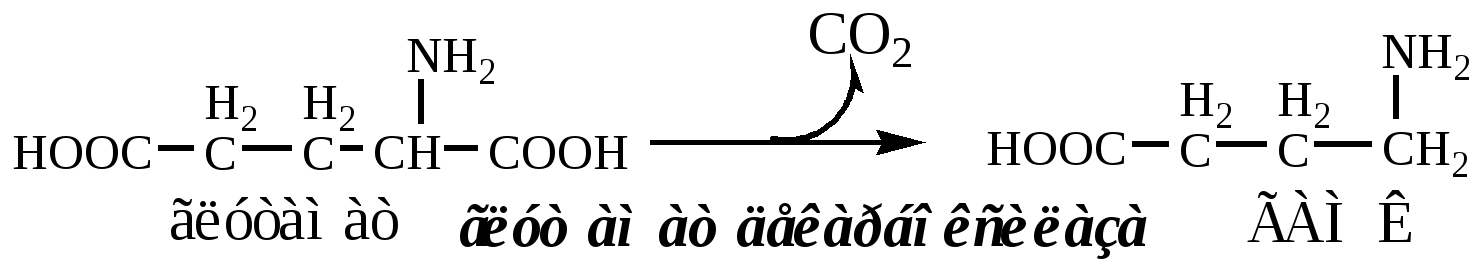
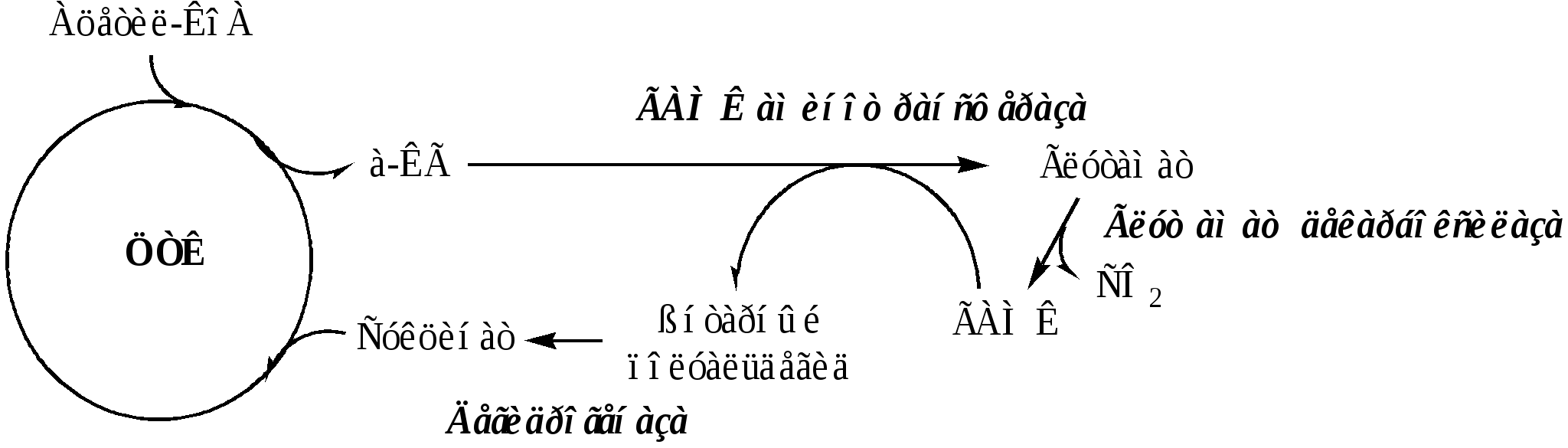
ГАМК – тормозной нейромедиатор (повышает проницаемость постсинаптических мембран для К+), повышает дыхательную активность нервной ткани, улучшает кровоснабжение головного мозга.
Гистамин
Гистамин образуется в тучных клетках. Секретируется в кровь при повреждении ткани, развитии иммунных и аллергических реакций.
Гистамин – медиатор воспаления, аллергических реакций, пищеварительный гормон:
стимулирует секрецию желудочного сока, слюны;
повышает проницаемость капилляров, расширение сосудов, покраснение кожи, вызывает отеки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль);
сокращает гладкую мускулатуру легких, вызывает удушье;
вызывает аллергическую реакцию;
нейромедиатор;
медиатор боли.
Дофамин
Дофамин образуется (фен → тир → ДОФА → дофамин) в мозге и мозговом веществе надпочечников.
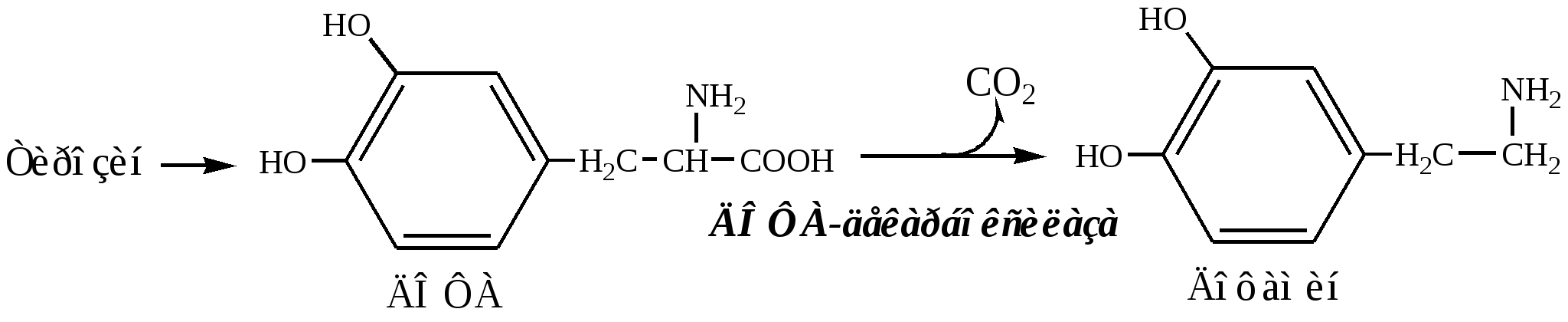
Дофамин – нейромедиатор среднего отдела мозга.
ЛЕКЦИЯ № 19
